梅PmARF17克隆及其在花发育中与内源激素的调控模式
2021-07-21李艳林ShahidIqbal侍婷宋娟倪照君高志红
李艳林,Shahid Iqbal,侍婷,宋娟,倪照君,高志红
梅克隆及其在花发育中与内源激素的调控模式

1南京农业大学园艺学院,南京 210095;2江苏省农业科学院,南京 210014
【】分析梅的生物学功能,探究梅花发育进程中其表达丰度与内源激素动态变化的关系,为梅花发育的调控研究提供依据。以梅品种‘大嵌蒂’为试材,克隆,利用生物信息学软件分析基因结构、系统进化及其与其他物种同源蛋白的差异;亚细胞定位确定PmARF17蛋白在细胞中作用的部位;以梅品种‘大嵌蒂’和‘龙眼’不同发育阶段的花芽、叶芽、花器官为试材,利用qRT-PCR检测时空表达模式,通过UPLC法测定IAA、GA3、ABA、ZT含量的动态变化,并与的表达进行相关性分析;克隆启动子,分析启动子的顺式作用元件,利用瞬时表达解析与GA3的调控模式。从梅品种‘大嵌蒂’中克隆得到,系统进化树分析表明PmARF17蛋白与其他植物的ARF蛋白序列高度同源;亚细胞定位表明其作用于细胞核和细胞膜上;qRT-PCR表达和内源激素含量的相关性分析表明,的表达与IAA含量的变化趋势没有明显的相关性。在雌蕊完好花芽中的表达水平相对不完全花芽显著上调,而GA3含量与的表达趋势一致。ABA和ZT含量总体上与的表达呈相反的趋势,表明两者可能抑制的表达。启动子含有GA顺式元件,且具有启动活性和组织表达特异性,在花瓣、雄蕊及根部特异表达。可能是梅花发育的正调控基因,促进梅雌蕊的正常发育。的表达可能受到GA3的正调控,其可能通过作用于雄蕊和花瓣,进而影响梅的雌蕊发育进程。
梅;生长素响应因子;雌蕊发育;基因表达;内源激素;瞬时表达
0 引言
【研究意义】梅(Sieb. et Zucc)原产于中国,其果实营养丰富,具有很高的加工价值和保健功能。然而梅雌蕊败育现象严重,并且严重影响果梅产量,限制了果梅的增产、创收[1]。研究表明,雌蕊败育现象和自身的调控基因有重要的关系[2],植物生长素响应因子(auxin response factor,ARF)在雌蕊等花器官生长发育中起到重要的调控作用[3-4]。花的发育与植物激素之间存在一定的关系[5-8]。ARF与植物激素在梅花雌蕊发育中的调控机制尚未明确,本研究可为果梅生产难题的克服及雌蕊败育作用机理的探明提供重要参考。【前人研究进展】植物ARF属于一种可以调节生长素响应基因表达的新转录因子家族[9]。功能多样,一些可以作为生长素信号通路中的生长素受体调节生长素诱导的基因转录[10-11]。Song等[12]在梅ARF家族进化分析中发现,与拟南芥聚为一类,为直系同源基因,具有相似的保守功能。而不仅可以在生长素信号传导过程中独立起作用,还可能与、、等相互作用,从而影响雌蕊原基的形态建成,进而影响雌蕊发育[13-16]。研究表明,影响梅花发育的主要因素是营养素、植物激素和钙调蛋白[17],ARF可能会在植物生长素信号传导途径中影响某些植物激素,如ARF与赤霉素(GA)影响番茄果实的萌发和发育[18-19]。研究表明,生长素在生物合成水平上或通过促进DELLA的降解与GA正向相互作用[20-23];ABA和CTK都与GA拮抗,参与多种发育过程的调节[24]。目前,在许多物种中已经进行了花发育与植物激素之间相互作用模式的研究,如玉米[25]、小麦[26]、榨菜[27]、油菜[28]、荔枝[29-30]、白桦[31]、罗汉果[32]等。植物启动子起着决定基因活性的“开关”作用,通过与转录因子结合来间接控制基因的活性。启动子含有多种重要的顺式作用元件,在转录水平上参与调节下游基因的表达,从而使植物能够抵抗外部环境胁迫。因此,对植物启动子的功能研究有助于阐明植物信号转导途径和调控机制[33]。【本研究切入点】笔者课题组前期在梅ARF家族进化分析研究中推测在梅雌蕊发育中可能起到重要的调控作用,而ARF与植物激素在梅花雌蕊发育中的调控机制尚未明确,是否参与了梅雌蕊败育及其调控方式有待研究。【拟解决的关键问题】探究的结构特征及其在梅花不同时期花芽、花器官中的时空表达模式;与IAA、GA3、ABA、ZT内源激素在梅雌蕊发育中的调控模式及对雌蕊发育的影响;分析启动子的顺式元件及组织特异性表达部位,探究与GA3存在的调控模式。
1 材料与方法
1.1 材料及处理
试验材料为梅品种‘大嵌蒂’和‘龙眼’,均处于盛果期。盛花期梅品种‘大嵌蒂’的不完全花比例高达76.3%,雌蕊败育现象严重,是研究梅雌蕊败育机制的重要材料;‘龙眼’雌蕊发育良好,败育率低,是研究梅雌蕊败育机制的重要对照材料[34]。采集‘大嵌蒂’和‘龙眼’2017年9月20日、10月20日、11月20日、12月20日、2018年1月20日的花芽和叶芽(花芽与叶芽区分方法:花芽饱满、较大,位于中间;叶芽较小,位于两侧);于2018年2月3日采集‘大嵌蒂’雌蕊完好、雌蕊缺失、雌蕊褐色、雌蕊畸形4种类型花芽;于2018年3月13日采集‘大嵌蒂’成熟花器官,主要有完全花的雌蕊、雄蕊、花瓣、萼片,不完全花的雄蕊、花瓣、萼片,共计7种成熟花器官(此处不完全花为雌蕊缺失的花)。在体视显微镜下观察雌蕊发育完整与否,进而分离获得4种类型花芽及7种成熟花器官。
本氏烟草()用于基因亚细胞定位;刚开花的拟南芥苗()用于启动子的瞬时表达试验。
1.2 PmARF17及其启动子的克隆和生物信息学分析
根据梅基因组测序数据库基因序列Pm031349及真核生物启动子在线预测软件UCSC: http://genome. ucsc.edu/确定启动子的分布区域为CDS编码区上游,在其预测所得CDS编码区上游序列选取约2 000 bp。引物分别设计为gene-F、gene-R及promoter-F、promoter-R(表1),以梅品种‘大嵌蒂’11月份花芽cDNA和总DNA为模板,利用高保真酶进行PCR扩增,扩增体系为25 µL:5×PrimerSTAR GXL Buffer (5 µL)、dNTP Mixture(2 µL)、PrimerSTAR GXL DNA Polymerase(0.5 µL)(Takara)、ddH2O(14 µL)、上下游引物各0.5 µL、cDNA/稀释DNA模板2.5 µL。扩增程序为:98℃ 5 min;98℃ 10 s,56℃ 15 s,68℃ 150 s,35个循环;68℃ 10 min;4℃保存。胶回收后与pClone007 Blunt Simple Vector(TSINGKE)连接、转化大肠杆菌DH5α,筛选阳性克隆并测序。
使用GSDS(http://gsds1.cbi.pku.edu.cn/)在线工具对进行基因结构分析,并绘制基因结构图;通过ProtParam和ExPASy软件分析PmARF17蛋白的基本理化特性;使用DNAMAN 9.0和ClustalX 2.1软件进行氨基酸的多序列比对和同源性分析;保守的蛋白质结构域通过在线软件Pfam和PROSTIE分析;通过MEGA 6.0软件构建PmARF17蛋白的系统发育进化树;使用在线软件TSSP及PlantCARE分析克隆所得的启动子顺式元件。

表1 引物序列及用途
下划线部分为酶切位点 The underlined base sequences in the primers represent corresponding restriction enzyme site
1.3 PmARF17蛋白的亚细胞定位
将的CDS序列插入pCAMBIA1302载体,选择在该载体CaMV35S强启动子与mGFP5序列标签之间插入。采用II单酶切体系,载体构建如图3-A。引物设计为PmARF17 GFP-F、PmARF17 GFP-R(表1)。用高保真酶进行PCR扩增,扩增程序及体系与1.2一致。测序正确后进行II单酶切验证,从而获得正确的植物融合表达载体pCAMBIA1302--GFP。将pCAMBIA1302(空载体)和pCAMBIA1302--GFP分别转化GV3101农杆菌感受态细胞,分别注入烟草叶片下表皮细胞。采用激光扫描共聚焦(Zeiss,德国)显微镜观察PmARF17蛋白在细胞中的定位。
1.4 PmARF17在花发育中的表达分析
采用实时荧光定量PCR(qRT-PCR)测定在‘大嵌蒂’和‘龙眼’花芽、叶芽、成熟花器官中的表达水平,其中设置叶芽是为了与同时期花芽中的表达形成对照,从侧面表现出在花芽中的表达特点(下文中叶芽中激素水平测定与此同理)。的qRT-PCR引物设计为:qPCR-F,qPCR-R(表1)。以梅为内参基因,引物设计为:-F、-R(表1)[35]。荧光定量PCR仪(ABI 7500)产自美国,实时荧光定量体系参照SYBR PrimeScript RT-PCR Kit(TaKaRa Ⅱ,日本)试剂盒说明书,各样品cDNA浓度均严格控制在200 ng∙µL-1,20 μL反应体系为:95℃4 min;95℃ 20 s,60℃ 20 s,72℃ 40 s,35个循环。每处理进行3次生物学重复和3次平行样重复,数据分析采用ABI7500 system软件2-ΔΔCt方法(∆Ct=Ct-Ct)进行分析计算。
1.5 梅花发育过程中内源激素的提取及测定
采用ACQUITY H-Class UPLC超高效液相色谱系统(Waters公司)测定梅不同时期不同类型花芽、叶芽、不同成熟花器官中IAA、GA3、ABA、ZT内源激素的含量[36-38]。植物激素IAA(纯度>98%)、GA3(纯度>98%)、ABA(纯度>98%)、ZT(纯度>98%)均购自于上海源叶生物科技有限公司,色谱甲醇、乙睛(色谱纯)、磷酸和乙酸乙酯(分析纯)均为Sigma公司产品,超纯水由Milli-Q系统制备。
参照前人研究方法[39-40]提取和测定梅花芽、叶芽及不同花器官中的激素。将IAA、GA3、ABA、ZT激素分别配制浓度为0.01、0.02、0.05、0.1和0.2 mg∙L-1的标样,并绘制标准曲线。使用ACQUITY H-Class UPLC超高效液相色谱测定标样和样品激素含量。
1.6 PmARF17启动子的瞬时表达载体构建及功能分析
用启动子定向替换载体pBI121上能够启动进行表达的CaMV 35S序列,与融合,构建pBI121-promoter-GUS融合表达载体。分别选择I、I作为上、下游酶切位点,克隆引物设计为Promoter-I-F,Promoter-I-R(表1),PCR扩增程序及体系同上。分别将测序和酶切正确的pBI121-promoter- GUS重组质粒、pBI121空载体转化EHA105农杆菌感受态细胞,将转化成功的EHA105菌液重悬,分别侵染拟南芥植株,进行瞬时表达和GUS组织化学染色,根据顺式元件分析及GUS染色结果研究该启动子的功能。
该瞬时表达试验及GUS染色过程为:①选择盛花期拟南芥苗;②将待侵染的拟南芥苗根部清洗干净;③使用悬浮液侵染;④25℃、60 r/min下震荡培养48 h,当OD600=1时,更换新的菌液和悬浮液;⑤加入GUS染液进行组织化学染色;⑥GUS染色过夜(约10 h)及脱色处理。
1.7 数据处理
使用Excel 2003软件统计荧光定量表达及激素测定数据,并绘制相应图表。使用SPSS13.0软件进行样本间差异显著性分析和相关性分析。
2 结果
2.1 PmARF17及其启动子的克隆和分析
测序表明,获得的cDNA片段大小为2 342 bp,CDS区最大开放阅读框ORF全长为2 160 bp,编码719个氨基酸。测序所得基因全长为4 546 bp(图1-A)。结构绘制如图1-C,包含11个外显子,10个内含子。
Pfam及PROSTIE分析表明,PmARF17的N端在第143—244位氨基酸处具有高等植物转录因子特有的B3-DNA binding domain结合域,在第270—350位具有Auxin response factor元件,未发现Aux-IAA结构域。与拟南芥为直系同源基因,具有相似的保守功能[12],而不仅可以在生长素信号传导过程中独立起作用,还可能与、、等相互作用,从而影响雌蕊原基的形态建成[15]。约1/4的梅PmARF蛋白缺少C末端Aux-IAA结构域[12],水稻[41]和番茄[42]中同样有类似的报道,表明可能与拟南芥类似,具有独立于生长素的信号转导途径。PmARF17蛋白与其他植物的生长素响应因子蛋白序列相似度很高。其中与山杏和桃的相似度最高,达98%,与甜樱桃和豆樱相似度达97%,与苹果、白梨相似度达84%(图1-B)。PmARF17 N端及C端蛋白序列较为保守,与其他植物ARF蛋白相似度高,具有ARF家族的保守结构域(图1-D)。为梅生长素响应因子基因,属于生长素响应因子超家族。

A:PmARF17的cDNA和推导的氨基酸序列(下划线标出最大ORF,阴影为保守区);B:PmARF17蛋白与其他植物的系统进化树分析;C:PmARF17的基因结构;D:PmARF17蛋白与其他植物的同源性比较[蓝色框为B3 DNA binding domain,红色框为Auxin response factor元件。1.Seq:梅;2.Seq:山杏;3.Seq:桃;4.Seq:甜樱桃;5.Seq:苹果;6.Seq:白梨;7.Seq:葡萄;8.Seq:野草莓;9.Seq:杨树;10.Seq:拟南芥;11.Seq:烟草;12.Seq:番茄]
启动子含有多种顺式作用元件,在转录水平上参与调节下游基因的表达,对植物启动子的功能研究有助于阐明植物信号转导途径和调控机制。PlantCARE软件分析表明启动子含有赤霉素GA作用元件GARE基序,如图2所示。
2.2 PmARF17蛋白的亚细胞定位
融合表达载体pCAMBIA1302--GFP构建如图3-A所示。pCAMBIA1302空载在细胞膜、细胞核、细胞质中均有分布,而PmARF17蛋白仅在细胞核和细胞膜上表达(图3-B、C),表明PmARF17蛋白是细胞核和细胞膜兼有的功能蛋白。
2.3 PmARF17在梅花发育中的表达分析
2.3.1在‘大嵌蒂’和‘龙眼’不同时期的花芽和叶芽中的表达 通过败育现象严重的梅品种‘大嵌蒂’和发育完好的‘龙眼’花芽和叶芽中的表达量对比发现(图4-A、B),在‘大嵌蒂’和‘龙眼’11月花芽中的表达显著上调,在12月、1月花芽中表达均显著下调。而该基因在‘大嵌蒂’11月、12月、1月花芽中的表达水平高于‘龙眼’。在雌蕊发育良好的‘龙眼’中,在其不同时期的花芽和叶芽中的表达水平变化基本一致;而败育严重的‘大嵌蒂’不同时期的花芽和叶芽,表达水平变化不一致。表明在‘大嵌蒂’11月、12月、1月花发育中可能起到重要的调控作用。
2.3.2在‘大嵌蒂’不同雌蕊形态花芽中的表达 为探明在梅花发育进程中所发挥的功能,选取败育现象严重、不完全花比例高达76%的梅品种‘大嵌蒂’为试材进行研究。qRT-PCR检测发现,在雌蕊完好花芽中表达显著高于雌蕊缺失、褐色、畸形的花芽(图4-C),表明可能会促进‘大嵌蒂’的雌蕊发育,一定程度减轻梅雌蕊败育现象,可能是梅雌蕊发育的正调控基因。
2.3.3在‘大嵌蒂’不同成熟花器官中的表达 为进一步研究在梅花败育中的调控模式,选取‘大嵌蒂’不同成熟花器官进行qRT-PCR表达检测(图4-D)(不完全花为雌蕊缺失的花芽)。结果表明,相较于完全花雌蕊,除不完全花雄蕊外,其余花器官(完全花雄蕊、花瓣、萼片;不完全花花瓣、萼片)表达均处于显著的下调模式。由此说明可能在完全花雌蕊发育中发挥着重要作用。在不完全雄蕊中的表达极显著高于完全花雌蕊和雄蕊,表明对于梅雄蕊的发育可能也起到重要的调控作用,可能通过调控雄蕊的生长影响梅的花发育及雌蕊发育进程。此外,与完全花相比,在不完全花瓣中表达较高,在不完全花萼中表达较低,具体作用机制有待进一步探明。

A:PmARF17启动子的植物激素作用元件;B:PmARF17启动子的顺式作用元件

A:pCAMBIA1302-PmARF17-GFP重组载体的结构;B:pCAMBIA1302-GFP空载;C:pCAMBIA1302-PmARF17-GFP融合表达载体。左图为荧光,中间为明场,右图为合并图像(标尺长度=20 000 nm)
2.4 PmARF17在梅花发育中的表达与内源激素含量变化的相关性分析
2.4.1‘大嵌蒂’和‘龙眼’花芽、叶芽中内源激素含量与表达分析 检测两品种不同时期花芽和叶芽中的IAA、GA3、ABA、ZT激素含量变化,并与的表达进行相关性分析。如图5-A、B所示,‘大嵌蒂’和‘龙眼’在9月至次年1月花芽、叶芽中IAA含量变化与的表达没有明显的规律,花芽中IAA含量及的表达总体高于叶芽,说明IAA和在花芽中起到重要作用。‘大嵌蒂’11月、12月、1月花芽中GA3含量均高于‘龙眼’11月、12月、1月花芽,且11月差别最大。在‘大嵌蒂’11月花芽中的表达显著上调,而此时GA3含量也相对较高,但12月的表达和GA3含量均下降。的表达水平与GA3含量的变化趋势总体一致。‘大嵌蒂’11月花芽中ABA含量有所降低,而在此时期表达显著上调,且花芽ABA含量总体高于叶芽。对于‘龙眼’,仅在其12月、1月花芽中检测到较高含量的ABA,其余花芽、叶芽各时期ABA含量均较低。在‘大嵌蒂’和‘龙眼’12月、1月花芽中表达显著下调,而此时ABA显著增加。可知,在梅的花发育中,ABA含量的变化与表达总体呈现相反趋势。‘大嵌蒂’和‘龙眼’叶芽中ZT含量及趋势一致,差异较小,而花芽中含量有较大差异。在11月的‘大嵌蒂’花芽中表达显著上调并达到峰值,而同时,ZT含量处于最低水平;在‘大嵌蒂’和‘龙眼’11月、12月花芽中表达显著下调,此时ZT含量均升高。可知,和ZT在梅花生长发育过程中呈现相反的作用趋势。
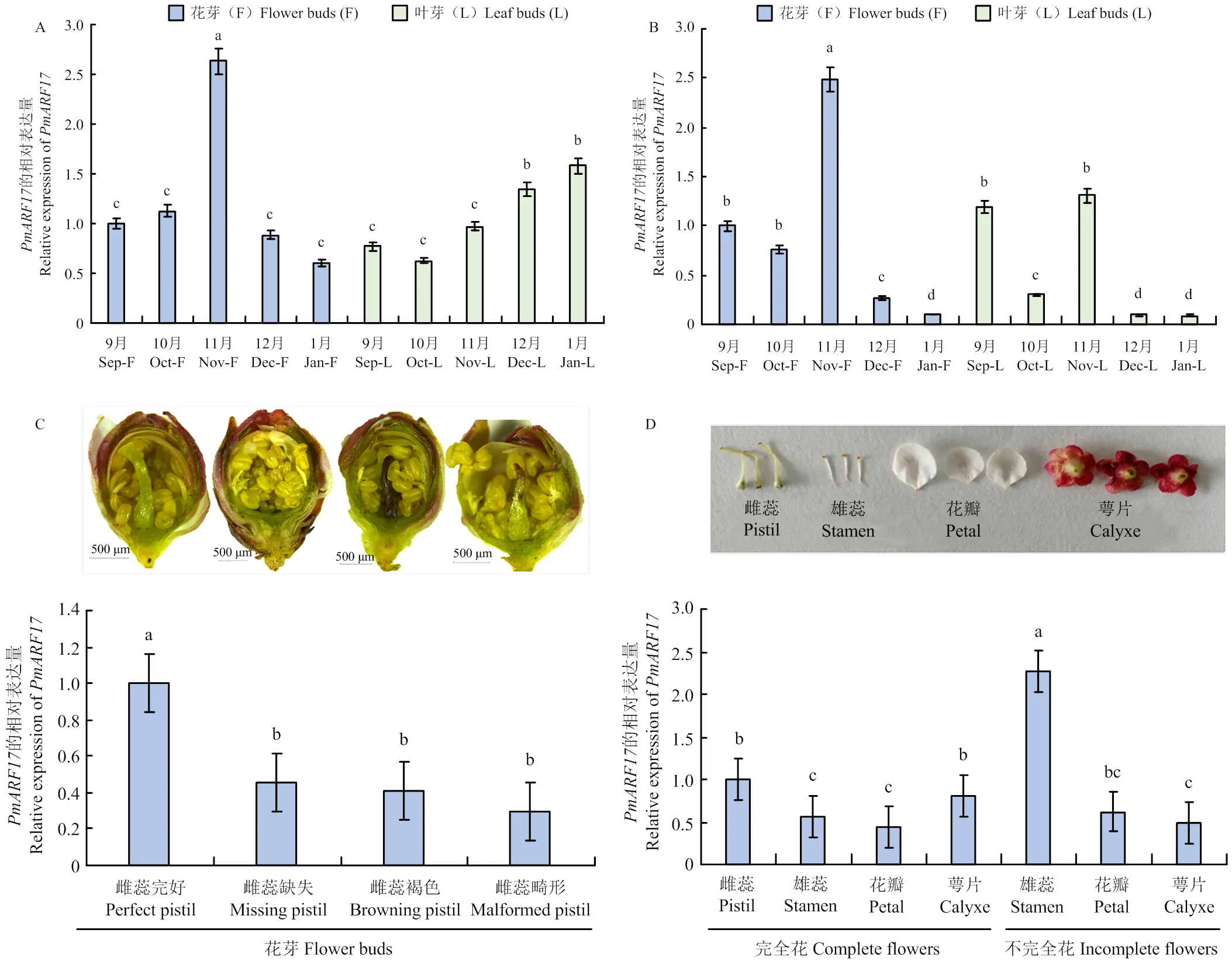
A:PmARF17在‘大嵌蒂’9月至1月花芽和叶芽中的表达;B:PmARF17在‘龙眼’9月至1月花芽和叶芽中的表达;C:PmARF17在‘大嵌蒂’不同雌蕊形态花芽中的表达;D:PmARF17在‘大嵌蒂’不同成熟花器官中的表达
2.4.2‘大嵌蒂’不同雌蕊形态花芽中内源激素含量与表达分析 在雌蕊缺失的花芽中,IAA、GA3、ABA和ZT的含量均最低,而在其他雌蕊形态的花芽中含量相近,说明雌蕊是这些激素的重要作用部位。在完好、缺失、褐色、畸形4种雌蕊形态花芽中,IAA、ABA和ZT的含量变化趋势非常相似,与的表达无显著关系。而该4种雌蕊形态的花芽中GA3含量普遍较低,与的表达趋势基本一致(图6-A)。由此可见,与GA3之间可能存在着正调控关系。
2.4.3‘大嵌蒂’不同成熟花器官中内源激素含量与表达分析 如图6-B,IAA含量在雌蕊完好花芽中最低,在完全花雄蕊中达到最高。完全花雄蕊和花瓣中IAA含量均显著高于不完全花雄蕊和花瓣,说明IAA可能在‘大嵌蒂’雄蕊和花瓣的生长中起重要作用。然而,在完全花雄蕊和花瓣中的表达均低于不完全花的雄蕊和花瓣,表明和IAA在此时有相反的作用趋势。GA3在完全花雌蕊中含量最高,并且在完全花和不完全花的花瓣、雄蕊中相对较高,在花萼中最低。表明GA3可能在‘大嵌蒂’雌蕊、花瓣、雄蕊的生长发育中起着重要作用。此外,在完全花雌蕊中高表达,而完全花雌蕊中GA3含量最高;完全花雄蕊中的表达低于不完全花雄蕊,GA3含量在这些情况下也有相同的趋势。但对于完全花和不完全花的花瓣,GA3含量与的表达不一致,可能受到其他基因或物质的影响。可知,在梅成熟花器官中的表达与GA3含量变化趋势总体一致。‘大嵌蒂’7种成熟花器官中ABA含量均处于较低水平,ABA含量的变化趋势与的表达没有明显的相关性。完全花雌蕊中ZT含量最高,其次是花萼,花瓣含量较低,而完全花和不完全花的雄蕊最低。同时,在不完全花的雄蕊中表达量最高,在雄蕊、花瓣、花萼等成熟器官中表达量与ZT含量呈相反的趋势;对于完全花的雄蕊和花瓣,的表达和ZT含量也呈现相反的趋势。但在完全花的雌蕊和花萼中,和ZT则表现出一致的趋势,这可能是由其他原因引起。由此可知,在梅成熟花器官的表达,总体上与ZT含量变化呈相反趋势。
A:‘大嵌蒂’不同时期花芽和叶芽中IAA、GA3、ABA、ZT的含量与的表达;B:‘龙眼’不同时期花芽和叶芽中IAA、GA3、ABA、ZT的含量与的表达。*表示<0.05,**表示<0.01。下同
A: IAA, GA3, ABA, ZT contents and theexpression of flower buds and leaf buds at different periods of the aborted Daqiandi; B: IAA, GA3, ABA, ZT contents and theexpression of flower buds and leaf buds at different periods of well-developed Longyan. * indicatesignificant difference (<0.05), and ** indicate extremely significant difference(<0.01). The same as below
图5‘大嵌蒂’和‘龙眼’不同时期花芽和叶芽中激素与表达的关联分析
Fig. 5 Correlation analysis between hormones andexpression of flower buds and leaf buds at different periods of Daqiandi and Longyan
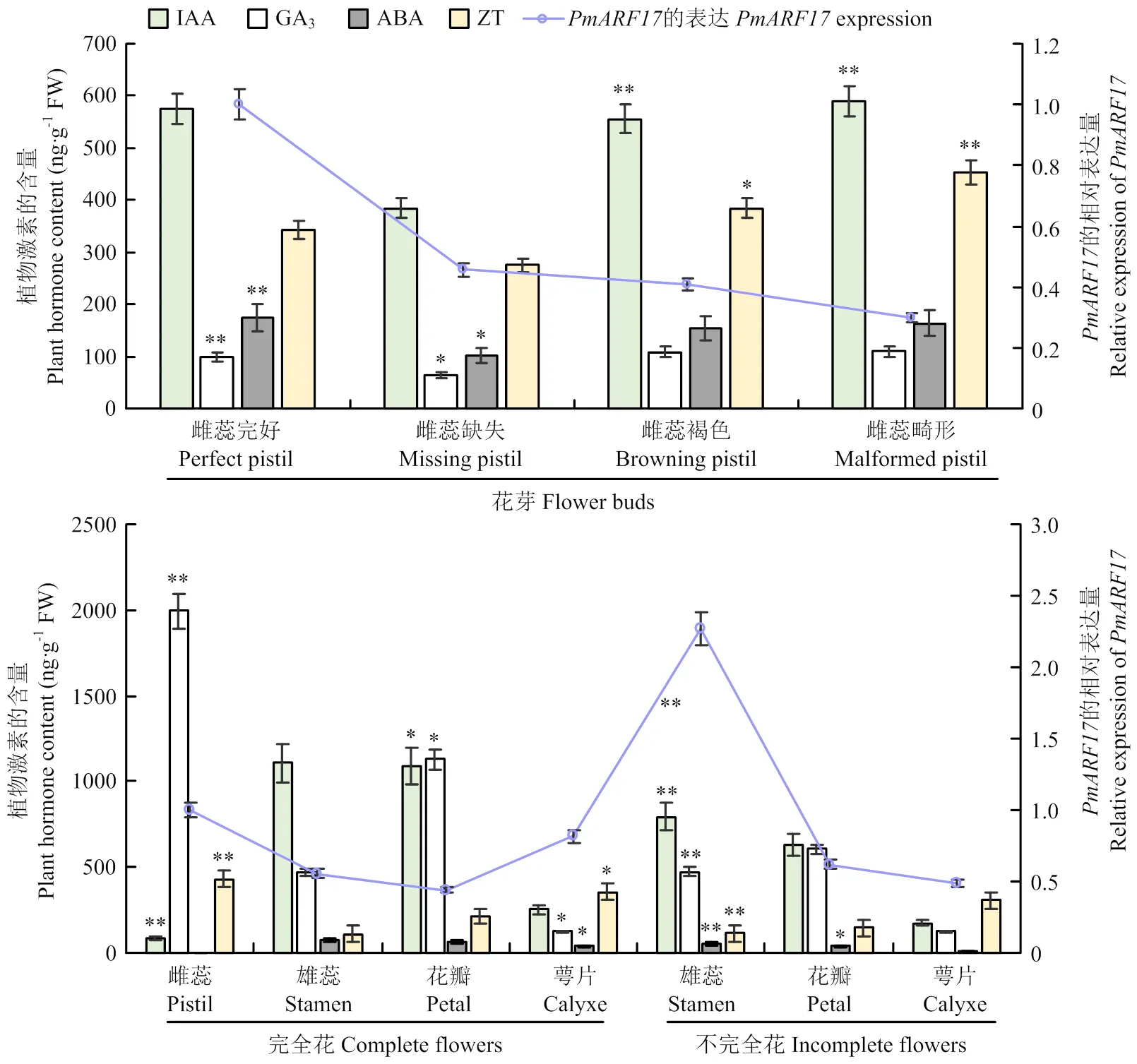
A:‘大嵌蒂’不同雌蕊形态花芽中IAA、GA3、ABA、ZT含量与PmARF17的表达分析;B:‘大嵌蒂’不同成熟花器官中IAA、GA3、ABA、ZT含量与PmARF17的表达分析
2.5 PmARF17启动子的瞬时表达及功能分析
将启动子构建到pBI121载体中,如图7-A所示,分别用pBI121-promoter-GUS融合表达载体和pBI121空载体转化EHA105农杆菌感受态,并将两种EHA105农杆菌重悬液侵染拟南芥植株。
启动子具备启动活性,可以诱导其下游表达,从而使拟南芥植株一些特定部位在GUS组织化学染色中呈现出蓝色。由农杆菌介导的pBI121空载体转化EHA105菌液瞬时侵染拟南芥苗,整株(各花器官、叶片、茎段、根部等)都表现出蓝色,如图7-D(或图7-K、L)所示。由图7-F、G可知,由启动子侵染的先盛开的花瓣较为明显地被GUS染成蓝色;图7-H表明,由启动子侵染的尚未盛开的花蕾中某一部位被GUS染成蓝色,该部位含有较多的蓝色斑点状物质。由于花蕾较小,在48 h的震荡培养中花器官内部结构遭受损坏,不易观察,推测为雄蕊。为了进一步验证为雄蕊,将该部位分离并在高倍镜下观察,发现该部位(图7-I)具有和图7-J中雄蕊一样的组成结构,则断定该部位为雄蕊,即雄蕊被GUS染成了蓝色。图7-E表明由启动子侵染的根部被GUS染成了蓝色。未经农杆菌侵染的2株拟南芥苗(阴性对照)GUS染色各部位均未呈现蓝色(图7-C,图7-J)。

A:pBI121-PmARF17 promoter-GUS融合载体结构图;B:pBI121-PmARF17 promoter-GUS侵染的拟南芥苗GUS染色结果;C:阴性对照GUS染色结果(未经菌液侵染);D:阳性对照GUS染色结果(pBI121空载侵染);E:B中根部的放大图;F、G:pBI121-PmARF17 promoter-GUS在花瓣中GUS染色结果;H:pBI121-PmARF17 promoter-GUS在雄蕊中GUS染色结果;I:从H中分离出的蓝色区域高倍镜图;J:阴性对照中花器官GUS染色结果,其雄蕊与H中的雄蕊具有相同组分;K、L:阳性对照中不同根部、花器官、叶片的GUS染色结果
3 讨论
近些年来,国内外研究表明ARF作为生长素受体调节生长素诱导的基因转录,在花发育的生长素信号转导途径中发挥着重要作用[11]。生长素几乎参与了植物生长和发育的所有过程,并且大多数过程都受基因表达的调控[43]。然而,植物激素和之间的作用机制鲜有报道[44]。为确定梅花发育和雌蕊败育的作用机理,并为植物与内源激素之间的调节关系提供重要支持,克隆并研究了其结构和功能。
可能在11月、12月、1月的梅花发育过程中起重要作用,可能是雌蕊发育的正调控基因,促进雌蕊正常发育,这与的同源基因在拟南芥花发育中可以促进雌蕊发育相一致[12,14]。与IAA没有明显的作用关系,这可能与PmARF17蛋白缺少Aux-IAA结构域有关,在梅花发育过程中可能不依赖于生长素而独立起作用。‘大嵌蒂’花芽中ABA和ZT含量变化总体上与的表达呈相反的趋势,可能会抑制的表达,但该作用关系不显著。而GA3的含量变化和的表达,在梅花发育上总体表现出明显的一致趋势。前人研究表明GA调节花分生组织识别基因()的转录活性[45],进而调节花同源异型基因[46]、[47]、[48]及[49]。YU等[50]指出,-1突变体花器官发生后,、和的转录受到GA的正调控。ZHANG等[51]研究指出,在GA诱导的葡萄单性结实过程中,GA促进的表达。据此,推测可能受到GA3的正调控作用,二者共同促进梅雌蕊发育,减轻雌蕊败育。梅发育过程中,ABA或ZT含量的变化与GA3的相互作用可能为拮抗,这与WEISS和ORI[25]的研究一致。
因启动子包含GA顺式调控元件,结合上述的表达与GA3含量变化的相关性分析,推断GA3可能在启动子的影响下正调控的表达,从而影响梅的花发育过程。值得注意的是,启动子瞬时表达试验表明,启动子作用部位并不在拟南芥的雌蕊上,而作用于其雄蕊和花瓣。在不完全花(雌蕊缺失)雄蕊中的表达显著高于完全花雌蕊、完全花雄蕊以及其余5种花器官中的表达;对于完全花和不完全花,在花瓣中也有较高表达,而GA3在其雄蕊和花瓣中均有较高含量(图6-B)。这与启动子的瞬时表达试验中启动子作用部位在雄蕊和花瓣上一致。
因此,推测在败育率较高的‘大嵌蒂’花芽中,可能受到GA3的正调控,共同作用于雄蕊和花瓣,进而影响雌蕊和花的发育。此外,推测可能存在与启动子结合的特定GA相关转录因子来调节的表达,具体机制有待进一步研究。
4 结论
可能在11月、12月、1月的梅花发育过程中起重要作用,可能是梅花发育的正调控基因,促进雌蕊的正常发育。与IAA没有明显的作用关系,这可能与PmARF17蛋白缺少Aux-IAA结构域有关,在梅花发育过程中可能不依赖于生长素而独立起作用。启动子含有GA顺式调控元件,具有启动活性和组织表达特异性,在拟南芥花瓣、雄蕊及根部特异表达。可能受到GA3的正调控作用,共同促进梅的雌蕊发育。在雌蕊败育严重的‘大嵌蒂’花发育过程中,和GA3可能通过作用于雄蕊和花瓣,进而影响梅的雌蕊发育进程。
[1] 孙海龙, 宋娟, 高志红, 倪照君, 章镇. 果梅PmKNAT2基因全长cDNA克隆及表达分析. 中国农业科学, 2014, 47(17): 3444-3452.
SUN H L, SONG J, GAO Z H, NI ZJ, ZHANG Z. Isolation and expression analysis of PmKNAT2 gene from Japanese apricot. Scientia Agricultura Sinica, 2014, 47(17): 3444-3452. (in Chinese)
[2] BOAVIDA L C, BORGES F, BECKER J D, FEIJO J A. Whole genome analysis of gene expression reveals coordinated activation of signaling and metabolic pathways during pollen-pistil interactions in Arabidopsis. Plant Physiology, 2011, 155(4): 2066-2080.
[3] ORI N. Dissecting the biological functions of ARF and Aux/IAA genes. Plant Cell, 2019, 31(6): 1210-1211.
[4] CAI H Y, CHAI M N, CHEN F Q, HUANG Y M, ZAHNG M, HE Q, LIU L P, YAN M K, QIN Y. HBI1 acts downstream of ERECTA and SWR1 in regulating inflorescence architecture through the activation of the brassinosteroid and auxin signaling pathways. New Phytologist, 2020. doi:10.1111/nph.16840.
[5] HASSANKHAH A, RAHEMI M, MOZAFARI M R, VAHDATI K. Flower development in walnut: Altering the flowering pattern by gibberellic acid application. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2018, 46(2): 700-706.
[6] HUANG Y M, ZENG X C, CAO H P. Hormonal regulation of floret closure of rice (Oryza sativa). PLoS One, 2018, 13(6): e0198828.
[7] MARZEC M, ALQUDAH A M. Key hormonal components regulate agronomically important traits in barley. International Journal of Molecular Sciences, 2018, 19(3): 795.
[8] REZAUL I M, FENG B H, CHEN T T, FU W M, ZHANG C X, TAO L X, FU G F. Abscisic acid prevents pollen abortion under high temperature stress by mediating sugar metabolism in rice spikelets. Physiologia Plantarum, 2019, 165: 644-663.
[9] ULMASOV T, HAGEN G, GUILFOYLE T J. ARF1, a transcription factor that binds to auxin response elements. Science, 1997, 276(5320): 1864-1868.
[10] 马军, 徐通达. 植物非经典生长素信号转导通路解析. 生物技术通报, 2020, 36(7): 15-22.
MA J, XU T D. Non-canonical auxin signaling pathway in plants. Biotechnology Bulletin, 2020, 36(7): 15-22. (in Chinese)
[11] VERNOUX T, ROBERT S. Auxin 2016: A burst of auxin in the warm south of China. Development, 2017, 144: 533-540.
[12] SONG J, GAO Z H, HUO X M, SUN H L, XU Y S, SHI T, NI Z J. Genome-wide identification of the auxin response factor (ARF) gene family and expression analysis of its role associated with pistil development in Japanese apricot (Sieb. et Zucc). Acta Physiological Plantarum, 2015, 37: 145.
[13] SESSIONS A, NEMHAUSER J L, MCCALL A, ROE J L, FELDMANN K A, ZAMBRYSKI P C. ETTIN patterns theflower meristem and reproductive organs. Development, 1997, 124: 4481-4491.
[14] LIU X G, DINH T T, LI D M, SHI B H, LI Y P, CAO X W, GUO L, PAN Y Y, JIAO Y L, CHEN X M. AUXIN RESPONSE FACTOR 3 integrates the functions of AGAMOUS and APETALA2 in floral meristem determinacy. Plant Journal, 2014, 80: 629-641.
[15] ZHANG K, WANG R Z, ZI H L, LI Y P, CAO X W, LI D M, GUO L, TONG J H, PAN Y Y, JIAO Y L, LIU R Y, XIAO L T, LIU X G. AUXIN RESPONSE FACTOR3 regulates flower meristem determinacy by repressing ctokinin biosynthesis and signaling. The Plant Cell, 2018, 30: 324-346.
[16] ZHENG Y, ZHANG K, GUO L, LIU X G. AUXIN RESPONSE FACTOR3 plays distinct role during early flower development. Plant Signaling & Behavior, 2018, 13(5): 1559-2324.
[17] 褚孟嫄, 黄金城. 梅树花芽形态分化及其物质代谢的研究. 北京林业大学学报, 1995, 17(S1): 68-74.
CHU M Y, HUANG J C. Studies on the morphological differentiation and the substanee metabolism in Meizi (Sieb. et Zucc.). Journal of Beijing Forestry University, 1995, 17(S1): 68-74. (in Chinese)
[18] DE JONG M, WOLTERS-ARTS M, FERON R, MARIANI C, VRIEZEN W H. The Solanum lycopersicum AUXIN RESPONSE FACTOR7 (S1ARF7) mediates cross-talk between auxin and gibberellins signaling during tomato fruit set and development. Journal of Experimental Botany, 2011, 62(2): 617-626.
[19] DE JONG M, MARIANI C, VRIEZEN W H. The role of auxin and gibberellin in tomato fruit set. Journal of Experimental Botany, 2009, 60(5): 1523-1532.
[20] 张文颖, 王晨, 朱旭东, 马超, 王文然, 冷翔鹏, 郑婷, 房经贵. 葡萄全基因组DELLA蛋白基因家族鉴定及其应答外源赤霉素调控葡萄果实发育的特征. 中国农业科学, 2018, 51(16): 3130-3146.
ZHANG W Y, WANG C, ZHU X D, MA C, WANG W R, LENG X P, ZHENG T, FANG J G. Genome-wide identification and expression of DELLA protein gene family during the development of grape berry induced by exogenous GA. Scientia Agricultura Sinica, 2018, 51(16): 3130-3146. (in Chinese)
[21] FU X D, HARBERD N P. Auxin promotes Arabidopsis root growth by modulating gibberellin response. Nature, 2003, 421: 740-743.
[22] NEMHAUSER J L, HONG F X, CHORY J. Different plant hormones regulate similar processes through largely non-overlapping transcriptional responses. Cell, 2006, 126: 467-475.
[23] BAO S J, HUA C M, SHEN L S, YU H. New insights into gibberellin signaling in regulating flowering in. Journal of Integrative Plant Biology, 2020, 62: 118-131.
[24] WEISS D, ORI N. Mechanisms of cross talk between gibberellin and other hormones. Plant Physiology, 2007, 144: 1240-1246.
[25] XIAO T, LIU J L. Study on the relation between auxin, zeatin, cytoplasmic male sterility in Maize (L.). Acta Agronomica Sinica, 1994, 20(1): 26-31.
[26] 李英贤, 张爱民, 黄铁城. 小麦细胞质雄性不育与花药组织内源激素的关系. 农业生物技术学报, 1996, 4(4): 307-313.
LI Y X, ZHANG A M, HUANG T C. Relationship between wheat cytoplasmic male sterility and the content of endogenous hormones in the anther. Journal of Agricultural Biotechnology, 1996, 4(4): 307-313. (in Chinese)
[27] 张明方, 陈竹君, 汪炳良, 董伟敏. 榨菜胞质雄性不育系和保持系花器发育过程中内源激素变化. 浙江农业大学学报, 1997, 23(2): 154-157.
ZHANG M F, CHEN Z J, WANG B L, DONG W M. Hormonal changes in flower organs of cytoplasmic male-sterile line and its maintainance line of tsatsai (tuber mustard). Journal of Zhejiang Agricultural University, 1997, 23(2): 154-157. (in Chinese)
[28] 田长恩, 张明永, 段俊, 黄毓文, 刘鸿先, 梁承邺. 油菜细胞质雄性不育系及其保持系不同发育阶段内源激素动态变化初探. 中国农业科学, 1998, 31(4): 20-25.
TIAN C E, ZHANG M Y, DUAN J, HUANG Y W, LIU H X, LIANG C Y. Preliminary study on the changes of phytohormones at different development stage in cytoplamic male sterility line and its maintainer of rape. Scientia Agricultura Sinica, 1998, 31(4): 20-25. (in Chinese)
[29] 肖华山, 吕柳新, 陈志彤. 荔枝花发育过程中雌雄蕊内源激素的动态变化. 应用与环境生物学报, 2003, 9(1): 11-15.
XIAO H S, LV L X, CHEN Z T. Dynamic changes of endogenous hormone in litchi (Sonn.) pistil and stamen during flower development. Chinese Journal of Applied & Environmental Biology, 2003, 9(1): 11-15. (in Chinese)
[30] 胡香英. ‘紫娘喜’和‘妃子笑’荔枝花期调控效应研究[D]. 海口: 海南大学, 2016.
HU X Y. Regulation of flower time in ‘Ziniangxi’ and ‘Feizixiao’ Litchi [D]. Haikou: Hainan University, 2016. (in Chinese)
[31] 李同华. 白桦生殖发育中形态解剖学研究和内源激素的动态变化分析[D]. 哈尔滨: 东北林业大学, 2004.
LI T H. The morphological and anatomic study and analysis on change of endogenous hormones during birch reproductive development [D]. Harbin: Northeast Forestry University, 2004. (in Chinese).
[32] 莫长明, 涂冬萍, 黄杰, 马小军, 潘丽梅, 姚绍嫦, 冯世鑫, 白隆华. 罗汉果花芽分化过程中形态及其激素水平变化特征. 西北植物学报, 2015, 35(1): 98-106.
MO C M, TU D P, HUANG J, MA X J, PAN L M, YAO S C, FENG S X, BAI L H. Morphological and endogenous hormones characteristics of flower budsofduring its differentiation. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(1): 98-106. (in Chinese).
[33] 聂丽娜, 夏兰琴, 徐兆师, 高东尧, 李琳, 于卓, 陈明, 李连城, 马有志. 植物基因启动子的克隆及其功能研究进展. 植物遗传资源学报, 2008, 9(3): 385-391.
NIE L N, XIA L Q, XU Z S, GAO D Y, LI L, YU Z, CHEN M, LI L C, MA Y Z. Progress on cloning and functional study of plant gene promoters. Journal of Plant Genetic Resources, 2008, 9(3): 385-391. (in Chinese)
[34] 侍婷, 张其林, 高志红, 章镇, 庄维兵. 2个果梅品种雌蕊分化进程及相关生化指标分析. 植物资源与环境学报, 2011, 20(4): 35-41.
SHI T, ZHANG Q L, GAO Z H, ZHANG Z, ZHUANG W B. Analyses on pistil differentiation process and related biochemical indexes of two cultivars of. Journal of Plant Resources and Environment, 2011, 20(4): 35-41. (in Chinese)
[35] TONG Z G, GAO Z H, WANG F, ZHOU J, ZHANG Z. Selection of reliable reference genes for gene expression studies in peach using real-time PCR. BMC Molecular Biology, 2009, 10: 71.
[36] ZHANG F P, SUSSMILCH F, NICHOLS D S, CARDOSO A A, BRODRIBB T J, MCADAM S A M. Leaves, not roots or floral tissue, are the main site of rapid, external pressure-induced ABA biosynthesis in angiosperms. Journal of Experimental Botany, 2018, 69(5): 1261-1267.
[37] RAHEEM A, SHAPOSHNIKOV A, BELIMOV A A, DODD I C, ALI B. Auxin production by rhizobacteria was associated with improved yield of wheat (L.) under drought stress. Archives of Agronomy and Soil Science, 2018, 64(4): 574-587.
[38] REDDY K E, LEE W, JEONG J Y, LEE Y, LEE H J, KIM M S, KIM D W, YU D, CHO A, OH Y K, LEE S D. Effects of deoxynivalenol and zearalenone-contaminated feed on the gene expression profles in the kidneys of piglets. Asian-Australasian Journal of Animal Sciences, 2018, 31(1): 138-148.
[39] 陈远平, 杨文钰. 卵叶韭休眠芽中GA3、IAA、ABA和ZT的高效液相色谱法测定. 四川农业大学学报, 2005, 23(4): 498-500.
CHEN Y P, YANG W Y. Determination of GA3, IAA, ABA and ZT in dormant buds ofby HPLC. Journal of Sichuan Agricultural University, 2005, 23(4): 498-500. (in Chinese).
[40] 林绍艳, 张芳, 徐颖洁. 植物中多胺含量超高效液相色谱法的建立. 南京农业大学学报, 2016, 39(3): 358-365.
LIN S Y, ZHANG F, XU Y J. The establishment of UPLC method for measuring polyamines content in plants. Journal of Nanjing Agricultural University, 2016, 39(3): 358-365. (in Chinese)
[41] KUMAR R, TYAGI A K, SHARMA A K. Genome-wide analysis of auxin response factor (ARF) gene family from tomato and analysis of their role in flower and fruit development. Molecular Genetics and Genomics, 2011, 285: 245-260.
[42] WU J, WANG F Y, CHENG L, KONG F L, PENG Z, LIU S Y, YU X L, LU G. Identification, isolation and expression analysis of auxin response factor (ARF) genes in. Plant Cell Reports, 2011, 30(11): 2059-2073.
[43] ROOSJEN M, PAQUE S, WEIJERS D. Auxin response factors: Output control in auxin biology. Journal of Experimental Botany, 2018, 69(2): 179-188.
[44] 李艳林, 高志红, 宋娟, 王万许, 侍婷. 植物生长素响应因子ARF与生长发育. 植物生理学报, 2017, 53(10): 1842-1858.
LI Y L, GAO Z H, SONG J, WAGN W X, SHI T. Auxin response factor (ARF) and its functions in plant growth and development. Plant Physiology Journal, 2017, 53(10): 1842-1858. (in Chinese)
[45] BLA´ZQUEZ MA, GREEN R, NILSSON O, SUSSMAN M R, WEIGEL D. Gibberellins promote flowering ofby activating the LEAFY promoter. Plant Cell, 1998, 10(5): 791-800.
[46] WAGNER D, SABLOWSKI R W M, MEYEROWITZ E M. Transcriptional activation of APETALA1 by LEAFY. Science, 1999, 285: 582-584.
[47] BUSCH M A, BOMBLIES K, WEIGEL D. Activation of a flower homeotic gene in. Science, 1999, 285: 585-587.
[48] LAMB R S, HILL T A, TAN Q K, IRISH V F. Regulation of APETALA3 flower homeotic gene expression by meristem identity genes. Development, 2002, 129: 2079-2086.
[49] WILLIAM D A, SU Y H, SMITH M R, LU M, BALDWIN D A, WAGNER D. Genomic identification of direct target genes of LEAFY. Proceedings of the National Academy of Sciences, 2004, 101: 1775-1780.
[50] YU H, ITO T, ZHAO Y X, PENG J R, KUMAR P, MEYEROWITZ E M. Floral homeotic genes are targets of gibberellin signaling in flower development. Proceedings of the National Academy of Sciences, 2004, 101: 7827-7832.
[51] ZHANG W Y, ABDELRAHMAN M, JIU S T, GUAN L, HAN J, ZHENG T, JIA H F, SONG C N, FANG J G, WANG C. VvmiR160s/ VvARFs interaction and their spatio-temporal expression/cleavage products during GA-induced grape parthenocarpy. BMC Plant Biology, 2019, 19: 111.
Isolation ofand Its Regulation Pattern of Endogenous Hormones During Flower Development in

1College of Horticulture, Nanjing Agricultural University, Nanjing 210095;2Jiangsu Academy of Agricultural Sciences, Nanjing 210014
【】The purposes of this study were to analyze the biological functions ofgene and to explore the regulation pattern between the expression ofand plant endogenous hormones, which could provide the basis for studying the regulatory mechanism of pistil abortion in. 【】gene was isolated from the cultivar Daqiandi of, and the gene structure, phylogeny and homology with other species were analyzed by bioinformatics software. Subcellular localization determined the position of PmARF17 protein in the cell. qRT-PCR was used to detect the spatiotemporal expression pattern ofvarieties Daqiandi and Longyan. The contents of IAA, GA3, ABA and ZT in flower buds, leaf buds, pistil morphology flower buds and different mature flower organs of Daqiandi and Longyan were determined by UPLC method, and the correlation analysis was conducted with the qRT-PCR expression ofCloning, element analysis and transient expression ofpromoter were performed to study the regulation pattern betweenand GA3. 【】Phylogenetic tree analysis showed PmARF17 protein sequence was highly conserved with ARF protein of other plants. Subcellular localization experiment showed PmARF17 protein was located on the nucleus and cell membrane. The correlation analysis between qRT-PCR expression and endogenous hormone content showed the expression ofhad no obvious similarity with the change trend of IAA content in different flower samples. The expression ofPmARF17 in complete pistil was significantly up-regulated compared to incomplete pistil, and GA content was consistent with the expression trend of PmARF17. The content of ABA and ZT in different flower samples and the expression ofshowed an overall opposite trend, indicating that they might inhibit the expression of. Thepromoter contained GA-element and had promoter activity and tissue expression specificity, specifically expressed in petals, stamens and roots. 【】might be a positive regulation gene of flower development, and it might promote pistil development of.The expression ofmight be positively regulated by GA3, which affected the pistil development ofby acting on stamens and petals.
; auxin response factor; pistil development; gene expression; endogenous hormones; transient expression

10.3864/j.issn.0578-1752.2021.13.013
2020-08-27;
2020-10-14
国家自然科学基金(31971703,31772282)、中国博士后基金(2018M640497)、江苏省博士后基金(2018K216C)、中央高校基本科研业务费专项资金(SYSB201805)
李艳林,E-mail:lisaltp@qq.com。通信作者高志红,E-mail:gaozhihong@njau.edu.cn
(责任编辑 赵伶俐)
