艾塞那肽治疗多囊卵巢综合征患者引起肠道菌群的改变
2021-07-20马瑞琳邓燕孙爱军
马瑞琳,邓燕,孙爱军
(中国医学科学院 北京协和医学院 北京协和医院妇产科,国家妇产疾病临床研究中心,北京 100730)
多囊卵巢综合征(PCOS)是育龄期妇女常见的内分泌和代谢紊乱性疾病。肥胖和胰岛素抵抗(IR)是PCOS患者的常见特征,同时也是PCOS发生发展以及PCOS远期并发症(2型糖尿病和心血管疾病)的危险因素,因此,调整生活方式和二甲双胍被广泛应用于PCOS患者的治疗[1]。肠道菌群失调与肥胖和IR的发生密切相关,将正常体重人群的肠道菌群移植至代谢综合征患者肠道可以改善患者IR也间接证明了这一结论[2]。胰高血糖素样肽-1(GLP-1)受体激动剂是一种新型抗糖尿病药物,近年来也应用于PCOS的治疗,它可以改善IR和糖耐量异常,还可通过延缓胃排空,增加饱腹感达到减重的效果[3]。已有研究表明GLP-1受体激动剂利拉鲁肽减重的作用与其调节肠道菌群结构有关[4]。然而,对于超重或肥胖的PCOS患者,GLP-1受体激动剂和二甲双胍对肠道菌群的影响仍需要进一步阐明。
艾塞那肽微球是一种长效GLP-1受体激动剂,在本研究中,我们假设艾塞那肽和二甲双胍在改善超重/肥胖PCOS患者体重和血糖的同时优化了PCOS患者肠道菌群的结构,因此,我们通过收集超重/肥胖PCOS患者接受艾塞那肽联合二甲双胍或单用二甲双胍干预治疗3个月前后的粪便样本,利用16S rRNA高通量基因测序技术描述和量化样本中的微生物α和β多样性,并研究其物种差异,以期为PCOS患者的治疗提供新思路。
材料与方法
一、研究对象与设计
本研究中的34例PCOS患者(符合鹿特丹标准[5];BMI≥25 kg/m2)为一项随机单中心对照试验(ClinicalTrials.gov,NCT04029272)的患者亚群,该试验于2019年7月至2020年12月在北京协和医院妇产科进行。
根据计算机生成的随机数表,按照1∶1的比例将患者随机分为2个治疗组:联合组(17例)和单药组(17例)。联合组患者给予二甲双胍(中美上海施贵宝)500 mg口服,每日3次,联合艾塞那肽(阿斯利康,美国)2 mg皮下注射,每周1次;单药组患者单用二甲双胍500 mg,每日3次。
比较二甲双胍联合艾塞那肽对比单用二甲双胍治疗12周对超重/肥胖PCOS患者体重的影响;肠道菌群组成分析为次要终点。本研究按照“赫尔辛基宣言”进行,并经北京协和医院伦理委员会批准。所有参与者在研究开始前都签署了知情同意书。
34例患者在基线及治疗12周后分别留取新鲜粪便标本。所有患者均自月经或黄体酮撤退出血的第1天起给予达英-35治疗,连续21 d,停药7 d后开始下一周期。所有患者在留取粪便标本前1个月内未使用抗生素,前7 d内未饮用酸奶。
二、人体测量学、内分泌、代谢指标评估
两组患者在12周治疗前后均测量腰围、体重,计算体质量指数(BMI);在基线和治疗12周后,隔夜禁食12 h后于早上进行标准的75 g口服葡萄糖耐量试验(OGTT),分别于0、30、60、120 min测定血糖和胰岛素水平。空腹血样还用于测量糖化血红蛋白(HbA1c)、性激素、血脂、全血计数、C反应蛋白以及肝肾功能标志物。
采用化学发光免疫分析法(Beckman Coulter DXI 800免疫分析系统)检测总睾酮(TT)和硫酸脱氢表雄酮(DS)。采用标准自动化检测方法(Beckman AU系列全自动化学分析仪)检测总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-c)、低密度脂蛋白胆固醇(LDL-c)、高敏C反应蛋白(hsCRP)和血糖浓度。采用化学发光免疫分析法(Siemens Centaur XP免疫分析系统)测定血清胰岛素浓度。胰岛素抵抗稳态模型(HOMA-IR)=空腹血清胰岛素(mIU/L)×空腹血糖(FBG,mmol/L)/22.5;定量胰岛素敏感性检查指数(QUICKI)=1/(Log[空腹胰岛素(FINS,mIU/L)]+Log[FBG(mg/dl)])。
三、粪便DNA提取和16S rRNA基因测序
在药品分发当日及试验结束后的早上留取新鲜粪便标本,并立即保存在-80℃用于分析。使用E.Z.N.A.soil DNA Kit(Omega Bio-tek,美国)抽提微生物总DNA,使用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对16S rRNA基因V3-V4可变区进行PCR扩增。每个样本重复3次。使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,美国)进行纯化,2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer(Promega,美国)对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit进行建库,利用Illumina公司的Miseq PE300平台进行测序。
四、统计学分析
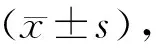
结 果
一、两组治疗前后的临床指标变化
1.体重相关指标变化:两组患者在治疗12周后体重、BMI和腰围均显著下降(P<0.05),联合组较单药组减轻更多体重,但组间无显著性差异(P>0.05)(表1)。
2.雄激素变化:两组患者治疗后的TT水平均显著下降(P<0.05),DS水平无显著变化(P>0.05)。两组药物降低TT的疗效无显著差异(P>0.05)(表1)。
3.糖代谢、hsCRP变化:联合组患者治疗12周后FBG、OGTT-2 h血糖(OGTT-2 h BG)、OGTT-2 h胰岛素(OGTT-2 h INS)和HbA1c水平均显著下降(P<0.05),单药组患者仅HbA1c水平显著下降(P<0.05)。联合组治疗降低FBG、OGTT-2 h BG和OGTT-2 h INS水平的疗效优于单药组(P<0.05)。两种治疗方法对FINS水平、HOMA-IR、QUICKI指数值及hsCRP均无显著影响(P>0.05)(表1)。
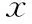
表1 两组患者治疗前后的各指标比较[(-±s),M(IQR)]
二、两组治疗前后肠道菌群的变化
68份粪便标本共获得3 287 785个有效序列,按照97%相似性对非重复序列进行OTU聚类,共划分为846个OTU。
1. α多样性分析:Shannon曲线(图1A)趋于平坦,表明测序深度足够获取我们样本中的大部分OTU。Chao指数(图1B)在两组患者中组间及组内均无显著性差异(P>0.05);Shannon指数(图1C)在单药组无显著变化(P>0.05),在联合组呈下降趋势但变化不显著(P>0.05)。两组患者治疗前的Shannon指数无显著性差异(P>0.05),但治疗后联合组显著低于单药组(P<0.05),提示艾塞那肽联合二甲双胍治疗可导致肠道菌群多样性的降低。
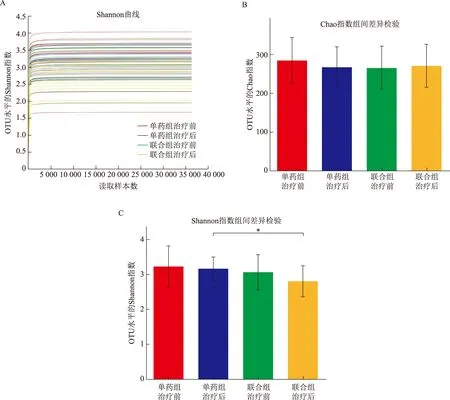
2. PCoA分析:PCoA分析表明艾塞那肽联合二甲双胍治疗与单独二甲双胍治疗对超重/肥胖PCOS患者肠道菌群结构的影响不同(图2A)。联合组治疗显著改变了超重/肥胖PCOS患者肠道菌群的结构(图2B,P=0.02),PC1和PC2轴对差异的解释度分别为14.93%和11.71%;而单药组对肠道菌群结构无显著影响(图2C,P=0.10),PC1和PC2轴对结果的解释度分别为16.04%和12.68%。
A:利用Shannon指数构建稀疏曲线;B:Chao指数比较;C:Shannon指数比较;相互比较,*P<0.05图1 不同方案治疗前后的肠道菌群整体结构——α多样性分析
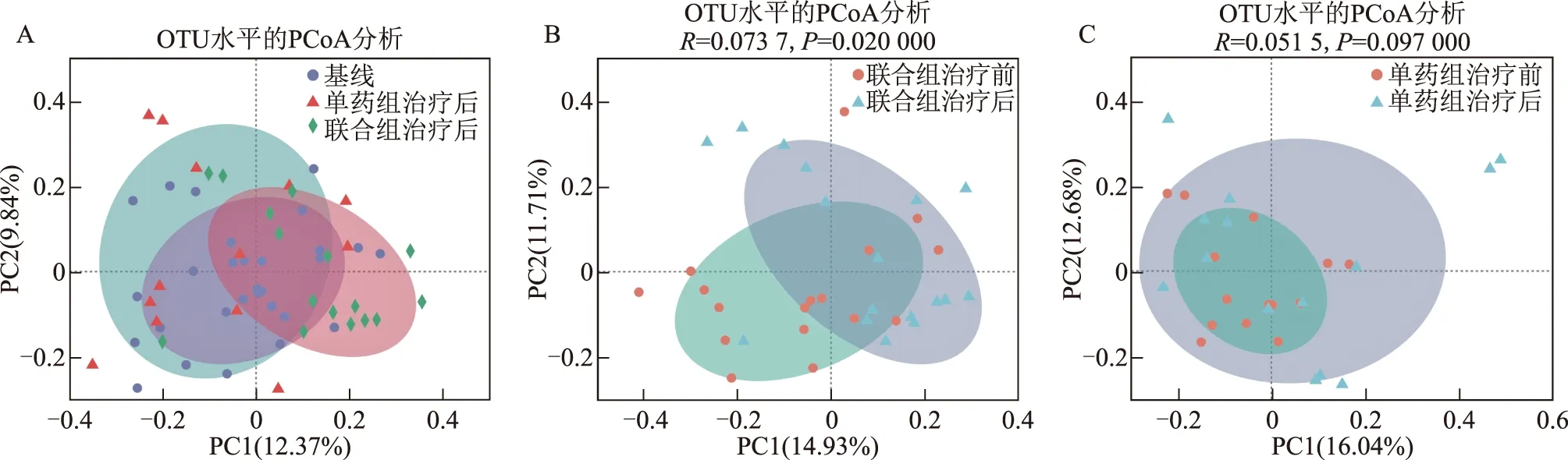
A:主坐标分析(PCoA)所有患者治疗前后的群落相似性;B:PCoA 分析联合组治疗前后的群落相似性;C:PCoA分析单药组治疗前后的群落相似性图2 不同方案治疗前后的肠道菌群整体结构——PCoA分析
3.群落组成与物种差异分析:两组患者治疗前后的肠道菌群在门、纲、科、属水平的群落Bar图见图3A~D。在门水平上,4组菌群组成以厚壁菌门、拟杆菌门、放线菌门和变形菌门为主(图3A)。
两组患者治疗前后肠道菌群门、属水平群落丰度比较见图4A~D。联合组治疗后厚壁菌门、拟杆菌门和绿弯菌门丰度显著降低,变形菌门丰度显著增加(P<0.05)(图4A)。单药组治疗后粪杆菌属丰度显著增加(P<0.05)(图2D)。联合组拟杆菌门/厚壁菌门比值在治疗后显著低于治疗前[(0.01±0.02)vs.(0.05±0.07),P=0.01],单药组拟杆菌门/厚壁菌门比值在治疗前后无显著变化[(0.04±0.06)vs.(0.05±0.06),P=0.26]。
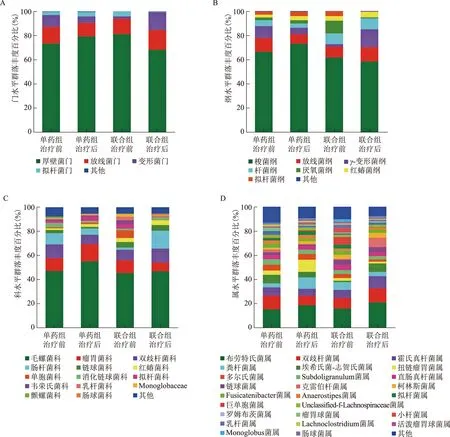
A:门水平;B:纲水平;C:科水平;D:属水平图3 不同方案治疗前后的肠道菌群群落丰度Bar图

A:联合组门水平;B:联合组属水平;C:单药组门水平;D:单药组属水平;*P<0.05,**P<0.01图4 不同方案治疗前后的肠道菌群群落丰度比较

讨 论
本研究首次探讨了艾塞那肽联合二甲双胍对比单用二甲双胍对超重或肥胖PCOS患者肠道菌群的影响,我们发现艾塞那肽干预可降低超重或肥胖PCOS患者肠道菌群的多样性,改变菌群物种组成。
肠道菌群结构和活性的变化与多种代谢紊乱疾病有关,包括肥胖、糖尿病和心血管疾病等[6-7]。已有研究表明,肥胖患者的肠道菌群表现为微生物多样性减少,厚壁菌门增多和拟杆菌门减少[8]。一些益生菌及其混合物被报道可通过调节肠道菌群结构来改善疾病代谢状态。例如,动物双歧杆菌乳亚种GCL2505可以改善代谢综合征患者糖耐量异常,抑制内脏脂肪积累,且该类益生菌显著增加了放线菌门的丰度,但不影响拟杆菌门/厚壁菌门比值[9]。此外,Graessler等[10]发现Roux-en-Y胃旁路术后的2型糖尿病肥胖患者体重明显减轻,代谢状态明显改善,同时粪便菌群中厚壁菌门和拟杆菌门减少,变形菌门增加。这些都表明,调节肠道菌群结构被认为是改善代谢紊乱的一种新兴的治疗策略。
肥胖是PCOS患者的普遍特征,肠道菌群失调与PCOS密切相关。肠道菌群失调可引起IR、高雄激素血症和慢性炎症等,并可能通过影响能量吸收、短链脂肪酸(SCFA)途径、脂多糖释放、肠黏膜通透性和脑-肠轴促进PCOS的发生[11]。GLP-1受体激动剂是一种新型抗糖尿病药物,作用于肠道L细胞GLP-1受体,发挥“肠促胰素效应”,可有效改善IR和糖耐量异常,还可通过延缓胃排空、增加饱腹感减轻体重[3]。大鼠试验研究发现GLP-1受体激动剂利拉鲁肽可通过调整肠道菌群结构,增加拟杆菌门物种丰度及拟杆菌门/厚壁菌门比值减轻肥胖者体重[4]。而在本研究中,尽管艾塞那肽干预后超重或肥胖PCOS患者体重下降明显,但肠道菌群中厚壁杆菌门与拟杆菌门丰度均下降,拟杆菌门与厚壁菌门的比值较治疗前亦下降。既往有研究表明厚壁菌门/拟杆菌门比值与肥胖呈正相关,但研究对象多是排除饮食、运动等混杂变量后的转基因动物或严格控制的人类受试者[7,12]。当研究对象为不受限制的人类受试者时,反而得出相反的结论,虽然DNA提取方案和引物设计的方法差异也会导致微小的差异[13]。在我们的研究中,研究对象为饮食运动不受限制的人类受试者,这可能是我们研究中获得的结果不同于上述结果的最可能解释。
在本研究中,我们发现二甲双胍治疗没有改变超重/肥胖PCOS患者肠道菌群的丰富度和多样性,但显著增加了菌群中粪杆菌属的丰度。有研究报道粪杆菌属丰度的升高与2型糖尿病病情缓解有关[14]。我们的结果与既往二甲双胍对PCOS模型小鼠肠道菌群影响的结果不同,Xue等[15]报道二甲双胍治疗显著降低了PCOS模型小鼠肠道螺杆菌属的丰度。研究对象和肠道菌群检测方法的不同可能是造成差异的原因。
综上所述,我们的研究初步证明艾塞那肽可以调节超重或肥胖PCOS患者肠道菌群的结构,包括抑制菌群丰度和多样性,提高厚壁菌门/拟杆菌门比值,且不同于二甲双胍对肠道菌群的影响。然而,需要更严谨的研究设计和更深入的分析来阐明艾塞那肽如何通过调节肠道菌群发挥对超重/肥胖PCOS患者的疗效。
