竹林金针虫实时荧光定量PCR内参基因的筛选与应用
2021-07-12叶碧欢陈友吾舒金平张亚波李海波宋其岩
叶碧欢,陈友吾,舒金平,张 威,张亚波,李海波,宋其岩
(1.浙江省林业科学研究院,浙江 杭州 310023;2.中国林业科学研究院 亚热带林业研究所,浙江 杭州 311400)
竹林金针虫是取食竹笋的叩甲幼虫的总称,虫害发生时竹笋产量显著减少,严重时竹种无法成竹,制约了竹林的自然更新[1−2]。筛胸梳爪叩甲Melanotuscribricollis隶属于鞘翅目Coleoptera叩甲科Elateridae梳爪叩甲属Melanotus,其幼虫为中国南方早园竹Phyllostachyspropinqua竹林的优势种。化学药剂防治竹林金针虫易造成环境污染、抗药性和食品安全等问题,阻碍以“生态、健康、有机”为标签的林产品产业发展,因此近年来逐渐采用生物技术防治该虫害。绿僵菌Metarhiziumsp.是常见的昆虫致病真菌[3−4],对鞘翅目和鳞翅目Lepidoptera等害虫均有一定防效[5−6]。研究竹林金针虫抗绿僵菌相关基因的表达有利于深入了解害虫免疫抗性机制和虫菌互作机制,也有利于生防菌菌株改造等研究,提高其对农林害虫防治的效果。实时荧光定量聚合酶链式反应(qRT-PCR)是研究基因表达分析的关键技术,省时、高效、应用广泛;为保证目的基因定量表达结果的准确性,需引入表达稳定的内参基因作为参照[7]。内参基因又称看家基因,理想的内参基因其表达水平应在各条件下保持稳定,而实际上不同条件下许多内参基因的表达并不稳定[8−9]。因此,即使是同一物种,不同试验条件下的内参基因也不能一概而用,qRTPCR试验之前应对所选内参基因的表达稳定性进行评估。常用的qRT-PCR内参基因包括ACT(肌动蛋白)、TUB(微管蛋白)、GAPDH(甘油醛-3-磷酸脱氢酶)、UBC(泛素结合酶)、18S rRNA (核糖体蛋白S18)、28S rRNA (核糖体蛋白 S28)、EF1 (延伸因子 1)、SYN1 (突触融合蛋白 1)、SYN6 (突触融合蛋白6)、RPS3 (核糖体蛋白 S3)、PRS20 (泛素-核糖体蛋白 S20)、PRS27a(泛素-核糖体蛋白 S27a)、RPL10 (核糖体蛋白 L10)、RPL13α(核糖体蛋白 S13α)、AK(精氨酸激酶)和V-ATPase(液泡型 ATP 合酶)等。符伟等[10]分析了小菜蛾Plutellaxylostella候选内参基因在Bt毒素诱导时的表达稳定性,最终筛选出由PRS13、RPL32和EF1α组成的最佳内参基因组合。冯波等[11]筛选出最适合校正松墨天牛Monochamus alternatus化学感受组织基因表达的GAPDH和TUB内参基因组合。刘金泊[12]评价了赤拟谷盗Tribolium castaneum的候选内参基因在磷化氢诱导条件下的表达稳定性,筛选出RPS18和RPL13α最佳内参基因组合。杨苓等[13]筛选出了适合桃蛀螟Conogethespunctiferalis不同发育时期和不同组织的基因表达研究的2组最佳内参组合(RP49和GAPDH,RPL13和RP49)。陶蓉等[14]则分别筛选出了美国白蛾Hyphantria cunea不同发育阶段、不同温度和不同组织的3组最佳内参基因(RPL12和EF1β,EF1α和GAPDH,ACT和RPS16)。目前,关于筛胸梳爪叩甲幼虫内参基因的筛选评估尚未见报道。本研究对平沙绿僵菌Metarhiziumpingshaense侵染不同时期的筛胸梳爪叩甲幼虫qRT-PCR内参基因进行了筛选和评估,以期选出最佳的内参基因,为今后开展竹林金针虫等昆虫的基因表达研究提供参考。
1 材料与方法
1.1 供试虫源、真菌和土壤
供试筛胸梳爪叩甲幼虫于2020年3月下旬至4月中旬采自浙江省湖州市德清县的早园竹林地,带回室内置于塑料养虫箱中,箱内装满约3/4的土壤(湿度为10% ± 1%),定期喂以鲜笋。供试平沙绿僵菌WP08菌株由中国林业科学研究院亚热带林业研究所森林保护团队提供,该菌株最初从僵死的筛胸梳爪叩甲幼虫虫体上分离获得[15]。WP08菌株接种于PDA培养基,产孢3周左右收集分生孢子。供试土壤采自德清早园竹园区,40 目的网筛过筛,高温灭菌(121 ℃、1 h),烘干备用。
1.2 样品处理
取一定量的平沙绿僵菌WP08分生孢子与供试土壤,混匀后调节土壤水分为(10 ± 1)%,土壤孢子密度为1.1×107个·g−1。挑选活力强且个体大小一致的幼虫置于处理样品中,培养至7、12和 17 d时取样,以未经绿僵菌侵染处理的幼虫作为对照组(0 d),随机取样5头·份−1。试验在人工气候培养箱中进行,温度设定为(25 ± 1) ℃,空气相对湿度为(80 ± 10)%,黑暗条件,设置3个生物学重复。所有样品用无菌水清洗数遍,用体积分数75%的乙醇表面消毒后,再用无菌水清洗1遍;无菌滤纸吸干虫体体表水分,液氮速冻,存放于−80 ℃备用。
1.3 总 RNA 提取和 cDNA 合成
利用景新微量动物组织总RNA提取试剂盒(SIMGEN,杭州)提取不同样品的RNA,具体操作参照试剂盒说明书。利用质量浓度1.0%的琼脂糖凝胶电泳和紫外分光光度计(美国Thermo Scientific)检测所提取总RNA的质量和质量浓度。利用无菌双蒸水(ddH2O)将所有样品RNA稀释到125 mg·L−1备用。按照 PrimeScriptTMReagent kit with gDNA Eraser(Perfect Real Time)反转录试剂盒 (Takara)说明书合成样品cDNA,每个样品取 7.0 μL RNA。
1.4 引物设计、合成和筛选
参考昆虫常用内参基因,根据筛胸梳爪叩甲幼虫的转录组测序注释结果[16],筛选不同内参基因(βactin、α-tubulin、GAPDH、AK、SYN6、RPS3、RPL13α、RPL10、RPS27a、RPL32、RPS20 和EF-1α)的同源序列,同时筛选昆虫免疫应答相关基因的6个同源序列[PGRP、Prx、SDR(1)、SDR(2)、SDR(3)和SDR(4)],并利用在线网站http://bioinfo.ut.ee/primer3-0.4.0/针对基因开放阅读框(ORF)区设计qRTPCR扩增引物。所有引物均由北京擎科新业生物技术有限公司合成。
以cDNA(0 d)为模板进行普通PCR扩增,并根据电泳结果筛选出扩增条带单一的特异性引物对。PCR 扩增反应体系为:2×TSINGKE Master Mix 10.0 μL,上下游引物 (10 μmol·L−1)各 1.5 μL,模板cDNA 3.0 μL,ddH2O 补足至 20.0 μL。扩增程序为:94 ℃ 预变性 5 min;94 ℃ 变性 30 s,退火 55 ℃,72 ℃延伸2 min,共35个循环;最后于72 ℃补平7 min,终止温度为4 ℃。PCR扩增反应在LifeECO基因扩增仪(杭州博日)上进行。取PCR扩增产物3.0 μL,点样于质量浓度为1.5%的琼脂糖凝胶上,TS-GelRed核酸染料染色,1×TAE缓冲液中电泳30~40 min(120 V),利用Bio-Rad凝胶成像分析仪(美国伯乐)摄取扩增图谱。
1.5 标准曲线构建及引物扩增效率分析
标准曲线构建。将反转录获得的cDNA(0 d)稀释2倍后,再依次稀释5个梯度,各梯度依次稀释5倍。以梯度稀释的cDNA为模板进行qRT-PCR,反应在Line Gene 9600 Plus实时荧光定量PCR仪(杭州博日)上进行,使用 Gene-9660 software 采集数据。PCR 扩增反应体系为:2×SYBR Green Mix 5.0 μL,上下游引物 (5 μmol·L−1)各 0.2 μL,模板 cDNA 1.0 μL,ddH2O 补足至 10.0 μL。qRT-PCR 扩增程序:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火和延伸1 min,共40个循环,60 ℃采集荧光信号。扩增结束后做熔解曲线分析以检测扩增产物的特异性。熔解曲线程序:95 ℃,15 s;65 ℃,1 min;95 ℃,20 s,隔 20 s步进 0.2 ℃;30 ℃,1 min。各样品进行 3 次技术重复,取循环阈值 (cycle threshold,Ct)的平均值。判断每对引物是否具有特异性以及是否有引物二聚体,熔解曲线为单峰时用于后续分析。
扩增效率分析。利用SPSS 19.0软件分析cDNA模板质量浓度(对数值)和Ct值的线性关系,获得相关系数(R2)和斜率(S),利用公式E=(10−1/S−1)×100%计算引物的扩增效率[17]。
1.6 内参基因表达稳定性分析
以0(ck)、7、12和17 d取样的cDNA为模板,利用1.4节筛选出的引物对进行qRT-PCR,具体程序同1.4节所述。利用Excel 2003,GeNorm[18]、Normfinder[19]和Bestkeeper[20]软件根据Ct平均值分析候选内参基因的表达稳定性。GeNorm根据表达稳定度(M值)大小对候选内参基因进行排序,M值越小表示基因表达越稳定;根据标准化因子的配对差异分析(Vn/n+1)判定最佳的内参基因数组,Vn/n+1<0.15代表该条件下内参基因最佳数目为n个。Bestkeeper软件通过标准差(SD)和概率值(P)直接分析Ct值,SD>1或者P>0.05时,判定该基因不适合作为内参基因。具体操作方法参考文献[21]。
1.7 内参基因表达稳定性验证
选择免疫应答相关基因的6个同源序列作为目的基因,分析1.6节选出的内参基因在不同处理间(0、7、12和17 d)的相对表达量变化,以验证其表达稳定性。目的基因相对表达量的计算采用2−∆∆Ct法。其中:ΔΔCt=ΔCt-实验−ΔCt-对照,△Ct=Ct-目的基因−Ct-内参基因。采用统计学单因素方差分析及最小显著性差异法(LSD)多重比较分析差异显著性。
2 结果与分析
2.1 总 RNA 提取
由图1可见:所有样品D(260)/D(280)均为1.8~2.1,凝胶电泳结果可见2条清晰条带(28S和18S rRNA),说明总RNA较为完整,未出现明显降解。
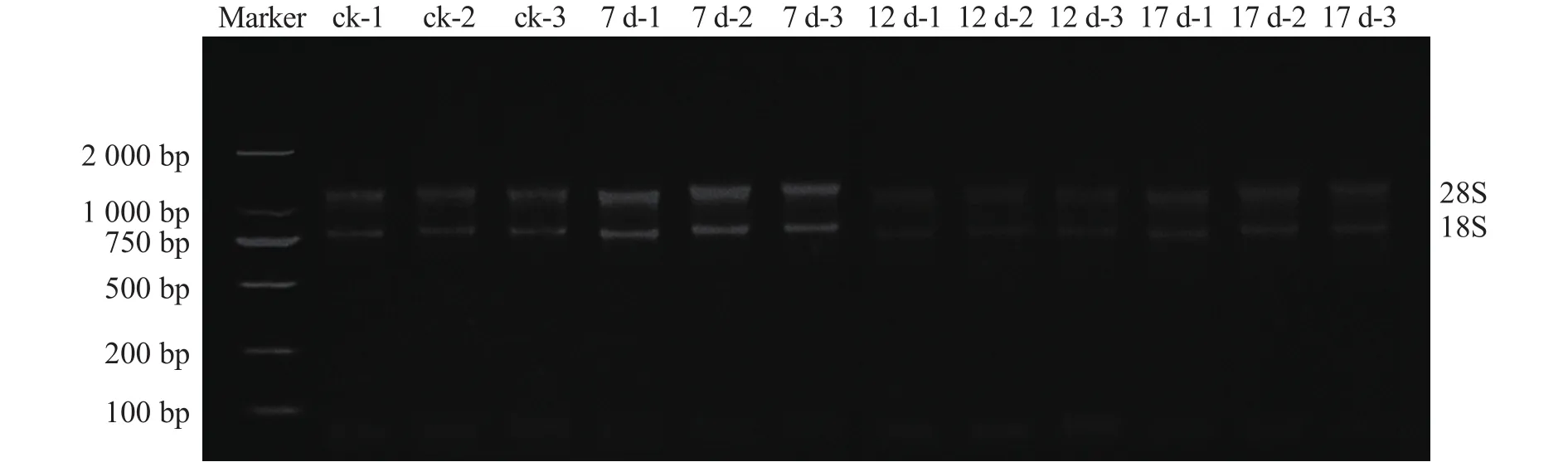
图 1 总 RNA 电泳图Figure 1 Electrophoretogram of total RNA
2.2 引物特异性和扩增效率分析
根据筛胸梳爪叩甲幼虫的转录组测序数据,筛选出24条候选内参基因和6条目的基因的同源序列,根据普通PCR扩增结果选出条带单一的22对特异性引物,再根据qRT-PCR的引物熔解曲线、R2和扩增效率进一步筛选出6对内参基因(β-actin、GAPDH、α-tubulin、RPL13α、RPS27a和RPS3)和6对目的基因的引物。12对引物的熔解曲线均为单峰,R2为0.989~0.998,扩增效率为88.69%~112.48%,表明引物具有特异性,cDNA的质量浓度和Ct值存在明确的线性关系,引物扩增效率符合荧光定量要求 (表 1)。

表 1 qRT-PCR 引物信息Table 1 Informations of qRT-PCR primers
2.3 内参基因表达稳定性分析
2.3.1 内参基因的表达水平分析 不同平沙绿僵菌侵染处理时长 (0、7、12 和 17 d)下,筛胸梳爪叩甲幼虫6个候选内参基因的Ct值为11.110~15.463(图2),表明本试验条件下所选内参基因表达水平较高。但不同基因的Ct值存在差异,其中β-actin最低,平均Ct值为11.622;α-tubulin最高,平均Ct值为14.712;GAPDH的Ct值跨度最小(13.273~13.873);RPS3跨度最大(13.720~14.970)。

图 2 筛胸梳爪叩甲幼虫候选内参基因的 Ct值分析 Figure 2 Ct value analysis of candidate reference genes of Melanotus cribricollis larvae
2.3.2 内参基因表达稳定性分析和最佳数量评估 GeNorm 软件计算基因的表达稳定度(M值),M>1.5的内参基因不可用,M越小,内参基因的表达越稳定。该软件分析结果显示:6个候选内参基因的M值均<1.5,PRS27a和RPS3的表达最稳定,其后依次是α-tubulin、RPL13α和β-actin,GAPDH的表达最不稳定。NormFinder通过比较样本的组内变异和组间变异来评估基因的稳定值。该软件分析结果显示:RPL13α的表达最稳定,其后依次是αtubulin、RPS3、RPS27a和β-actin,GAPDH的表达最不稳定。BestKeeper是以标准差和P来判断内参基因是否可用。该软件分析结果显示:所有候选内参基因的标准差均<1,但β-actin和GAPDH P>0.05,不适合作为本试验条件下的内参,其余4个内参基因可用。综合3个软件的评价结果发现:RPS3、PRS27a、RPL13α和α-tubulin这 4个内参的表达稳定性排名稍有差异,RPS3的表达最稳定,PRS27a和RPL13α次之,随后是α-tubulin(表2)。GeNorm软件通过判断配对变异值(<0.15)来确定内参基因最佳数目。由表3可知:V2/3=0.084<0.15,表明该条件下最佳内参基因的数目n=2(表3)。

表 2 利用 BestKeeper 软件评价候选内参基因的表达稳定性Table 2 Stability of candidate reference genes based on BestKeeper analysis

表 3 内参基因的最佳数量评估Table 3 Determination of the optimal number of reference genes for normalization
2.3.3 内参基因表达稳定性验证 综合 3 款软件的内参基因表达稳定性排名和最佳组合数目分析结果,本研究选择PRS27a和RPS3为内参基因。由图3可知:以PRS27a和RPS3为内参基因时,6个目的基因在平沙绿僵菌不同处理时间(0、7、12和17 d)的筛胸梳爪叩甲幼虫中的表达变化趋势相同;其中,PGRP基因相对表达量在7 d时都较对照(0 d)显著提高 (P<0.05),随后下降,12 和 17 d 时无显著差异;Prx基因相对表达量整体呈上升趋势,在12 和 17 d 时均显著高于对照 (P<0.05);SDR(1)相对表达量则呈下降趋势;SDR(2)在17 d 时相对表达量显著升高(P<0.05);SDR(3)和SDR(4)相对表达量均先升高后下降,并在12 d时表达量最高,较其他处理时间存在显著性差异(P<0.05)。

图 3 以PRS27a和RPS3为内参时6个目的基因不同处理时间下的相对表达量Figure 3 Expression analysis of six target genes under different processing times calibrated by PRS27a and RPS3 as reference genes
3 讨论
实时荧光定量PCR具有快速、准确和灵敏的特性,在基因表达分析研究中应用广泛,然而表达稳定的内参基因选择是获得目的基因准确表达结果的前提条件。同一内参基因在不同物种、组织、发育阶段和处理条件下的表达稳定性也存在差异[8−9]。目前尚未见有关筛胸梳爪叩甲幼虫内参基因的研究报道。本研究首次对该虫在平沙绿僵菌侵染条件下的候选内参基因进行了筛选评估。GeNorm、NormFinder和BestKeeper软件对候选内参基因的分析结果表明:PRS27a和RPS3的表达稳定。本研究以PGRP、Prx、SDR(1)、SDR(2)、SDR(3)和SDR(4)为目的基因对PRS27a和RPS3内参基因进行了验证,结果显示:分别以这2个基因为内参时,6个目的基因的表达趋势一致,证明了这2个基因作为内参的可靠性。PGRP隶属于模式识别受体蛋白(pattern recognition receptor proteins,PRRs)家族,可与革兰氏阳性菌和革兰氏阴性菌的肽聚糖结合,激活Toll和Imd信号转导通路,诱导免疫防御相关的水解级联反应,发生吞噬作用[22−23]。以PRS27a和RPS3为内参时,目的基因PGRP在筛胸梳爪叩甲幼虫体内被平沙绿僵菌诱导表达,7 d时较对照组显著升高,该现象与赤拟谷盗和油菜花露尾甲MeligethesaeneusPGRP基因被寄生物或病原菌诱导后表达上调相似[24−25]。Prx基因编码过氧化物还原酶(peroxiredoxin),是抗氧化家族中的一员,能够通过消除细胞内的活性氧(ROS)以维持氧化还原平衡[26]。以PRS27a和RPS3为内参时,目的基因Prx整体表达呈上升趋势,推测其可能在病程后期发挥作用。SDR蛋白(short-chain dehydrogenases/reductases,短链脱氢还原酶)是一个超级家族,由多种酶编码基因家族组成,在多种生物合成途径、细胞信号通路和病理途径中都扮演重要角色[27]。本研究发现:筛胸梳爪叩甲幼虫4个SDR基因[SDR(1)、SDR(2)、SDR(3)和SDR(4)]对绿僵菌侵染的响应机制不同,可能是因为参与过程不同。由上可见,以PRS27a和RPS3为内参时,筛胸梳爪叩甲幼虫PGRP、Prx和SDR这3类基因的表达模式符合赤拟谷盗和油菜花露尾甲等昆虫对病原菌的响应机制,进一步证实了该内参组合适用于绿僵菌侵染条件下的目的基因表达水平研究。
本研究首次报道了在平沙绿僵菌侵染条件下筛胸梳爪叩甲幼虫可用的内参基因(PRS27a和RPS3),为后续研究绿僵菌和竹林金针虫互作相关基因的表达奠定基础,也对其他昆虫基因表达以及虫菌互作相关研究提供参考。
