基线25(OH)D水平与2型糖尿病发病风险无相关性:基于5044例人群的前瞻性队列研究
2021-07-08汤旭磊车红霞甄洁玉刘丽娟刘进进关聪会傅松波王丽婷李红利王强梅甄东户
苏 姗,汤旭磊,车红霞,甄洁玉,刘丽娟,赵 楠,刘进进,关聪会,傅松波,王丽婷,李红利,张 迪,王强梅,甄东户
兰州大学1第一临床医学院,2第一医院内分泌科,甘肃 兰州 730000;3甘肃省第三人民医院内分泌科,甘肃 兰州 730000;4甘肃省人民医院妇科,甘肃 兰州 730000
中国2型糖尿病(T2DM)患病人数已高居全球首位[1],最新的流行病学调查显示中国18岁及以上成人糖尿病患病率达12.8%,糖尿病前期患病率为35.2%[2]。T2DM是一种以胰岛素抵抗为主要特征,由炎症因子介导的慢性低度炎症性疾病[3]。在T2DM小鼠模型中发现,维生素D受体(VDR)是炎症和胰岛β细胞存活的重要调节因子,维生素D与靶组织中的VDR特异性结合后,可通过调控基因表达,抑制炎症反应,改善胰岛β细胞的功能,从而降低血糖水平[4]。临床研究也初步表明,维生素D 水平与糖尿病患病率呈显著的负相关[5],T2DM患者补充维生素D3后,随着血清25(OH)D水平的升高,患者的糖化血红蛋白、空腹血糖、胰岛素抵抗指数均明显下降[6]。然而一项meta分析发现,补充维生素D3后,在非糖尿病患者中并不能预防糖尿病发生,在糖尿病前期或已确诊的T2DM患者中亦不能改善胰岛素抵抗及降低血糖水平[7]。目前的研究结果不一致,且多数研究仅仅限于基础和横断面研究,还未能明确阐明维生素D水平与糖尿病发生、发展的关系,也不能确定补充维生素D3是否能够改善糖尿病患者的血糖控制状况[8-11]。因此本研究以兰州市城关区社区40~75岁人群为研究对象,首次探讨了本地区维生素D水平与糖尿病前期、2型糖尿病发病风险之间的关系,进一步明确维生素D水平是否会影响糖尿病患者的血糖控制状况。
1 资料和方法
1.1 研究对象
该研究采取了西北地区“REACTION”研究的部分调查资料,于2011年7月~2012年9月对兰州市城关区铁路西村社区、天庆嘉园社区和广武门社区中年龄为40~75岁的6252名常住居民(居住时间≥5 年)进行了流行病学调查,于2014~2016年进行随访,最终以符合如下标准的5044人为研究对象。纳入标准:参加了2011~2012年流行病学调查及2014~2016年随访的人群;能独立完成问卷调查的人群;个人资料以及血液生化指标等资料完整者。排除标准:基线时未提供血样(n=62);有严重肝肾功能不全(丙氨酸转氨酶或谷草转氨酶>200 FU/L,Crea>178 μmol/L,n=6)、恶性肿瘤(n=121)、特殊类型糖尿病(n=24);近半年使用维生素D制剂及其衍生物制剂者以及激素生物免疫抑制剂者(n=26);2014~2016年随访期间失访者(969人)。该研究已获上海交通大学伦理委员会批准,所有参与者均获得书面知情同意。
1.2 研究方法
1.2.1 问卷调查 经由统一培训的工作人员采用标准化问卷对所有纳入的研究对象进行问卷调查,问卷内容主要包括性别、年龄、职业、文化程度、现病史及既往史、糖尿病家族史、吸烟饮酒史、近3~6月服用药物种类及名称等。
1.2.2 体格检查 测量身高、体质量、腰围、臀围,计算体质量指数(BMI)=体质量(kg)/[身高(m)]2,腰臀比(WHR)=腰围(cm)/臀围(cm);静息状态下,测量3次血压,并取收缩压、舒张压平均值。
1.2.3 生化检测 对研究人群进行清晨空腹状态(空腹至少8~10 h)下75 g无水葡萄糖口服耐量试验,抽取空腹血样和2 h血样,测定空腹血糖(FPG)和OGTT-2h后血糖(2hPG);抽取空腹静脉血测定糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C);采用酶免疫分析法测定血清25(OH)D(EIA;IDS Ltd,Boldon,英国)。
1.2.4 分组及判定标准(1)根据WHO(1999年)制定的诊断标准[12],DM:FPG≥7.0 mmol/L,和/或2h-PG≥11.1 mmol/L和/或既往诊断为糖尿病;IGR:FPG 6.1~7.0 mmol/L,和/或OGTT-2h PG介于7.8~11.1 mmol/L;NGR:FPG<6.1 mmol/L且OGTT-2h PPG<7.8 mmol/L;(2)血糖达标以2017 年版《中国2 型糖尿病防治指南》推荐的HbA1c<7%为准[13];(3)高血压判定标准按《中国高血压防治指南2018 年修订版》[14],在静息未使用降压药物的情况下,测量3 次取平均值,收缩压≥140 mmHg 或舒张压≥90 mmHg;(4)吸烟定义为目前吸卷烟或烟叶,且>1 d支或1 g/d烟叶,持续6月以上;饮酒定义为每周至少饮酒1 次,每次乙醇摄入量在50 g以上,并持续1年以上;(5)血清25(OH)D状态:血清25(OH)D≥30 ng/mL为维生素D充足,20 ng/mIL≤25(OH)D<30 ng/mIL 为维生素D 不足,25(OH)D<20 ng/mL为维生素D缺乏[15];(6)由于维生素D不同营养状态人群样本量存在明显差异,因此根据25(OH)D 水平四分位数将研究对象分为4 个亚组[Q1(2.24~11.76),Q2(11.77~16.19),Q3(16.20~20.22),Q4(20.23~65.69)ng/mL]。
1.3 统计学分析
1.3.1 样本量估计 本研究欲调查中老年人群维生素D水平与糖尿病发病的相关性,采取整群抽样的方法,根据以往资料发现中国中老年人群3~5年的糖尿病发病率约为8%[16],以95%的可信度,要求结果落在总体真实率的10%以内,根据公式:N=Z1-α/22(1-p)/ε2p 估算样本量。该研究中,p=0.076,ε=0.1,α=0.05,则Z1-α/2=1.96,计算结果如下:N=1.962×(1-0.08)/0.12×0.08=4417人,考虑到10%~20%的失访率,因此共需4417/0.8=5521例,而在实际研究中最初共纳入了6252名居民。
1.3.2 统计学方法 应用SPSS 23.0统计软件进行数据处理和分析,计量资料符合正态分布者用均数±标准差表示,多组间比较采用单因素方差分析,在方差齐时组间两两比较采用LSD-t 检验,方差不齐时采用Dunnett's T3检验,基线与随访资料比较采用配对t检验;非正态分布者计量资料采用中位数(四分位间距)[M(QR)]表示,多组间比较采用Kruskal-Wallis H检验,基线与随访资料比较采用Wilcoxon 符号秩检验。计数资料用例数和率表示,组间比较应用χ2检验,两两比较采用Bonferroni法。采用偏相关分析法探讨血清25(OH)D水平与糖脂代谢指标间的相关性。采用线性趋势卡方检验比较不同维生素D水平组的糖尿病前期及糖尿病累积发病率,并采用多因素Cox比例风险模型分析基线不同水平25(OH)D与糖尿病前期以及糖尿病发病风险的相关性,P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 基线不同糖代谢状态下的人群特征
本研究最终纳入基线研究人群5044名,其中男性1429人(28.3%),女性3615人(71.7%),年龄57.7±7.9岁,按基线不同糖代谢状态,将研究对象分为正常糖耐量(NGT组)(n=2447)、糖调节受损(IGR组)(n=1392)和T2DM 组(n=1205)。与NGT组比较,T2DM组以男性居多,年龄更大,有糖尿病家族史和吸烟的比例以及高血压、冠心病的患病率更高,且T2DM组的腰臀比、BMI、FPG、2h-PG、HbA1c、TC、TG 水平明显升高,而HDL-c水平显著低于NGT组,差异具有统计学意义(P<0.001)。NGT、IGR和T2DM 组人群的血25(OH)D水平分别为16.20(11.82,20.32)、15.93(11.42,19.83)、16.46(12.01,20.52)ng/mL,3组间25(OH)D水平差异不明显;NGT、IGR和T2DM组人群维生素D缺乏的患病率分别为73.7%、75.7%、71.7%,各组间差异无统计学意义(P>0.05,表1)。
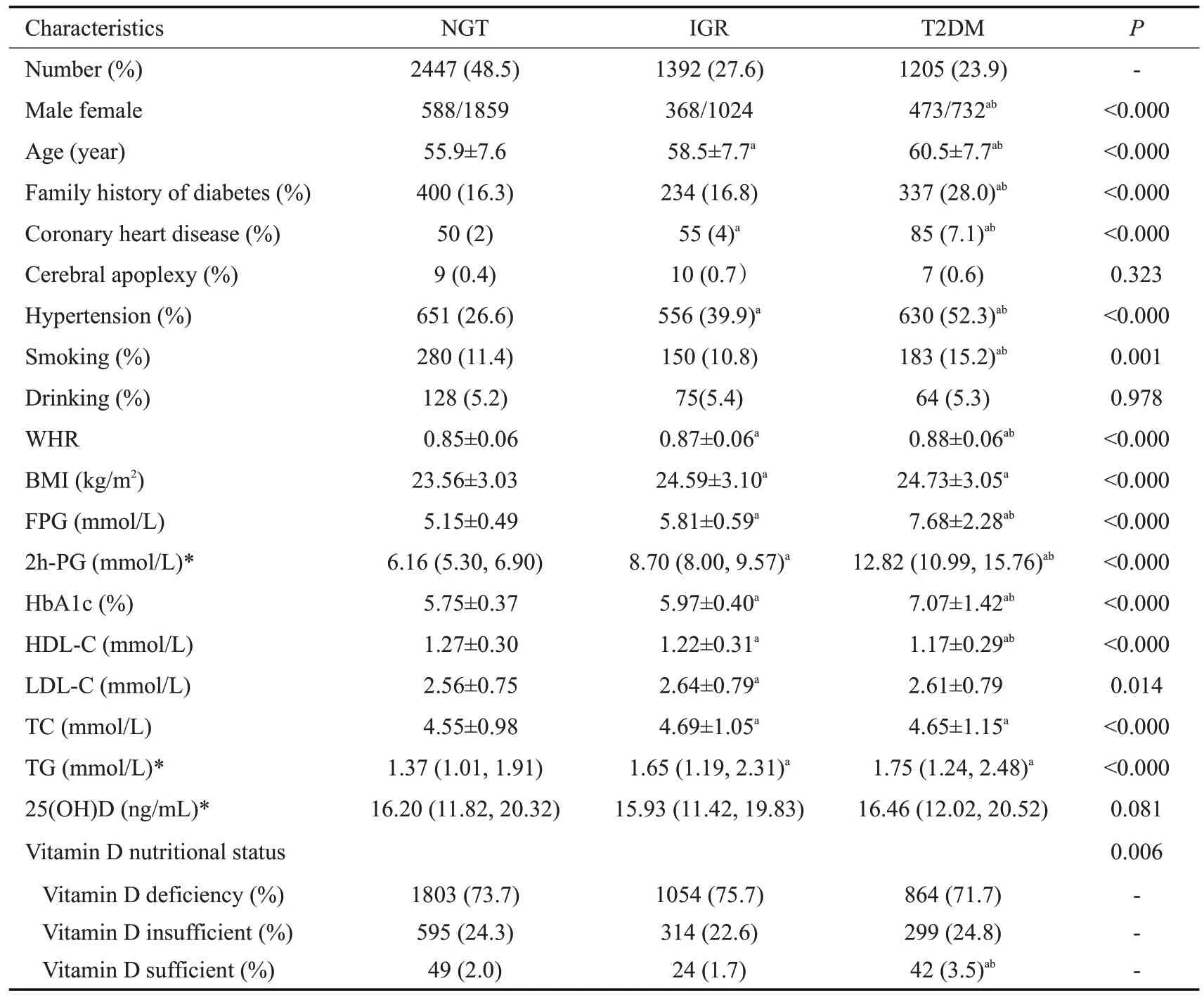
表1 基线不同糖代谢状态下的人群特征Tab.1 Demographic characteristics at baseline in groups with different glucose metabolism status
2.2 基线不同25(OH)D水平组的人群特征
根据25(OH)D水平四分位数将基线5044例研究对象分为4个亚组[Q1(2.24~11.76),Q2(11.77~16.19),Q3(16.20~20.22),Q4(20.23~65.69)ng/mL],4组间在性别、年龄、吸烟、饮酒率、WHR以及LDL-C具有显著差异(P<0.05)。与Q1组相比,其余3组有糖尿病家族史所占比例明显增高,而各组之间糖尿病前期及糖尿病患病率无明显差别,且不同25(OH)D水平组间FPG、2h-PG、HbA1c水平无显著差异(P>0.05,表2)。
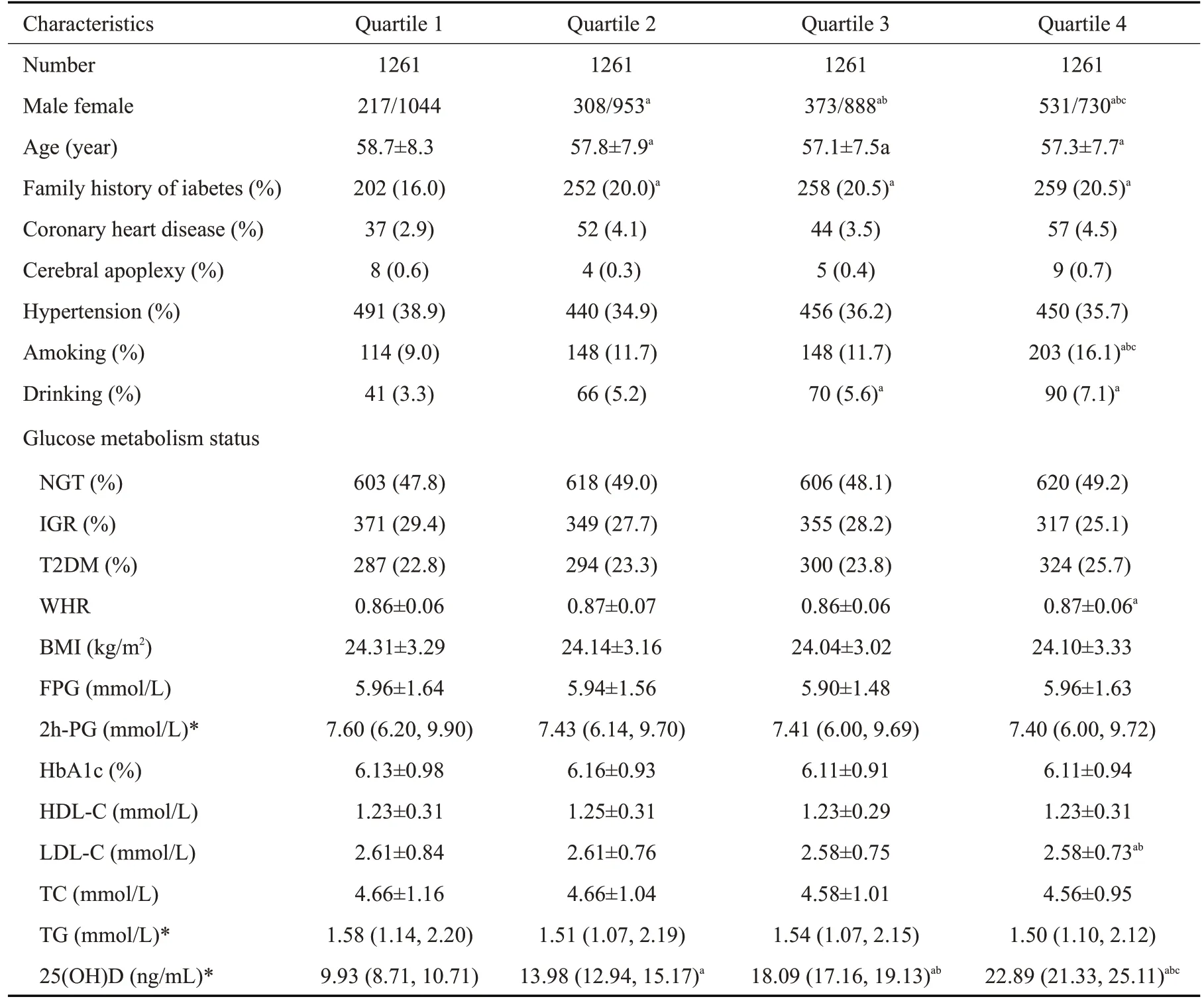
表2 基线不同25(OH)D水平组的人群特征Tab.2 Demographic characteristics of the 4 groups with different baseline 25(OH)D levels
2.3 基线25(OH)D水平与糖脂代谢指标的相关性
采用偏相关分析法探讨血清25(OH)D水平与糖脂代谢指标间的相关性,结果显示,血清25(OH)D水平与LDL-C、TC、TG呈负相关(P<0.05),而与FPG、2h-PG、HbA1c、HDL-C无相关性。在校正性别、年龄、BMI、腰臀比、有无糖尿病家族史、有无合并高血压、脑卒中、冠心病以及吸烟、饮酒史等混杂因素后,血清25(OH)D水平与FPG、2h-PG、HbA1c、HDL-C仍然不存在相关性,而与TG仍呈现出负相关(P<0.05,表3)。
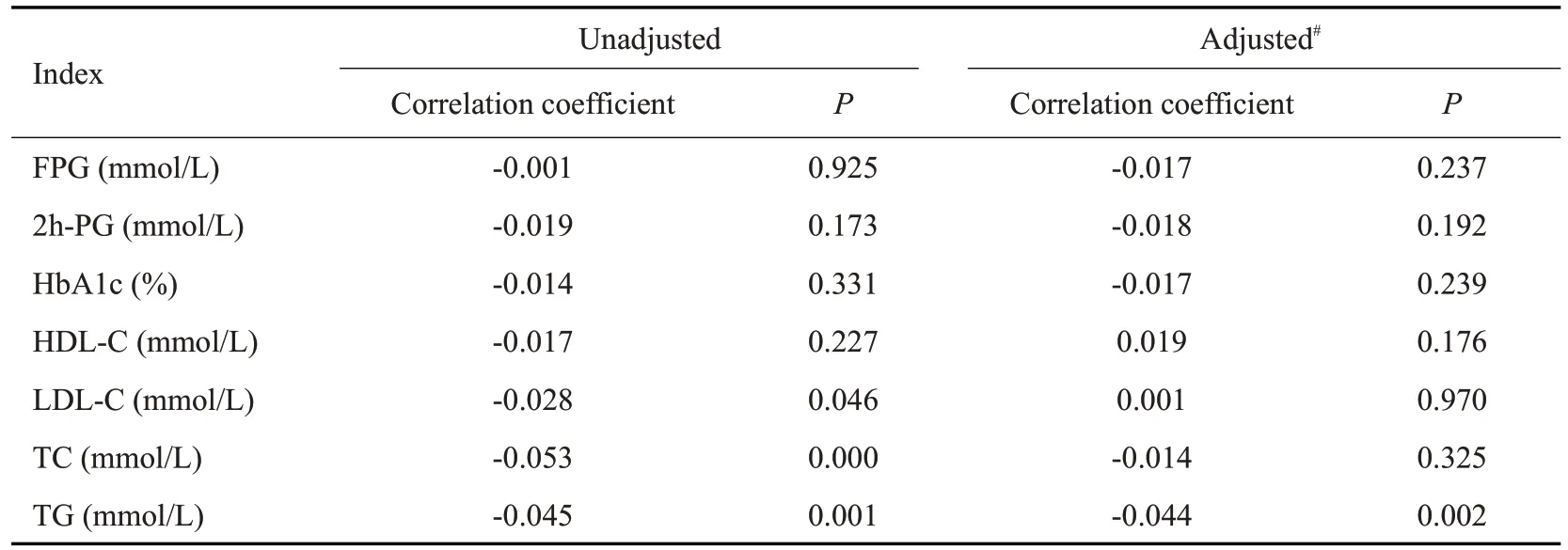
表3 基线25(OH)D水平与糖脂代谢指标的相关性Tab.3 Correlation between baseline 25(OH)D level and glucolipid metabolism index
2.4 随访后NGT人群糖尿病前期及糖尿病发病情况
2.4.1 NGT人群不同25(OH)D水平组糖尿病前期及糖尿病发病情况 在随访3.4±0.6年期间,2447名NGT人群共收集新发糖尿病前期389例(15.9%),新发糖尿病75例(3.1%)。不同25(OH)D水平组的糖尿病前期累积发病率分别为14.9%(90/603)、14.2%(88/618)、17.3%(105/606)、17.1%(106/620);4组的糖尿病累积发病率分别为2.7%(16/603)、3.9%(24/618)、2.8%(17/606)、2.9%(18/620),经线性趋势卡方检验,差异无统计学意义(χ2=1.038,趋势P=0.308,图1)。
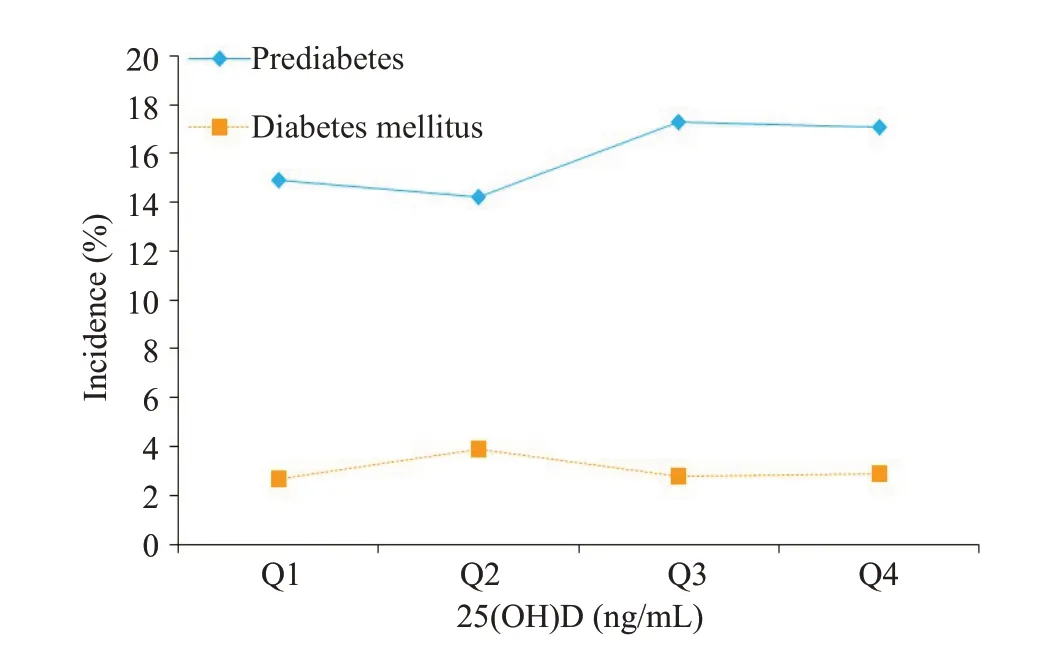
图1 基线NGT人群不同25(OH)D水平组糖尿病前期及糖尿病发病率Fig.1 Incidence of prediabetes and diabetes mellitus among participants with normal glucose tolerance in the 4 groups with different 25(OH)D levels.
2.4.2 NGT人群不同25(OH)D水平与糖尿病前期及糖尿病发病的相关性 在未调整混杂因素时,与Q1组相比,其余各组糖尿病前期及糖尿病发生风险未见显著增加或降低,调整性别、年龄、BMI、腰臀比、糖尿病家族史、高血压、脑卒中、冠心病、吸烟、饮酒、FPG、2hPG、HAb1c、HDL-C、LDL-C、TC以及TG等混杂因素后发现,与Q1组相比,第Q2、Q3、Q4组糖尿病前期及糖尿病发生风险仍无明显变化(P>0.05,表4)。
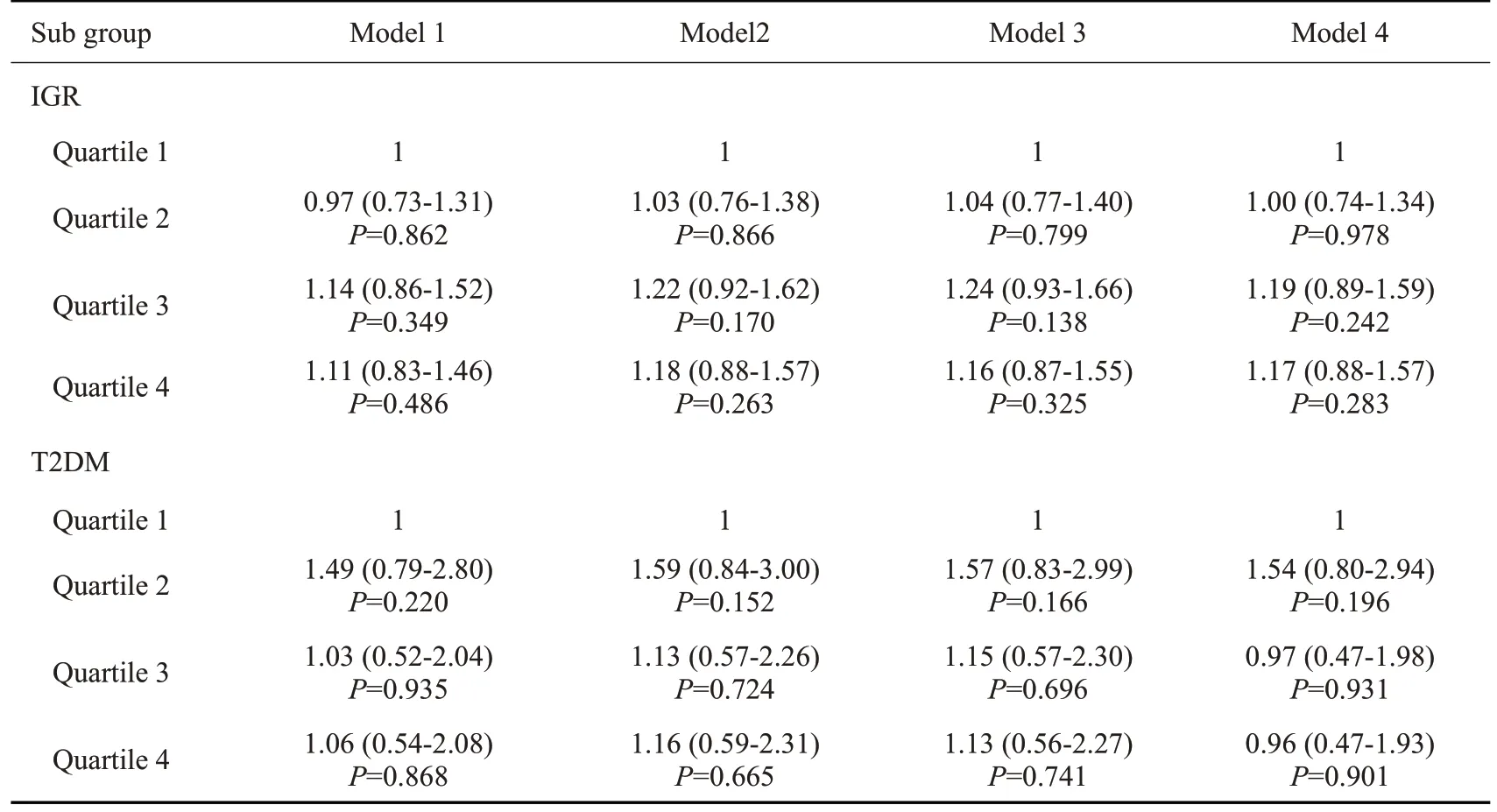
表4 NGT人群不同25(OH)D水平与糖尿病前期及糖尿病发病的相关性Tab.4 Correlation of 25(OH)D levels with the risk of prediabetes and diabetes in participants with normal glucose tolerance
2.5 随访后IGR人群糖尿病发病情况
2.5.1 不同25(OH)D水平组糖尿病发病情况 在随访期间,1392名IGR人群共收集新发糖尿病200例(14.4%)。Q1~Q4组的糖尿病累积发病率分别为12.9%(48/371)、17.2%(60/349)、14.6%(52/355)、12.6%(40/317),经线性趋势卡方检验,差异无统计学意义(χ2=0.109,P=0.742,图2)。
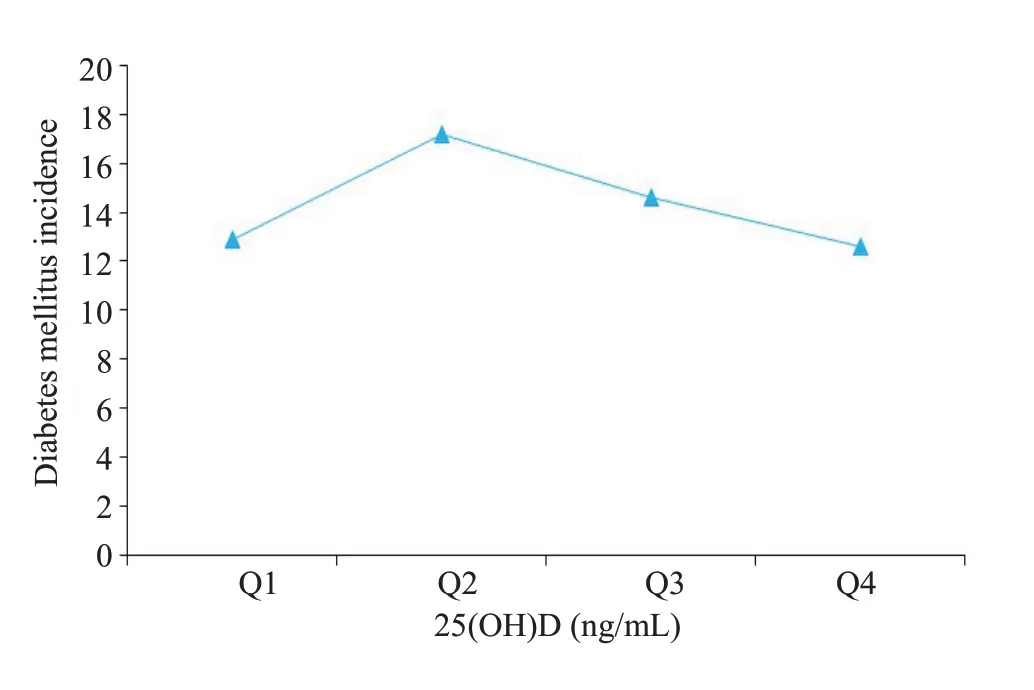
图2 基线IGR人群不同25(OH)D水平组糖尿病发病情况Fig.2 Incidence of diabetes mellitus among individuals with impaired glucose regulation(IGR)in the 4 subgroups.
2.5.2 IGR人群中不同25(OH)D水平与糖尿病发病的相关性 在IGR人群中,未调整混杂因素时,与Q1组相比,Q2、Q3、Q4组的糖尿病发生风险无明显增加或降低。调整混杂因素后,仍未观察到有意义关联(P>0.05,表5)。
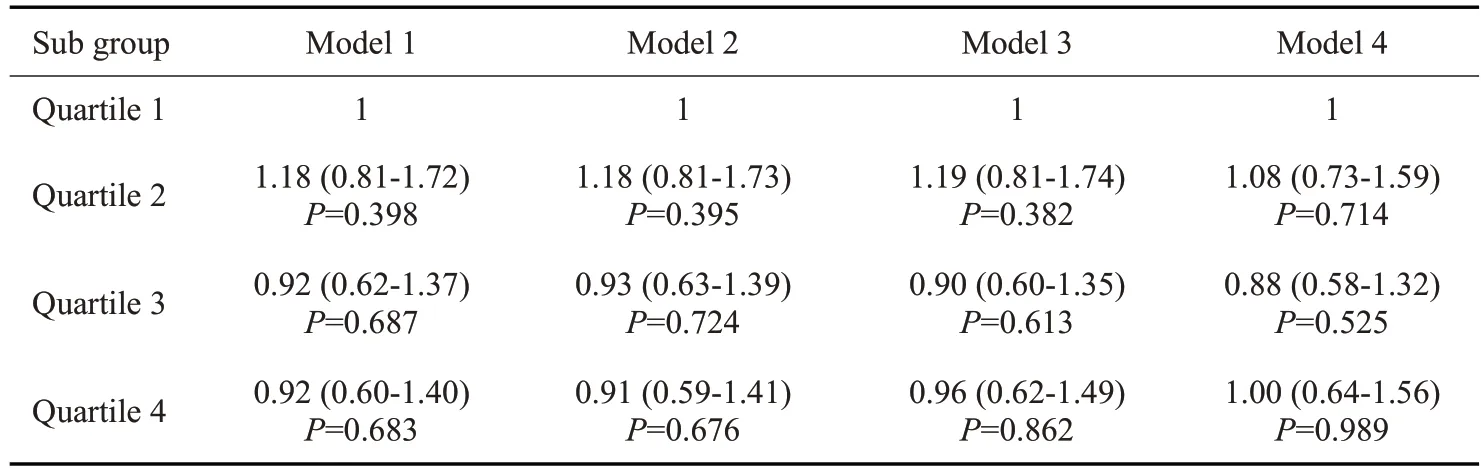
表5 IGR人群不同25(OH)D水平与糖尿病发病的相关性Tab.5 Correlation of 25(OH)D level with the risk of diabetes in individuals with IGR
2.6 T2DM人群不同25(OH)D水平组随访前后血糖控制情况比较
T2DM 人群随访后的血糖控制达标率显著高于随访前(60.6%vs 63.4%)。在基线时,4 组间随着的25(OH)D 水平升高,血糖控制达标率有所升高,HbA1c、FPG、2h-PG水平呈现出下降趋势,但仅Q4组2h-PG水平显著低于Q1组(P<0.05),余差异均无统计学意义;在随访后,4组的HbA1c、FPG、2h-PG水平均较随访前有所降低,血糖控制达标率高于随访前,但4组之间比较,无论是血糖控制达标率还是HbA1c、FPG、2h-PG水平,差异均无统计学意义(P>0.05,表6)。
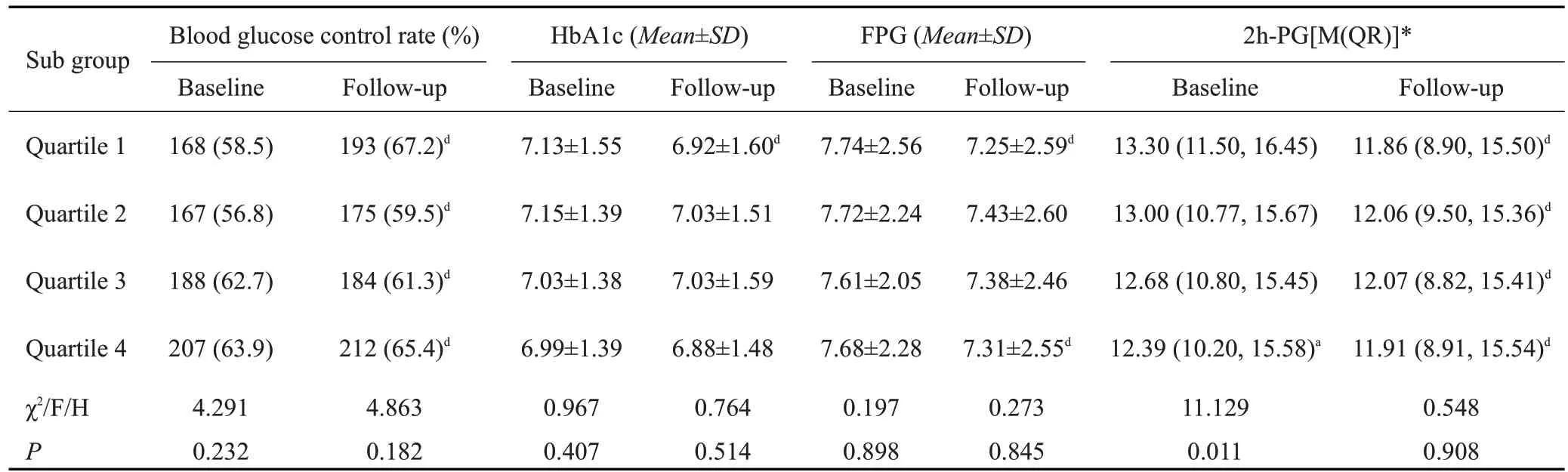
表6 T2DM人群不同25(OH)D水平组随访前后血糖控制情况比较Tab.6 Comparision of blood glucose control in T2DM patients before and after follow-up in the 4 groups with different 25(OH)D levels
3 讨论
糖尿病已成为继心脑血管疾病、肿瘤后的又一严重危害大众健康的慢性非传染性疾病,其患病率、发病率以及致死率高、并发症多的特点给社会及家庭带来沉重的经济和生活负担[2]。韩国的一项前瞻性队列研究对7688名40~69岁无糖尿病的受试者进行了12年的随访,结果发现糖尿病发病率高达19.0%[17]。而在中国,有研究对我国8省市7064名成人随访6~7年后发现,糖尿病前期发病率为14.8%,糖尿病发病率为6.7%[18];天津市的一项前瞻性队列研究对5077名18~90岁的社区居民随访5年后,糖尿病发病率为6.5%[19];阮晓楠等[20]报道了上海社区798名35~74岁基线时无糖尿病的人群在随访3年后,糖尿病前期的累积发病率为12.59%,糖尿病3年累积发病率为6.39%,其中基线糖尿病前期的人群约有17.17%进展为糖尿病。这与赵娅等[21]研究报道的四川省泸州市糖尿病前期人群随访3年后糖尿病发病率的结果相似(17.25%)。本研究利用2011年《中国2型糖尿病患者肿瘤发生风险的流行病学研究》(REACTION研究)甘肃兰州地区的研究资料,以40~75岁的5044例人群为研究对象,结果发现在平均随访3.4年后,总体人群糖尿病前期累积发病率约为15.9%,糖尿病累积发病率为7.1%,其中,在NGT人群中,糖尿病前期及糖尿病的累积发病率分别为15.9%、3.1%;而在IGR患者中,约有14.4%的人群在随访3.4年后发展为糖尿病。与上述两项研究相比[20-21],本研究人群糖尿病前期进展为糖尿病的风险较低,但对于本地区来说,糖尿病前期人群转归为糖尿病的风险明显高于正常糖耐量人群,因此,早期筛查糖尿病前期人群并采取干预措施对延缓或预防糖尿病的发生至关重要。
维生素D是一种脂溶性维生素,主要由人体表皮内储存的7-脱氢胆固醇受B型紫外线辐射照射后合成,除了经典的调节钙磷代谢及骨代谢外,其在内分泌、心血管、免疫等多种系统中也具有重要作用[15]。目前维生素D缺乏也已成为全世界范围内重要的公共卫生问题,流行病学研究表明,我国86%的人群存在维生素D水平缺乏或不足,仅有14%的人群维生素D水平属于正常[22]。近年来研究发现,2型糖尿病患者易出现维生素D缺乏现象,其25(OH)D水平显著低于正常糖耐量人群,且25(OH)D水平与糖脂代谢指标呈负相关[23],而补充维生素D(60 000 U/周)8周后,从糖尿病前期发展为糖尿病的机率降低了58%[24]。本研究发现,在甘肃兰州城关区中老年人群血清25(OH)D中位水平为16.19(11.75,20.22)ng/mL,维生素D缺乏的患病率高达73.8%,且女性比男性更普遍(78.7%vs 61.4%),而维生素D充足者仅占2.3%,进一步证实了我国维生素D普遍缺乏的现象。令人意外的是,我们的研究进一步发现,与NGT人群相比,IGR以及T2DM患者的血25(OH)D水平未见明显升高或降低,维生素D缺乏的患病率并无明显增加,而且25(OH)D水平与FPG、2h-PG、HbA1c指标均无显著相关性。既往一项临床对照研究[25]与我们的研究结论一致,该研究对912名受试者(包括429名T2DM和483名非DM)进行了分析,结果发现维生素D缺乏在2型糖尿病和非糖尿病人群中均普遍存在,两组维生素D缺乏患病率无差异,且维生素D水平与HbA1c及胰岛素抵抗无显著相关性。
虽然关于维生素D与糖尿病患病风险、胰岛素抵抗以及糖代谢指标相关性的研究结果不一致,但目前仍有许多机制研究发现维生素D在保护胰岛β细胞和促进胰岛素分泌方面起到重要作用,其主要通过VDR来介导发挥生物学功能:一方面,活性维生素D与免疫细胞和炎性细胞上的VDR特异性结合后,可抑制T淋巴细胞增殖和树突细胞的成熟,减弱IL-6、TNF-α等炎症因子对胰岛β细胞的破坏[26-27];另一方面,胰岛β细胞也可表达VDR及1α-羟化酶,维生素D与β细胞上的VDR结合后可直接刺激β细胞分泌更多的胰岛素[28];此外,胰岛素分泌过程依赖钙离子,而维生素D作为钙调节剂,与胰腺组织中维生素D依赖的钙结合蛋白结合后,可促进细胞外钙离子内流,增加细胞内钙离子浓度,进一步刺激体内胰岛素分泌[29]。
临床研究也表明维生素D缺乏是T2DM发病的危险因素:纳入21项前瞻性研究(含76 220例无糖尿病受试者和4996例2型糖尿病患者)的meta分析[30]发现,25(OH)D 水平与2 型糖尿病发病风险呈显著负相关,25(OH)D水平每增加10 nmol/L,2型糖尿病发病风险降低4%。Deleskog等[31]对2378名35~56岁无2型糖尿病的参与者进行了8~10年的随访,结果发现无论男女,25(OH)D每增加10 nmol/L,从糖尿病前期到2型糖尿病的进展风险都降低了约25%。进而我们对5044名不同糖代谢状态人群进行平均3.4±0.6年的随访,结果发现无论是在NGT人群还是IGR人群中,基线25(OH)D水平的升高并不能减少糖尿病前期及糖尿病的发病风险。一项为期11年的前瞻性队列研究的结论与我们一致,该研究分析了6119 名基线非糖尿病参与者的25(OH)D水平与2型糖尿病发病风险的关系,在随访11年后,共有247例参与者发生了2型糖尿病,其发病率约为4.0%,进一步发现,随着25(OH)D 水平的降低,T2DM 的发病风险逐渐增加,但当校正BMI 后,基线25(OH)D水平与T2DM发病风险之间的关系消失[32]。此外,芬兰的一项前瞻性研究也得出了同样的结论[33]。众所周知,活性维生素D主要通过VDR受体发挥生物学功能[15],目前的相关研究主要都集中于维生素D浓度本身对糖尿病的影响,而对于VDR基因多态性以及受体后作用与糖尿病相关性的研究较少,仅仅还停留在基础研究水平[4],同时也有少数临床研究[34]发现,VDR的FokI位点单核苷酸多态性与T2DM易感性存在较强的相关性,该位点基因突变是T2DM发生的危险因素;在中国人群中的研究[35-36]也发现,福建省汉族人群VDR的BsmⅠ基因位点和ApaⅠ基因位点多态性与T2DM易感性相关。因此,不仅仅是维生素D浓度本身与糖尿病有关,维生素D受体后作用与VDR基因多态性可能亦是糖尿病发生发展的重要因素,需要更深入的机制研究探讨其原因。
在本研究中,基线T2DM患者在经历3.4±0.6年的随访后,血糖达标率显著高于随访前(63.4%vs 60.6%),提示兰州地区糖尿病患者的血糖控制情况明显改善。后续我们进一步发现,维生素D水平对基线及随访后患者血糖控制情况均无明显影响。一项病例对照研究发现T2DM患者的25(OH)D水平与FPG、HbA1c水平无相关性[37],进而一项双盲、随机、安慰剂对照试验给予维生素D 缺乏的T2DM 患者间断大剂量补充胆骨化醇(50 000 U/月),6月后患者的HbA1c、空腹胰岛素、血糖以及胰岛素抵抗指数无显著改变[38]。但也有研究发现,25(OH)D与T2DM患者的HbA1c水平存在线性负相关[39]。因此,需要更多深入研究进一步研讨维生素D水平对血糖控制的影响。
本研究是一项前瞻性队列研究,有诸多的不足之处,首先是随访时间较短,可能会导致维生素D对糖尿病发生、发展结局的影响未能显现;其次,没有进行干预性研究进一步明确补充维生素D是否可延缓糖尿病的发生及进展;此外,VDR 基因多态性与本地区人群T2DM发病的相关性研究仍是空白;最后,本研究未分析随访前后维生素D水平变化对糖尿病发病的影响。
综上所述,甘肃兰州市城关区中老年人群的糖尿病发病率高,尤其是IGR人群演进为糖尿病的情况不容乐观;但本地区糖尿病患者的血糖控制情况明显改善;本研究进一步发现基线人群25(OH)D水平的高低与糖尿病前期及糖尿病的发病风险无关,亦与T2DM患者的血糖控制情况无明显相关性。