三硫二苄基抑制头颈部鳞状癌细胞HN30的增殖并诱导其凋亡
2021-07-08徐璐,钱峰,孙磊
徐 璐,钱 峰,孙 磊
上海交通大学药学院细胞与治疗抗体工程研究中心,上海 200240
头颈癌是好发于人口腔、鼻腔、咽、喉等部位粘膜表面的鳞状细胞癌,据统计仅2018年就有超过90万新发病例,死亡人数超过40万,严重威胁人类健康[1-2]。目前,头颈癌的首选治疗手段是手术切除、放化疗[3],但由于放射性治疗对人体存在的毒性反应,有20%~30%的患者无法完成整体放化疗过程[4]。对于中晚期并伴随局部淋巴结转移的头颈癌患者,寻找有效的抗头颈癌药物对于提高患者生存期及生活质量至关重要。三硫二苄基(DTS)是商陆科蒜香草(Petiveria alliacea L)中的一种主要活性成分[5]。该药用植物在民间被广泛运用于哮喘、关节炎、肿瘤等疾病的治疗[6],现代药理研究证实其在各种中枢神经系统疾病中也具有明显疗效,例如焦虑、疼痛、记忆力减退和癫痫发作等,能够有效改善大脑认知、记忆和学习能力[6-7]。有研究显示DTS及其类似物能够抑制多种肿瘤细胞的增殖[8],但DTS在头颈癌中的作用尚未报道。
抗凋亡是肿瘤细胞的一种恶性表型,目前多数肿瘤治疗策略与细胞凋亡信号通路激活相关[9]。线粒体介导的凋亡依赖于线粒体外膜上Bcl-2家族蛋白之间的相互作用以及细胞色素c的释放,从而促进一系列凋亡蛋白酶包括caspase-3的激活[10];同时线粒体外膜通透性的增高也会导致线粒体去极化,造成线粒体膜电位降低以及凋亡因子释放[11]。已知PI3K/Akt信号通路广泛参与了多种癌症的发病机制,由生存因子诱导的Akt激活可以抑制细胞凋亡,调控细胞生长和分化[12]。p53是多种肿瘤的抑制因子,能够调控细胞周期,也是早期头颈癌常见的突变基因[13]。本研究阐明了DTS对头颈癌细胞HN30增殖和凋亡的影响,并对其作用机制作进一步探讨。
1 材料和方法
1.1 试剂
三硫二苄基(Cato Research Chemicals)(C14H14S3,MW:278.46,纯度≥98.0%,CAS:6493-73-8);DMEM培养基、青霉素-链霉素双抗(100×)、胰酶(Thermo Fisher);胎牛血清(浙江天杭生物);结晶紫、MTT粉末(生工生物工程(上海));Annexin Ⅴ-FITC细胞凋亡检测试剂盒(杭州联科生物);线粒体膜电位检测试剂盒(JC-1)、RIPA裂解液、BCA蛋白浓度测定试剂盒(上海碧云天);一抗β-actin,caspase-3,cleaved caspase-3,Bcl-2,p-Akt,Akt,p-p53,p53(Cell Signaling Technology);人源头颈部鳞状癌细胞株HN30(美国菌种保藏中心)。
1.2 细胞培养
人源头颈部鳞状癌细胞株HN30、HN12和SCC25所用培养基为含10%胎牛血清及1%双抗的DMEM培养基,置于37 ℃、5%CO2培养箱中进行培养。观察到细胞状态良好,于生长对数期进行胰酶消化、传代操作。
1.3 克隆形成实验
分别取处于对数生长期且状态良好的HN30、HN12和SCC25细胞,胰酶消化并离心收集,梯度稀释后以400/孔的细胞密度接种至六孔板,加入2 mL/孔的培养液以及相应浓度的DTS,37 ℃、5%CO2条件下培养7 d。待显微镜下观察到单个克隆点含有50及以上细胞,终止培养,弃上清,甲醇固定20 min,0.1%结晶紫染色,20 min后洗去染色液晾干拍照,克隆点计数。实验重复3次。
1.4 MTT实验
准确称量MTT 粉末并用无菌PBS 溶解,得到5 mg/mL的MTT溶液。收集处于对数生长期且状态良好的HN30细胞,梯度稀释后以1×103/孔的细胞密度接种至96孔板,过夜培养。每孔换新鲜培养液200 μL,并加入相应浓度的DTS孵育24 h。孵育结束,每孔加入20 μL5 mg/mL的MTT溶液,继续培养4 h。弃上清,每孔加入100 μL DMSO,置于水平摇床上,震荡5~10 min,待孔内紫色沉淀充分溶解,酶标仪测定490 nm 处的A490nm。各组设6个复孔,实验重复3次。
1.5 凋亡检测
收集处于对数生长期且状态良好的HN30细胞,以4×105/孔的细胞密度接种至12孔板,过夜培养。每孔换新鲜培养液2 mL,并加入相应浓度的DTS孵育24 h。孵育结束,消化、收集细胞,冷PBS洗3遍。根据细胞凋亡检测试剂盒说明书,加入1×binding buffer重悬,转移至流式管中,加入FITC和PI染液避光孵育。流式细胞仪(LSRFortessaTMX-20;BD Biosciences)上机检测,结果通过Flowjo 7.6软件进行分析。实验重复3次。
1.6 线粒体膜电位检测
收集处于对数生长期且状态良好的HN30细胞,以4×105/孔的细胞密度接种至12孔板,过夜培养。每孔换新鲜培养液2 mL,并加入相应浓度的DTS孵育24 h。孵育结束,消化、收集细胞,冷PBS洗3遍。根据线粒体膜电位检测试剂盒说明书,配置JC-1染色工作液,避光孵育20 min后,离心,用JC-1染色缓冲液洗3遍,PBS重悬。流式细胞仪上机检测,结果通过Flowjo 7.6软件进行分析。实验重复3次。
1.7 Western blot 蛋白印迹分析
1.7.1 蛋白样品处理 将HN30细胞以1×106/孔的细胞密度接种至六孔板,贴壁后加入相应浓度的药物刺激。用RIPA裂解液裂解蛋白,根据BCA定量结果调齐蛋白浓度。
1.7.2 电泳及转膜 配置10%SDS-聚丙烯酰胺凝胶。电压80 V至各孔样品跑齐,调整电压为120 V至样品跑到底。取出蛋白胶,按“纤维垫-滤纸-胶-膜-滤纸-纤维垫”的顺序放置,电压110 V 将蛋白转至硝酸纤维素(NC)膜上。转膜结束,取出NC膜,在5%的脱脂牛奶中室温封闭2 h。1×TNET buffer 洗膜,4 ℃下与对应的一抗孵育14 h,1×TNET buffer 洗膜。室温孵育二抗2 h,1×TNET buffer 洗膜。现配ECL 显影液,使用Bio-Rad 凝胶成像系统进行条带显色和拍照。实验重复3次。
1.8 统计学分析
本研究各实验均进行3次重复,数据结果以均数±标准差表示,作图与分析采用Graph Pad Prim 5软件,统计学差异比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 DTS抑制头颈癌细胞增殖
克隆形成实验结果显示,DTS结构如图1A所示,在DTS刺激下,与溶剂对照组相比,不同头颈癌细胞株HN30、HN12和SCC25的增殖能力均被抑制,且随DTS浓度增加,克隆点的数目逐渐减少(图1B)。对HN30细胞的克隆点进行统计,1 μmol/L DTS 作用下,HN30 增殖几乎被完全抑制(图1C,P<0.001)。MTT实验结果显示,不同浓度DTS刺激HN30细胞24 h后,细胞活力显著降低(图1F,P<0.01),呈现剂量依赖性。
2.2 DTS诱导HN30细胞凋亡
DTS刺激HN30细胞24 h,凋亡细胞比例显著增多(图2A)。对第一象限及第四象限的凋亡细胞进行统计分析显示,DTS能够诱导HN30细胞凋亡,且具有剂量依赖性(P<0.05,图2B)。
2.3 DTS诱导HN30细胞线粒体膜电位降低
当细胞发生线粒体依赖性的早期凋亡,线粒体膜电位下降,JC-1探针由聚合物(红色荧光)转变为单体(绿色荧光)。在DTS刺激下,呈绿色荧光的细胞群体(右下)比例增多(图3A),对JC-1单体比例进行统计分析显示,随DTS浓度升高,JC-1单体比例逐渐增多(P<0.01,图3B)。
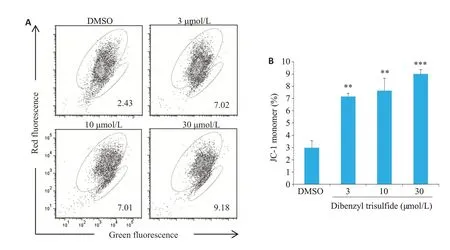
图3 DTS诱导HN30细胞线粒体膜电位降低Fig.3 DTS reduces mitochondrial membrane potential in HN30 cells.A:JC-1 fluorescent probe staining for detecting mitochondrial membrane potential of HN30 cells treated with 3,10,and 30 μmol/L DTS for 24 h;B:Percentages of JC-1 monomer cells.**P<0.01,***P<0.001 vs the solvent control group.
2.4 DTS调控HN30细胞凋亡相关蛋白表达
不同浓度的DTS刺激HN30细胞24 h后,caspase-3表达降低,有活性的cleaved caspase-3表达升高,而Bcl-2含量显著降低(图4A)。分别对caspase-3、cleaved caspase-3和Bcl-2的蛋白条带进行灰度分析,结果显示,DTS能够调控HN30细胞的凋亡信号通路,诱导凋亡蛋白酶cleaved caspase-3 的表达,抑制抗凋亡蛋白Bcl-2的表达(P<0.05,图4BC)。
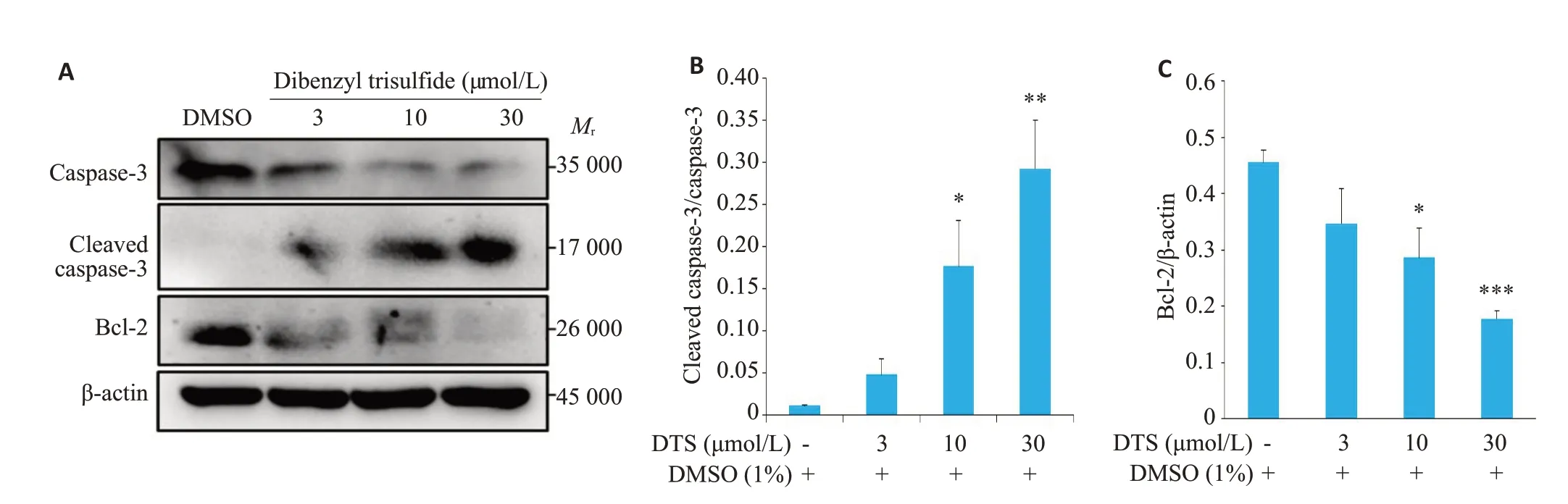
图4 DTS调控HN30细胞凋亡相关蛋白表达Fig.4 DTS regulates the expression of apoptosis-related proteins in HN30 cells.A:Western blot analysis of the expression of caspase-3,cleaved caspase-3 and Bcl-2 in HN30 cells after treatment with DTS(3,10,30 and μmol/L)for 24 h.B,C:Quantification of the protein expressions.*P<0.05,**P<0.01,***P<0.001 vs the solvent control group.
2.5 DTS能够抑制HN30细胞中Akt的磷酸化并激活p53通路
通过Western blot 检测Akt 及p53 蛋白的变化,10 μmol/L DTS 刺激HN30 细胞,在不同时间点检测HN30细胞Akt及p53的表达,结果显示,DTS刺激下,HN30 细胞Akt 磷酸化(Ser 473)降低,p53 磷酸化(Ser 15)增强,在16 h作用显著(图5A)。分别对Akt及p53的总蛋白水平和磷酸化水平进行灰度分析,结果显示,随着DTS作用时间延长,HN30细胞的Akt磷酸化被抑制,而p53磷酸化被激活(P<0.05,图5B、C)。

图5 DTS能够抑制HN30细胞中Akt的磷酸化并激活p53通路Fig.5 DTS inhibits the phosphorylation of Akt and activates p53 pathway in HN30 cells.A:Western blot analysis of the phosphorylation level of Akt and p53 after treatment with DTS(10 μmol/L)for 0.5,1,2,4,8,and 16 h.B-D:Quantification of the protein expressions.*P<0.05,**P<0.01,***P<0.001 vs the 0 h group.
3 讨论
本研究发现活性含硫化合物DTS对头颈癌HN30细胞具有显著的增殖抑制和凋亡诱导作用。DTS刺激后,HN30细胞中cleaved caspase-3蛋白呈剂量依赖性增加,Bcl-2蛋白呈剂量依赖性降低;同时,随着DTS作用时间延长,Akt磷酸化受到抑制,p53的磷酸化水平增加。这些结果表明DTS在HN30细胞中具有显著的抗肿瘤活性。
DTS是从药用植物Petiveria alliacea L中分离出的一种多硫化物,早期被报道具有抗病毒、消炎镇痛、免疫调节等作用[14],但是针对单体化合物DTS的抗肿瘤作用机制研究较少,本研究旨在探讨DTS单体化合物的抗肿瘤作用。已有文献报道,作为特异性RSK激酶抑制剂,WST-1初步检测发现DTS对肺癌、乳腺癌及胰腺癌细胞具有体外抗增殖作用[8]。与本研究结果相似,DTS在头颈癌中也被证实具有抗增殖活性,但本研究发现DTS 还具有显著的凋亡诱导作用,进一步确证了DTS对头颈癌的抗肿瘤作用。目前,针对DTS抗肿瘤作用的机制研究很少,深入探寻其作用靶点十分必要。有研究表明DTS能减弱神经母细胞瘤SH-SY5Y细胞中丝裂原活化蛋白激酶MAPK(Erk1/2)酪氨酸残基的去磷酸化,造成细胞微管解聚并抑制神经突触生长[15]。研究显示,DTS的类似物双(4-氟苄基)三硫化物通过共价结合β-微管蛋白Cys 12残基,直接抑制微管聚合,导致微管稳定性的破坏,从而阻滞细胞的G2/M期[16]。与已有研究不同,本研究通过时间依赖性实验证实DTS可能影响Akt和p53蛋白的磷酸化,在头颈癌HN30细胞中发挥作用,并且其凋亡诱导与线粒体膜电位降低相关,进一步丰富了DTS在抗肿瘤机制方面的研究结果。
Akt参与调节细胞存活、增殖、生长、凋亡、糖原代谢等多过程,具有广泛的生物学活性,研究发现Akt的磷酸化影响了多种肿瘤细胞的凋亡、迁移[17]。对大肠癌患者的结直肠组织的分析结果显示p-Akt表达的上调与肿瘤发生发展、侵袭转移密切相关[18]。在HER2阳性乳腺癌中,p-AKT的高基础水平表达与肿瘤进展和耐药性相关[19]。本研究中,DTS刺激不同时间收集HN30细胞蛋白,通过免疫印迹实验发现Akt总蛋白水平未见明显差异,但p-Akt表达量明显抑制,证实DTS对于HN30细胞的抗肿瘤活性与p-Akt的抑制相关。
肿瘤抑制蛋白p53调控细胞凋亡、周期及DNA损伤修复过程,在恶性肿瘤的发展和进程中起着至关重要的作用,因本身基因突变或激活机制缺陷,p53在多种肿瘤中处于功能丧失状态,因此靶向p53成为目前肿瘤治疗的热点[20-22]。本研究中,DTS作用后,p53总蛋白及p53磷酸化均显著增加,表明DTS通过促进p53的磷酸化,激活p53功能从而影响了HN30细胞的增殖和凋亡。
本研究发现DTS能够有效抑制头颈部鳞状癌细胞HN30的增殖,并激活凋亡相关信号通路以线粒体途径诱导细胞凋亡,其作用机制与Akt/p53信号通路相关。该发现揭示了DTS作为潜在抗肿瘤活性药物可能的作用机制和靶点,同时也为头颈癌的治疗提供了参考依据。