表面增强拉曼散射技术在蛋白质类物质检测中的研究进展
2021-06-28韩子郭晓东王元凤魏新林
韩子,郭晓东,王元凤,魏新林*
1.上海交通大学农业与生物学院(上海 200240);2.上海师范大学生命科学学院(上海 200234)
蛋白类物质的检测被广泛应用于医疗诊断、食品及环境检测等领域。其常用的检测方法包括酶联免疫吸附反应(ELISA)[1]、电化学[2]、基于荧光的蛋白质微阵列[3]等。然而,传统的蛋白质检测方法需要消耗大量材料,操作复杂、产量低,影响在实际检测中的应用[4]。
拉曼散射现象推动检测技术的革新,但较弱的拉曼效应及低灵敏度阻碍其大规模发展;表面增强拉曼散射(surface enhanced Raman scattering,SERS)技术的发现在增强拉曼信号方面提供了新的解决思路。SERS技术基于贵金属的聚集效应,将待测分子吸附在纳米级粗糙金属表面,使得入射光激发金属表面电子产生更强烈的共振,极大地增强了拉曼信号[5]。随着研究日益深入,SERS技术成为小分子、大分子蛋白质甚至细胞生物分子分析必不可少的超灵敏分析工具,它可以通过分子的拉曼指纹图谱实现对待测分子的无标记检测[6]。对SERS技术的发展及原理进行概述,对SERS及其联用技术在蛋白质类物质检测中的应用进行介绍,为建立基于SERS的蛋白质检测方法提供参考。
1 拉曼散射、表面增强拉曼(SERS)光谱及SERS基底
1928年,拉曼等[7]发现散射光波长相对于入射光发生改变,该现象因此被命名为“拉曼散射”。由于拉曼散射是入射光子(h)的非弹性散射,能够因其特征分子振动的能量而在频率上发生位移(图1a);依据散射后波长的增加或降低,可分为斯托克斯散射(h1)和反斯托克斯散射(h2)[8]。1974年,Fleischmann等[9]发现粗糙银电极上吡啶产生的拉曼信号有所增强的现象,即表面增强拉曼散射(SERS)。其原理图如图1(b)所示。SERS效应产生的原理被认为是由电磁增强和化学增强介导的[10]。电磁增强理论认为,入射光可以激发纳米金属表面的电子产生局域表面等离子体共振(LSPR);而化学增强(电荷转移效应)机制具有一定的限制性,只适用于能与金属表面形成化学键的物质[11]。材料的尺寸、形状、颗粒间距及介质环境均会影响LSPR强度[12]进而影响SERS效应,因此,选择合适的SERS基底尤为重要。
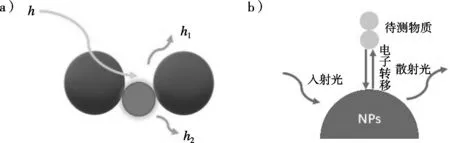
图1 拉曼散射的原理[13](a)和表面增强拉曼散射(SERS)的原理[14](b)
为扩大表面增强拉曼光谱技术的应用规模,该技术的灵敏度、重复性、稳定性、基底成本和制造的简易性等问题亟待解决[15]。SERS活性纳米的结构由2种类型的基质组成:基于固体表面的基质和基于胶体的基质[16]。固相的SERS基底有助于制备高度增强信号的表面金属纳米结构,如将纳米颗粒直接沉积在氨基硅烷涂层表面或利用纳米光刻技术、电子束光刻技术等制备纳米三角阵列或纳米球[17];金或银的纳米颗粒液相体系也是常用的SERS基底,与固态基底相比表现出了更好的分散均匀性[18]。基于对固相及液相SERS基底的改进将有助于开发检测性能更高的SERS技术。
作为一种强大的分析及成像工具,SERS图谱可以提供更加丰富的振动光谱信息,使其在食品分析、药物分析、生物医学方面获得广泛应用[19-25]。根据检测方法的不同,基于SERS的蛋白检测可以分为两类,一类是SERS直接检测法,另一类是基于SERS的联用技术。
2 SERS直接检测技术
直接法是SERS中最简单常用的方法,可获取与等离子体材料直接接触的目标分析物的SERS光谱,同时能获取蛋白质振动光谱中的信息;该种方法灵敏度高,某些情况下甚至可以检测到单分子[26]。
通过SERS检测蛋白质的策略是基于目标蛋白存在条件下贵金属胶体的化学或物理聚集,纳米簇聚集产生的交互效应可以产生较高的电场强度,这些以高电场强度聚集的局部区域被称为“热点”[27]。贵金属纳米粒子因具备良好的等离子体共振效应及易于调谐的几何学性质,能够提供丰富的“热点”,常被用于基于SERS技术的检测。Chen等[28]开发金纳米棒(Au NR)修饰的氧化石墨烯作为底物,以裸露的Au NRS为探针的新型夹心免疫结构为SERS基底,用于肿瘤标志物癌胚抗原(CEA)的定量检测;受到化学和电磁增强的共同作用,检测限可达3.01 pg/mL。在SERS直接检测中,纳米粒子的尺寸和拉曼照明波长能够影响金纳米粒子及纳米等离子体团簇,因而可以通过调整光照波长及选择合适的金纳米团簇模型,防止辐射损耗,进一步优化SERS对蛋白质的检测[29]。
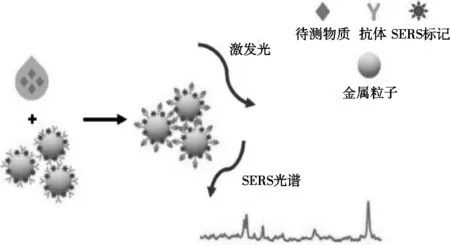
图2 SERS直接检测技术示意图
3 基于SERS的联用检测技术
基于SERS的蛋白质直接检测方法发展较为成熟,但仍需要昂贵的试剂和仪器,费时费力,需要训练有素的操作人员等。随着SERS发展,许多传统的检测蛋白质类的方法,如酶联免疫吸附法(ELISA)、免疫印迹法(MIP),在单独使用时往往操作复杂、稳定性和重复性不强、干扰因素多、成本高[30],不适用于基质复杂的样品等,当与SERS联用时,将会表现出更好的检测能力。同时,随着近年来对临场检测及快速检测的要求,SERS与试纸条及生物芯片的联用也成为基于SERS的检测蛋白质类物质的新型手段。
3.1 SERS与酶联免疫吸附反应(ELISA)联用
ELISA是一种定量分析方法,通过酶连接的偶联物和酶底物之间相互作用所产生的颜色变化来表现抗原-抗体反应[31]。传统的ELISA所用抗原及抗体的制备成本高,质量易受抗原抗体制备方法的影响[32],需要较为精密的操作,具有一定的局限性。
通常情况下,检测抗体和拉曼报告分子标记在纳米粒子表面形成免疫拉曼探针,当免疫拉曼探针与抗原结合时,可通过检测拉曼信号来确定抗原浓度[33]。由于蛋白质是一类大分子物质,在基于SERS的ELISA检测法中,“三明治”模式是最常见的一种(图3A)。Yang等[34]制备一种新型的等离子体多层核壳的-卫星纳米结构(Au@Ag@SiO2-AuNPs),Au@Ag作为SERS平台,较高的SiO2层在Au@Ag与AuNPs之间表现出远程等离子体耦合,进一步导致了拉曼散射增强。此外,还可以利用过氧化氢的还原性来改变金属纳米颗粒以实现超灵敏检测。Liang等[33]结合SERS和银纳米粒子聚集,ELISA的酶标物质通过控制过氧化氢对拉曼标记银纳米颗粒的溶解,实现抗原-抗体反应,同时,该过程在分析物存在时产生较强的拉曼信号。
3.2 SERS与免疫印迹技术
分子印迹聚合物(MIP)具有特定的识别能力,稳定性好、制备简单、成本低,与SERS联用时不需要特殊的标记,因而具备广泛的应用前景。如图3(B)所示,MIP材料可作为待测目标蛋白的预浓缩方法,在SERS标签即金属纳米粒子和拉曼信号分子的作用下,通过抗体与抗原特异性结合以获得SERS信号[35]。有研究表明,结合MIP可以捕获糖蛋白、包括SERS报告基因的金属NPs以及硼酸基结合到蛋白质的糖基化部分来实现蛋白质检测[36]。Tu等[37]采用金基硼酸盐亲和分子印迹技术从复杂样品中特异性提取目标糖蛋白,金阵列在激光照射下产生等离子体波,显著增强SERS信号,分析时间可以缩短至30 min。MIP方法操作较为复杂,定量分析不够精确,通过与SERS联用能够依靠特征性指纹图谱获得更为精确的蛋白质定性定量指标,有助于进一步分析鉴定。
3.3 SERS与试纸条联用
试纸条是一种快速简便的现场检测手段,但通常仅作为一种定性或半定量测量的工具,其灵敏度和稳定性仍有待提高。功能化的Fe3O4@Au磁性纳米颗粒(MNPs)可对双重感染生物标记物进行超灵敏分析,而经抗体修饰的Fe3O4@Au MNP能够作为SERS纳米标记感染生物标记物,组装在侧向流免疫层析试纸条时,可实现血液中目标感染生物标志物的定量检测(如图3C所示)[38]。Wang等[39]利用Fe3O4@Ag磁标签与双层拉曼分子和捕获目标病毒的抗体结合,可对试纸条上的目标病毒进行特异性识别和富集,对甲型H1N1流感病毒和人腺病毒(HAV)的检出限可分别达到50和10 PFU/mL。纸基试纸条结合SERS同样可以实现待测物的快速、灵敏定量分析。有研究表明,将具备多个“热点”的树莓型双金属Au@AgNP纳米结构组装在箭头形试纸条上,可以实现对复杂样品的高灵敏度检测,且树莓型的双金属纳米粒子SERS性能的灵敏度和稳定性均优于球形AgNP[40]。引入SERS技术可极大地提高试纸条的定量检测及分析的可靠性和灵敏度,有利于实现LFIA的痕量蛋白质检测。
3.4 SERS与生物芯片联用
生物传感器可对蛋白质类物质进行定量检测,灵敏度较高,选择性好,适用于现场分析。与生物芯片联用SERS基底通常是使用刻蚀工艺将模板图案转移到人IgG底物上,芯片暴露于等离子体后洗去纳米颗粒,将其浸入牛血清白蛋白溶液中,获得图案化的蛋白质芯片,用于蛋白质检测时,将上述芯片浸入标记抗原溶液中即可完成检测[41]。如图3(D)所示,一般而言,有序排列的硅纳米管(SiNPLs)和等离子体银纳米颗粒(AgNPs)可作为增强SERS信号的有效基底,适用于不同带电蛋白质甚至特殊的淀粉样蛋白[42]。然而,对于SERS与生物芯片联用的报道较少,大部分仍集中在医学领域。

图3 SERS与ELISA(A)、免疫印迹(B)、试纸条(C)、生物芯片(D)技术联用原理图
4 结语及展望
SERS技术观察到的拉曼信号比传统的拉曼散射高几个数量级,能有效降低使用荧光标记产生的光淬灭及干扰现象,并能够通过选择合适的SERS基底实现信号放大,提高对蛋白质类物质检测的灵敏度。随着SERS与越来越多的技术联用,基于SERS的蛋白质类物质检测的应用范围逐渐从医学领域拓宽到环境检测、食品等领域。
然而,仍有许多技术问题亟待解决。SERS技术应用的瓶颈问题是待检测的分析物附着的有效“热点”很少;拉曼基底随机分布在SERS基底上,导致SERS信号的重现性通常不佳;不均匀的SERS活性底物影响SERS定量分析的准确性;不能同时检测样品中的多种蛋白质;SERS基底通常是一次性的,不利于对待测物质的反复捕获和释放[43]。
针对上述问题,可将目标聚焦于构建高密度、均匀分布的“热点”,实现“热点”内拉曼分子的有效富集。随着检测技术的日益完善及更灵敏便捷的检测方法不断发展,基于SERS的检测技术可在医学、环境、食品等领域得到广泛应用。
