建兰花色调控关键基因的克隆与表达
2021-06-25李文建王观龙谢朝晖王莲哲
李文建,王 澎,王观龙,谢朝晖,朱 涛,王莲哲
(河南城建学院 生命科学与工程学院,河南 平顶山 467036)
花青素(anthocyan)又称花色素或花色苷,是一类水溶性的类黄酮类化合物。作为天然色素,其广泛存在于植物营养器官和繁殖器官中,使组织器官呈现出红、蓝、紫等颜色,同时也有利于提高植株繁殖后代和抵御不良环境等方面的能力[1]。植物类黄酮物质合成途径中的第一个关键酶,即查尔酮合酶(chalcone synthase,CHS),由催化香豆酰辅酶A和丙二酰辅酶A反应而生成查尔酮[2]。近年来,酵母、昆虫、植物和哺乳动物细胞等真核表达系统相继发展和完善,然而应用最多、最广泛的仍是大肠杆菌原核表达系统[3]。原核表达系统生产重组蛋白具有周期短、产量高、可重复性好、操作简便等优点[4]。
1 材料与方法
本文将建兰花色形成关键基因的编码区片段定向克隆至pET28a质粒,转化至大肠杆菌BL21(DE3)菌株,经IPTG诱导,SDS-PAGE检测表达产物蛋白特征,并优化该蛋白的最佳诱导表达条件。
1.1 实验材料
建兰花瓣材料均源于同一植株,以此保证所有花瓣组织基因组遗传背景的一致性,从而减轻建兰基因组序列源头差异给关键基因克隆与表达研究带来的误差。
1.2 培养基
(1)LB液体培养基:胰蛋白胨10 g/L,酵母抽提物5 g/L,NaCl 5 g/L,NaOH溶液调pH值为7.0;
(2)LB固体培养基:在(1)基础上加入15 g/L琼脂粉。
1.3 引物
用Primer Premier5.0软件设计引物,分析pET28a载体多克隆位点区域,分别加入酶切位点。
CeCHS1-S:5′-CGGAATTC(EcoRI)ATGGCGCCGGCGTTGGAAGC-3′
CeCHS1-A:5′-CGCTCGAG(XhoI)TCACTCCGCATTAGCAATCG-3′
根据建兰植株18S序列设计RT-PCR验证引物:
18s-113-s:5′-CAACCATAAACGATGCCGACC-3′
18s-113-a:3′-CCCTCATACCAGCGTTCCGAC-5′
1.4 建兰花瓣总RNA提取
取建兰同一植株完全开放花,无水乙醇擦拭洁净花瓣,解剖刀裁取花瓣两种颜色部位组织混合。TRNzol-A+总RNA提取试剂盒提取花瓣组织总RNA,步骤参照试剂盒说明书进行。
1.5 cDNA制备
使用天根公司Quant cDNA第一链合成试剂盒对建兰花瓣组织总RNA样品进行逆转录反应,步骤参照试剂盒说明书进行。并依据建兰18S rRNA序列引物18s-113-s/18s-113-a验证RT-PCR效果。
1.6 CeCHS1基因扩增
根据建兰转录组数据库搜索“Chalcone synthase”,经筛选比对分析,获得建兰花瓣CHS基因序列(完整开放阅读框),命名为CeCHS1。设计引物CeCHS1-S /CeCHS1-A,以花瓣cDNA为模板,PCR扩增开放阅读框(ORF)。
PCR体系:10×PCR Buffer(Mg2+Free)2.5 μL、dNTP Mixture(各2.5 mmol/L)2.0 μL、MgCl2(25 mmol/L)2.0 μL、引物(1.0 mmol/L)1.0 μL、模板cDNA 1 μL、Taq酶(5 U/μL)0.3 μL、dd H2O 15.2 μL,共25 μL。
PCR条件:94 ℃ 4 min;35个循环(94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min);72 ℃ 7 min。
1.7 原核表达载体制备
将E.coliBL21菌种(携带质粒pET-28a)接种于50 mL LB液体培养基中(含50 μg/mL Amp),37 ℃振荡培养过夜后,离心收集菌体。使用E.Z.N.A Gel extraction Kit试剂盒依照说明书操作提取质粒。
1.8 感受态细胞制备
将活化菌液转移至50 mL离心管中,冰浴10 min,8 000 r/min离心10 min,弃上清;用3 mL 0.1 mol/L CaCl2悬浮沉淀,8 000 r/min冷冻(4 ℃)离心10 min;再用10 mL 0.1 mol/L CaCl2悬浮沉淀,冰浴30 min,8 000 r/min离心10 min;回收大肠杆菌菌体,加200 μL冰冷0.1 mol/L CaCl2悬浮细胞,50~100 μL分装,-70 ℃保存备用。
1.9 表达片段与载体的酶切、连接及转化
用EcoRI和XhoI对表达片段和载体进行双酶切。通过1.1%琼脂糖凝胶电泳检测酶切效果。再将基因片段与载体摩尔比51配制成8 μL混合液,加入1 μL T4 Ligation Buffer和1μL T4连接酶混匀,于16 ℃连接过夜。将连接产物转化至感受态细胞,用LB/Kan平板筛选转化子。
1.10 转化子鉴定
挑取单个阳性克隆菌落接于LB液体培养基(50 μg/mL Kan)中,37 ℃培养过夜。可通过菌落PCR和提取质粒后的EcoRI和XhoI双酶切共同鉴定转化子。
1.11 CeCHS1诱导表达条件优化
(1)总蛋白SDS-PAGE电泳
分别取1 mL同浓度菌体的菌液,室温下8 000 r/min离心20 min,收集菌体。加入60 mL水和15 mL 5×SDS-PAGE电泳缓冲液,混匀,煮沸10 min,12 000 r/min离心10 min后进行12 % SDS-PAGE蛋白电泳(15 %分离胶,5 %浓缩胶)。在室温条件下,考马斯亮蓝R250染色,脱色液脱色直至蛋白条带清晰。用BandScan5.0扫描蛋白胶后做CeCHS1蛋白分子量和表达量分析。
(2)IPTG浓度
加IPTG至活化后的阳性转化子菌液中,分别获得终浓度0.1 mM、0.2 mM、0.5 mM、1.0 mM、1.5 mM、2.0 mM的菌液,于37 ℃ 200 r/min震荡培养4 h,8 000 r/min离心10 min,收集菌体。
(3)诱导温度
加IPTG至活化后的阳性转化子菌液中使其终浓度为1.0 mM,分别在18 ℃、23 ℃、28 ℃、32 ℃和37 ℃条件下200 r/min摇菌4 h,8 000 r/min离心10 min收集菌体。
(4)诱导时间
加IPTG至活化后的阳性转化子菌液中使其终浓度为1.0 mM,37 ℃条件下200 r/min分别摇菌1 h、2 h、3 h、4 h、5 h、6 h和12 h,8 000 r/min离心10 min收集菌体。
2 结果与分析
2.1 建兰花瓣组织总RNA提取
经建兰花瓣总RNA提取,取少量进行琼脂糖凝胶电泳,如图1所示。由图1可知:总RNA的28 S rRNA与18 S rRNA之间的亮度比约为21,无明显拖尾,说明RNA提取质量较好,降解少,分子完整。
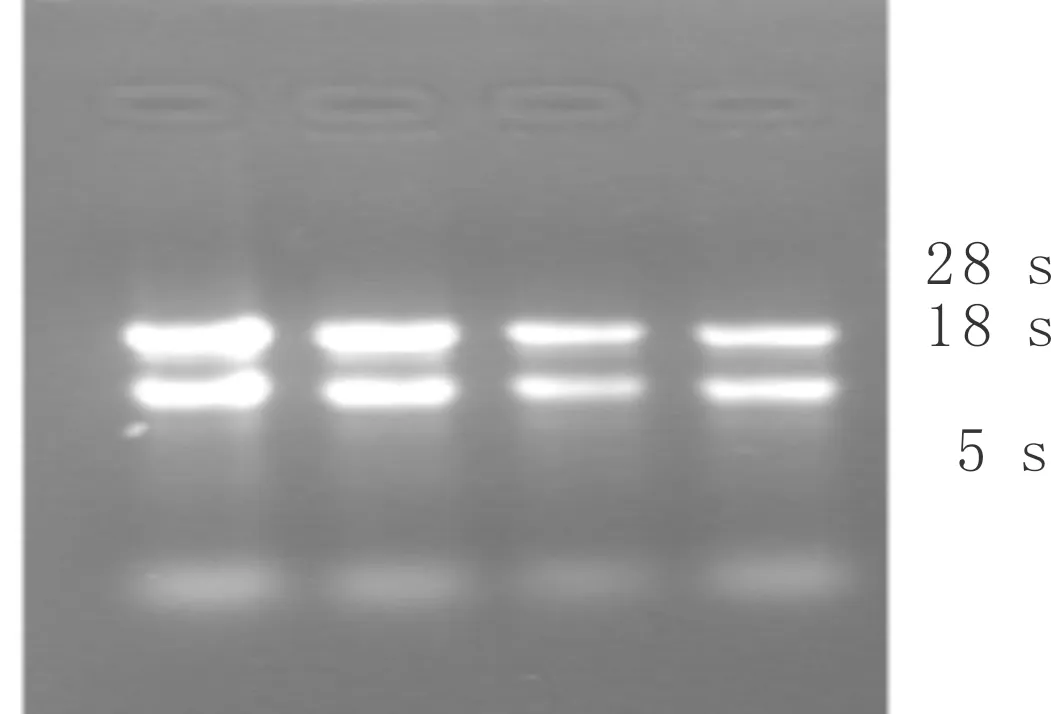
图1 建兰花瓣组织总RNA电泳
2.2 cDNA制备
对建兰花瓣RNA进行逆转录反应,并依据建兰18S rRNA序列引物验证RT-PCR效果,如图2所示。由图2可知:建兰花瓣18S rRNA得到了较好的扩增(113 bp),说明从建兰花瓣总RNA反转录的cDNA可用于下一步基因克隆研究。
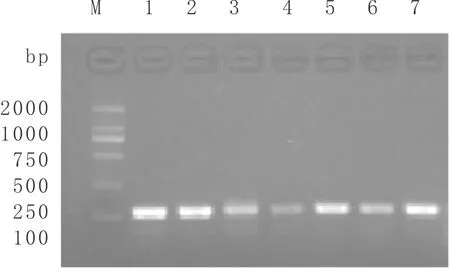
图2 建兰花瓣RT-PCR cDNA适用性验证M:DL 2000 Marker;1~7:18S 条带
2.3 CeCHS1基因片段ORF扩增
用具有酶切位点(EcoRI 和XhoI)的引物CeCHS1-S/CeCHS1-A,以验证的cDNA为模板进行CeCHS1开放阅读框(ORF)的PCR扩增。用1.1%琼脂糖凝胶电泳分析PCR产物,分子量约为1 200 bp(图3)。
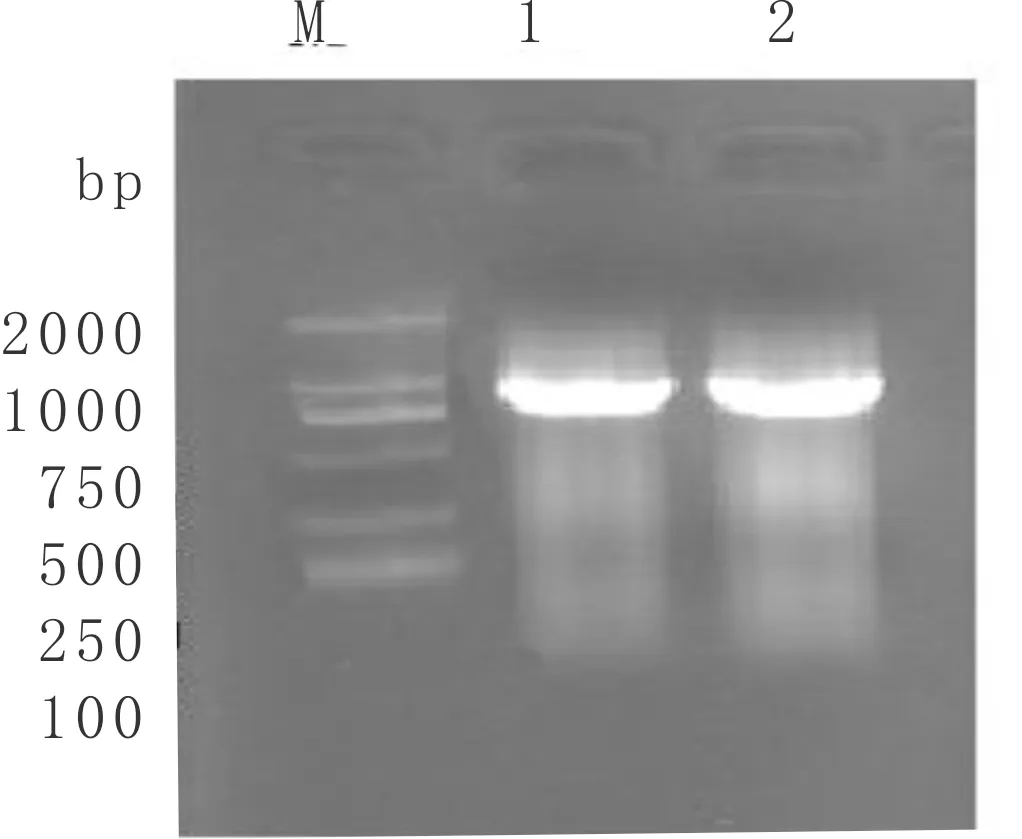
图3 PCR扩增CeCHS1产物凝胶电泳分析M:DL 2000 Marker;1~2:CeCHS1产物
2.4 转化子鉴定
目的片段与载体经酶切、连接及转化后,能否获得成功的重组子(pET28a-CeCHS1)、插入片段是否正确及其编码片段大小等方面,可通过菌落PCR和质粒提取的双酶切来共同验证与鉴定(图4)。图4显示,经琼脂糖凝胶电泳检测,两者均得到了约1 200 bp的清晰条带,该片段大小与预期结果一致。
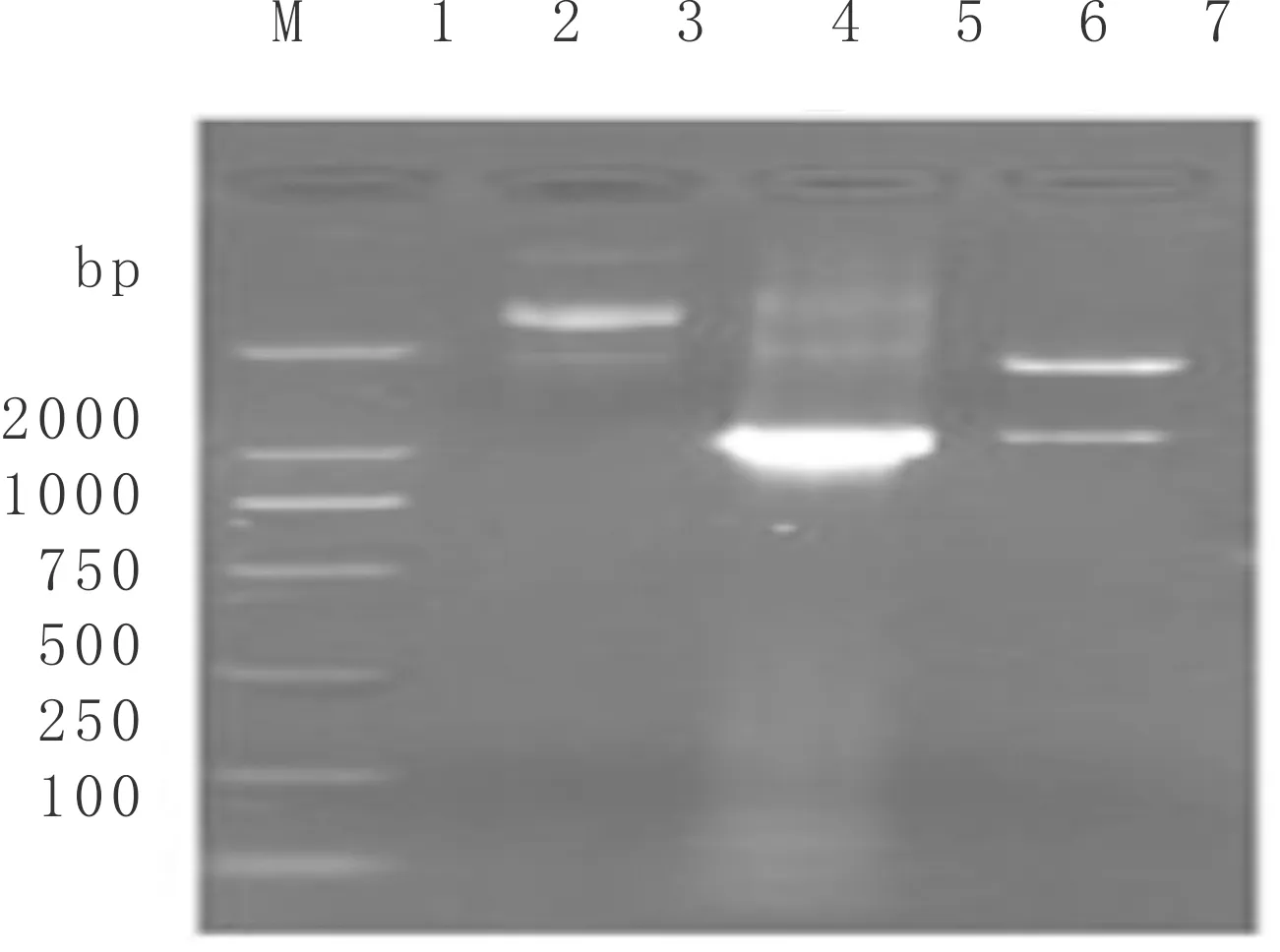
图4 pET28a-CeCHS1阳性转化子菌落PCR和质粒EcoR I/Xho I双酶切验证M:DL 2000 Marker;1:阳性克隆质粒;2:菌落PCR验证;3:质粒酶切验证
2.5 CeCHS1诱导表达条件优化
2.5.1 IPTG浓度
SDS-PAGE蛋白电泳图谱(图5)表明,从带3~带8均出现了特异蛋白条带,约43 KDa,与预计大小相符。在0.1~2.0 mM IPTG浓度范围内,随浓度增加,相应CeCHS1蛋白表达量依次增加,诱导浓度达到1.0 mM IPTG时,蛋白表达已达最大量,可见1.0 mM IPTG为蛋白诱导表达中的最适浓度,本研究结果与青稞[3]CHS蛋白诱导表达(1.0 mM IPTG)结果一致,与香雪兰[4]CHS蛋白诱导表达(0.4 mM IPTG)差别较大。

图5 不同IPTG浓度诱导蛋白表达的SDS-PAGE电泳带1:低分子量蛋白Marker;带2:未诱导对照;带3~8:分别是IPTG浓度为0.1 mM、0.2 mM、0.5 mM、1.0 mM、1.5 mM和2.0 mM诱导结果;黑色箭头所示为目的融合蛋白
2.5.2 诱导温度
在IPTG浓度为1.0 mM,并在不同温度条件(18~37 ℃)下培养重组菌诱导表达,见图6。图6显示,设置温度范围内随诱导温度的提高,诱导的菌体总蛋白表达量也在增加。与37 ℃相比,诱导温度42 ℃时蛋白表达量不再增加,因此37 ℃可作为CeCHS1蛋白诱导表达最适宜的诱导温度,这也是大肠杆菌及其重组菌培养最适宜的生长与生产温度。
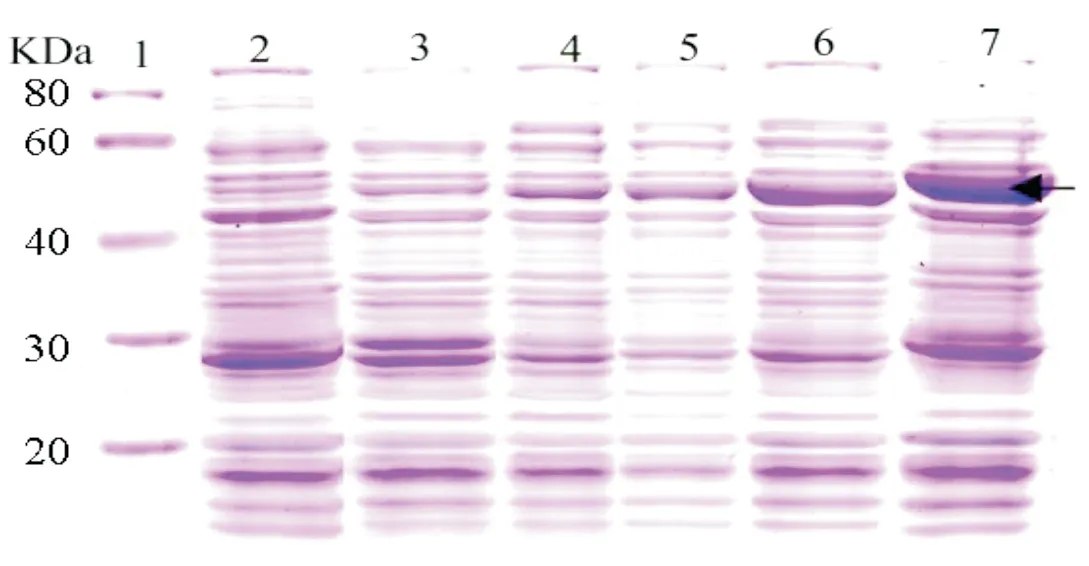
图6 不同温度诱导蛋白表达的SDS-PAGE电泳带1为低分子量蛋白Marker;带2为重组菌未诱导对照;带3~7依次为温度18 ℃、23 ℃、28 ℃、32 ℃和37 ℃的诱导结果;黑色箭头所示为目的融合蛋白
2.5.3 诱导时间
在诱导温度37 ℃及诱导浓度1.0 mM IPTG条件下,研究不同诱导时间(1 h、2 h、3 h、4 h、5 h、6 h、12 h)对重组菌总蛋白表达量的影响,结果见图7。图7显示,随时间延长,菌体总蛋白表达量随之增加,诱导6 h时蛋白表达量已达到最大量。故诱导时间6 h即是CeCHS1蛋白诱导表达的最佳培养时间,与青稞[3]CHS蛋白诱导(3 h)、香雪兰[4]CHS蛋白诱导(4.5 h)相比,其各自诱导时间稍长。
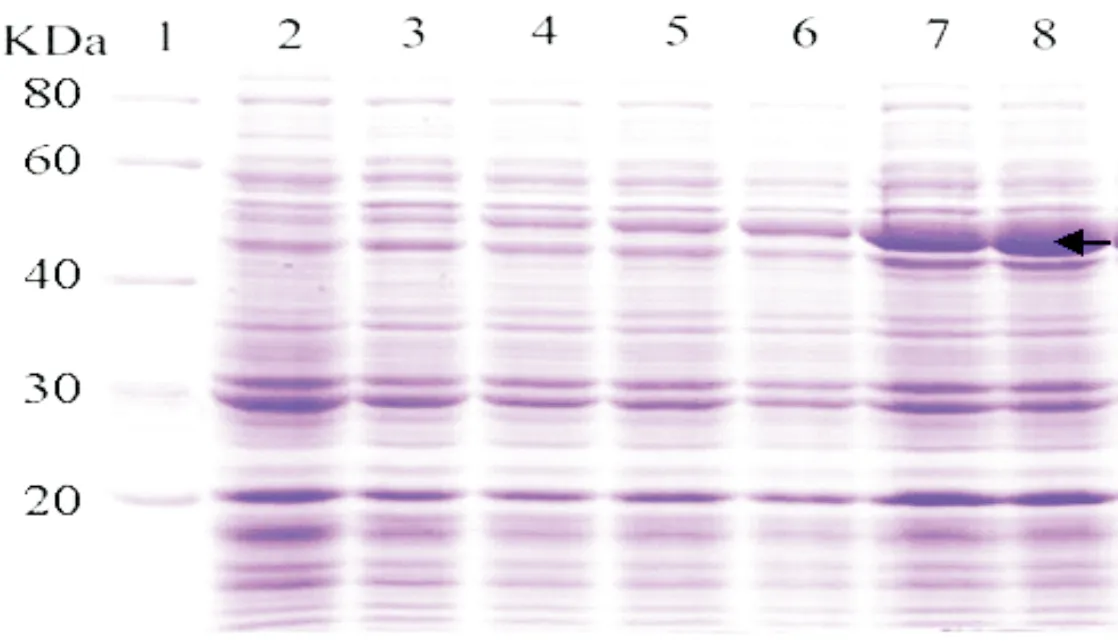
图7 不同时间诱导蛋白表达的SDS-PAGE电泳带1为低分子量蛋白Marker;带2~8依次是诱导时间1 h、2 h、3 h、4 h、5 h、6 h、12 h的诱导结果;黑色箭头所示为目的蛋白
根据以上诱导条件优化结果得出,在37 ℃条件下、IPTG诱导浓度为1 mM及诱导时间6 h是pET28-CeCHS1在大肠杆菌BL21(DE3)中表达的最佳条件。
3 讨论与结论
近年来,随着分子生物学和基因工程的快速发展和应用,观赏植物育种学者较为关注的课题逐渐集中在利用基因工程改良和培育新花色等研究方面,花色改良已成为花卉基因工程育种研究的重点和热点[5-8]。关于基因工程育种途径进行改良花色的研究报道日益增多,如矮牵牛[9-11]、苦荞[6,12]、瓜叶菊[13]、石斛兰[14]、卡特兰[15]、鸢尾[16]等花卉植物花色形成关键基因克隆与表达分析等方面,均获得了较好的结果和成效。
针对兰科类花卉,其花色相关研究主要包括:花色素类组成分析、功能基因克隆和分析及转基因技术改变花色等方面,开展兰花尤其是独具特色国兰类的花色育种相关研究具有重要的实用价值和应用前景[5,14,15,17]。
