木犀草素铜配合物的抗氧化活性与配位模式研究
2021-06-17臧昕王家文周坤鹏厉诗娴林玮李婧
臧昕 王家文 周坤鹏 厉诗娴 林玮 李婧
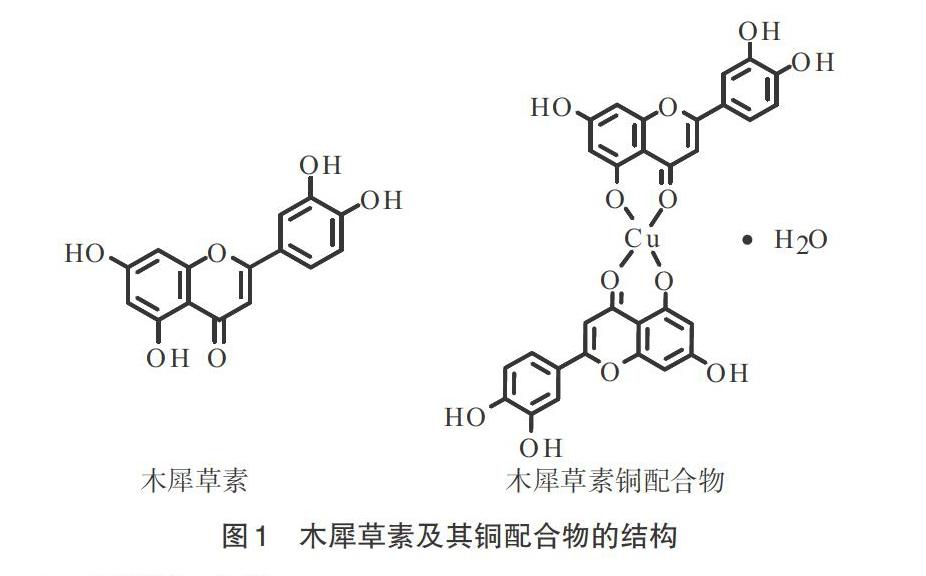
摘 要:黄酮类金属配合物具有多种生物和药理活性。通过木犀草素及其铜配合物与DPPH·、·OH、O2·-作用,探讨木犀草素及其铜配合物的抗氧化活性。结果显示,铜配合物较木犀草素对·OH的清除能力减弱较为明显,对DPPH·、O2·-的清除能力下降不明显。这进一步验证了木犀草素以4-C=O和5-OH与铜离子配位,配位模式与抗氧化活性密切相关。
关键词:木犀草素;铜配合物;抗氧化活性;配位模式
中图分类号 O657.3;R285.5文献标识码 A文章编号 1007-7731(2021)10-0018-03
Study of Antioxidant Activity and Coordination Mode of Luteolin Copper Complex
ZANG Xin et al.
(Heilongjiang Bayi Agricultural University, College of Life Science and Biotechnology, Daqing 163319,China)
Abstract: Flavonoid metal complexes have many biological and pharmacological activities. In this research, luteolin and its copper coordination complex were studied antioxidant activity by examining the free radical scavenging effects through reactions with DPPH·, ·OH and O2·-. The results showed that radical scavenging ability of luteolin copper complex on ·OH was weakened obviously compared with luteolin, while the activities on DPPH· and O2·- were slightly lower than that of luteolin. The experiments confirm that luteolin is coordinated with copper ion via 4-C=O and 5-OH, the coordination mode is highly related to the antioxidant activity.
Key words: Luteolin; Copper complex; Antioxidant activity; Coordination mode
木犀草素(luteolin)是具有C6-C3-C6结构的典型黄酮类化合物,多存在于木犀草、金银花、菊花、荆芥等草本植物中,不仅具备抑制肿瘤生长、减少激素分泌、抗菌、抗过敏、抗病毒的生物活性,也可显著抑制TNF-α(肿瘤坏死因子)和IL-6(白细胞介素),同时促进炎症细胞中Nrf2的表达,使氧化应激状态维持较低水平,从而发挥抗氧化作用[1-3]。由于木犀草素的3′、4′、5和7位上均含有羟基,因此将其作为配体与金属离子络合形成配合物,所得配合物在裂解DNA、杀灭癌细胞、清除自由基等生物活性方面均有一定的改善作用[4]。 木犀草素可以与Fe3+、Mn2+、Cr3+、Zn2+、Ca2+等多种金属元素进行配合[5-6],木犀草素中4-C=O和5-OH、3′-OH和4′-OH可以分别与金属离子配位形成配合物。关于配位化合物结构的分析,目前多从红外、紫外、元素分析等表征中推断木犀草素与金属离子的配位形式。为此,笔者应用木犀草素与新戊酸铜或苯甲酸铜制备木犀草素铜配合物,分析论证配合物的结构(图1)[7]。为研究木犀草素铜配合物的抗氧化能力及其与配位模式的关系,应用木犀草素及其铜配合物与DPPH·、
·OH、O2·-等3种自由基在不同浓度下相互作用,通过紫外可见光谱分析对自由基的清除效果,对比抗氧化能力,结合木犀草素羟基对自由基的活性能力,阐明抗氧化能力与配位模式的关系。
1 材料与方法
1.1 试验材料 木犀草素(上海贤鼎公司),1,1-二苯基-2-三硝基苯肼(DPPH·,上海阿拉丁试剂),30%H2O2(麦克林公司),其他试剂、药品均为分析纯。
1.2 试验方法 紫外吸收光谱由Thermo Fisher Scientific分光光度计测得;红外光谱在Nicolet 380型红外光谱仪上通过KBr压片法测得;元素分析在Vario Micro cube上测得。参照课题组前期文献[7],将4mmol的木犀草素完全溶解于5mL无水乙醇中,滴加2mmol新戊酸铜的乙醇(5mL)溶液,充分混合并于85℃恒温水浴中回流反应75min,过滤后自然晾干,得到黑色固体,即木犀草素铜配合物。
1.3 自由基清除率测定
1.3.1 DPPH· 称取0.0039g DPPH·固体,于1mL无水乙醇中充分溶解,从中取0.1mL加入到19.9mL无水乙醇中混匀,制得0.5μmol/mL DPPH·溶液,避光保存;称取0.0014g木犀草素粉末,加入20mL无水乙醇混合均匀,制成0.5μmol/mL淡黄色溶液;称取0.0064g铜配合物,以20mL DMSO为溶剂制成0.5μmol/mL橙黄色溶液。将上述溶液均按梯度稀釋为2.5×10-1、1.25×10-1、6.25×10-2、3.13×10-2、1.56×10-2、7.81×10-3、3.91×10-3、1.95×10-3和9.77×10-4μmol/mL共10个浓度。在EP管中加入1mL DPPH·溶液,再加入1mL样品溶液,震荡均匀后于室温条件下避光反应35min,随后取出,以无水乙醇为背景,在517nm处测其紫外吸光度A1;将样品溶液替换为样液所用溶剂,重复上述反应,记录紫外吸光度A0;将DPPH·替换为无水乙醇,仍加入1mL样品溶液,重复上述反应,并记录紫外吸光度A2,以除去计算时样品溶剂的影响。
DPPH·清除率(%)=[A0-(A1-A2)]/A0×100
1.3.2 ·OH 称取0.0139g的FeSO4·7H2O,加蒸馏水定容至50mL,制成1μmol/mL FeSO4溶液;取3.3mL30% H2O2溶液,加蒸馏水定容至50mL,制成2μmol/mL H2 O2溶液;取0.0116g的水杨酸固体粉末,加入14mL无水乙醇混匀,制成6μmol/mL水杨酸溶液;木犀草素、配合物按照上述配置并稀释。在EP管中加入1mL FeSO4溶液和1mL H2O2溶液,再加入2mL样品溶液,混合均匀,于37℃恒温水浴中反应20min,取出,再加入1mL水杨酸,震荡均匀,继续水浴反应20min,以蒸馏水为背景,在520nm处测其紫外吸光度A1;将样品溶液替换为溶剂,重复上述反应,记录紫外吸光度A0。
·OH清除率(%)=(A1-A0)/A0×100
1.3.3 超氧阴离子(O2·-) 称取0.6057g Tris-base固体,加蒸馏水定容至50mL,制成0.1mmol/mL Tris溶液;称取0.0063g邻苯三酚固体,用0.01mmol/mL HCl溶液溶解,并定容至100mL,制成0.5μmol/mL邻苯三酚溶液;木犀草素、配合物按照上述配置并稀释。在EP管中加入1mL邻苯三酚溶液,再加入0.4mL Tris溶液,混匀后静置1.5min,加入1mL 样品溶液,震荡均匀,反应5min后加入0.25mL HCl溶液终止反应,记录吸光度A1;将样品溶液替换为溶剂,重复上述反应,记录紫外吸光度A0。
O2·-清除率(%)=(A1-A0)/A0×100
2 结果与分析
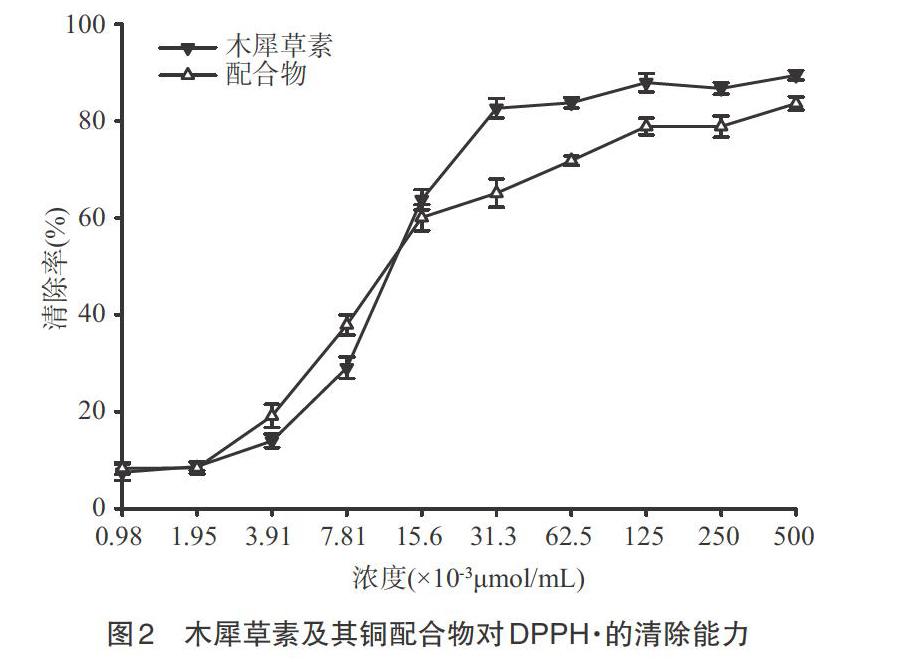
2.1 对DPPH·自由基的清除作用 在对DPPH·清除机理的研究中,黄酮化合物通过HAT机理进行反应。DPPH·的无水乙醇溶液呈深紫色,随着反应的进行,其含有孤电子的2-N夺取木犀草素羟基上的氢原子,破坏共轭结构,使得溶液逐渐转变为淡黄色,其中木犀草素的羟基对自由基的活性顺序为4′-OH>3′-OH>5-OH>7-OH,4′-OH的活性最强[8]。木犀草素及其配合物对DPPH·的清除能力如图2所示。由图2可知,随着样品浓度增大,清除率增大。在浓度为9.8×10-4μmol/mL和1.95×10-3μmol/mL时,其对DPPH·的清除率均在10%以下;随着浓度增长至5×10-1μmol/mL,清除率达到最高,分别为89.43%和83.61%;配合物的清除能力整体上较木犀草素有小幅降低。这表明铜离子发生配位后,3′-OH、4′-OH不能参与配位,这2个羟基与自由基反应能力较强,若它们参与了铜离子的络合,清除率将会出现较大程度的下降;同时也表明铜配位后不利于断裂O-H键与半醌式自由基形成稳定结构,从而导致清除能力的略微下降。由此可见,配合物结构中4-C=O和5-OH参与配位,3′-OH、4′-OH未参与配位。
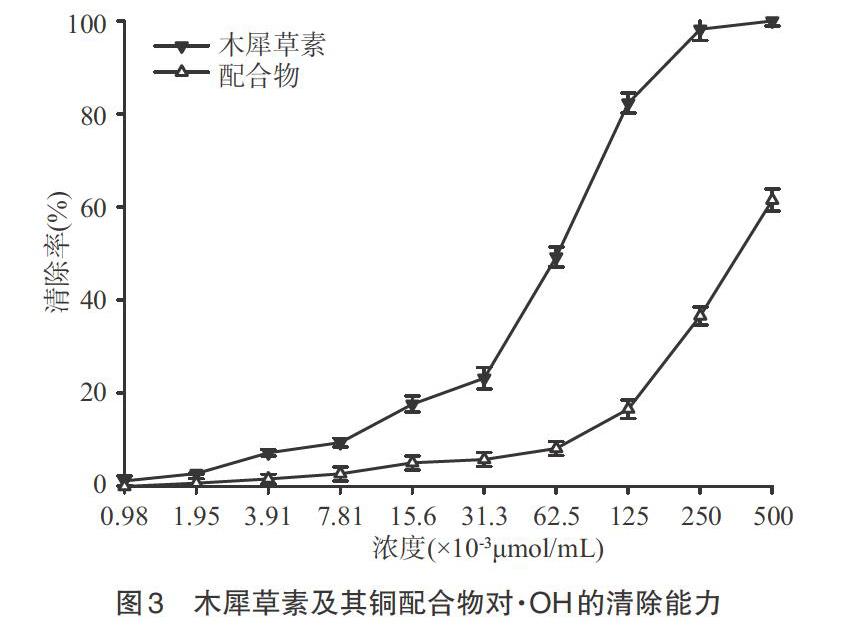
2.2 对·OH的清除作用 FeSO4溶液与H2O2混合后产生·OH,随着反应的进行,游离的·OH与配合物结合,溶液逐渐变为深棕色,接着在此溶液中加入水杨酸,与剩余的·OH相互作用,产生2,3-羟基苯甲酸,使得溶液呈浅紫色[9]。木犀草素及其铜配合物对·OH的清除作用如图3所示。由图3可知,样品溶液浓度为9.8×10-4μmol/mL时,没有清除能力;之后随着浓度的提升,木犀草素及其铜配合物对羟基自由基的清除率不断增大,但配合物的清除作用增长相对缓慢;木犀草素自2.5×10-1μmol/mL后可完全清除自由基,而配合物在5×10-1μmol/mL时清除效果仅有61.5%。由此可见,配合物对·OH的清除作用较木犀草素降低较多,这可能是由于配位后Cu2+的存在使配合物中羟基提供氢离子的能力下降,从而导致其清除羟基自由基的能力减弱。
2.3 对超氧阴离子(O2·-)的清除作用 邻苯三酚溶液中加入Tris溶液,即溶液由弱酸性变为弱碱性后,发生自氧化产生O2·-,且溶液逐渐变为黄棕色,在加入样品溶液后,随着反应的进行,配合物与超氧阴离子结合,同时溶液转变为棕色[10]。在对超氧阴离子的淬灭能力中,黄酮类各环上的羟基活性相差较大[11]:B环上含有的酚羟基活性最高;A环上含有酚羟基活性最弱;若C环上不饱和双键链有羟基,则C环也具有较强的抗氧化活性。木犀草素C环上不含有羟基,因此淬灭能力只由B环和A环上羟基决定完成。由图4可知,木犀草素及其铜配合物对超氧阴离子的淬灭能力相当。当浓度为9.8×10-4μmol/mL时,两者均没有清除效果;随着浓度的增大,两者对超氧阴离子自由基的清除率逐渐升高,当浓度为1.25×10-1μmol/mL时,木犀草素及其铜配合物清除率分别达到95.41%和97%,且两者均可在5×10-1μmol/mL的浓度下完全清除O2·-。由此可见,配合物的清除能力基本不受Cu2+的影响,这也证实配合物中Cu2+的配位位点为4-C=O和5-OH,而3′-OH和4′-OH未参与配位。
3 结论与讨论
试验结果显示,对DPPH·的清除中,木犀草素铜配合物能力轻微降低;对·OH的清除中,配合物的能力下降较大;对O2·-的清除中,两者能力相当。对比3种自由基化合物,超氧自由基氧化能力较强,反应较快,黄酮上羟基所具有的不同活性能决定物质的抗氧化能力;·OH氧化能力稍弱,反应较慢,但其位阻较小,木犀草素分子内羟基位置影响较小,但羟基的个数及分子的还原态对·OH的影响较大;DPPH·的氧化能力也稍弱,分子结构较大,位阻较·OH大,在夺取黄酮上自由基的过程中,活性较强的羟基位点对DPPH·的清除起着重要作用。结合抗氧化能力与分子结构分析,本研究进一步证明木犀草素4-C=O和5-OH与铜离子配位,也为黄酮类化合物金属配合物的抗氧化活性研究及对配位结构研究提供了参考。
参考文献
[1]Lin Yong,Shi Ranxin,Wang Xia,et al. Luteolin, a flavonoid with potential for cancer prevention and therapy[J]. Current Cancer Drug Targets,2008,8(7):634-646.
[2]孙霁寒,王兆丹,孙桂菊,等.木犀草素对高血脂症SD大鼠肝脏脂肪变性及抗氧化水平的影响[J].食品工业科技,2019,40(11):308-312,317.
[3]王伟,何平,江小明.木犀草素及其黄酮苷的抗炎、抗氧化作用[J].食品科学,2020,41(17):208-215.
[4]李海霞,郭芳.黄酮类化合物金属配合物研究进展[J].中国药房,2016,27(34):4872-4876.
[5]蔡胜.木犀草素和金属配合物的制备及其生物活性研究[D].广州:华南理工大学,2016.
[6]熊运浩.基于中药配位化学学说的四种木犀草素金属配合物的合成、结构表征及活性研究[D].南昌:江西科技师范大学,2018.
[7]臧昕,王家文,林悦,等.木犀草素铜配合物的制备及其对DNA的裂解作用研究[J].山東化工,2020,49(18):14-16.
[8]夏小明,张杰,刘绣华.木犀草素-锡(Ⅱ)配合物的合成、表征及抗氧化活性研究[J].天然产物研究与开发,2013,25(05):656-661.
[9]吴春,黄梅桂,车春波.槲皮素-锌(Ⅱ)配合物清除自由基的活性研究[J].食品工业科技,2010,31(01):128-129,247.
[10]袁倬斌,高若梅.邻苯三酚自氧化反应的动力学研究[J].高等学校化学学报,1997(09):1438.
[11]赵静,李玉琴,王芳乔,等.6种黄酮类化合物清除超氧阴离子自由基能力及其构效关系[J].中国医药导报,2014,11(29):7-10,14.
(责编:徐世红)
