氢渗透对L360QS钢表面涂层剥离的影响
2021-06-17冯旻祎扈俊颖钟显康
冯旻祎,扈俊颖,钟显康
(1. 西南石油大学,成都 610500; 2. 中石化重庆页岩气有限公司,重庆 408400)
随着我国对天然气需求的急剧增长,越来越多的酸性气田、高酸性气田被不断开发,例如:川东北气田群的H2S含量为8.8%~17.1%(质量分数,下同)[1],普光气田的H2S含量为13%~18%[2]。酸性气体环境容易导致氢原子从管道内壁向管体内部渗透。另外,当管道的阴极保护电位低于析氢电位时,会发生析氢反应,造成氢原子向管壁渗透[3]。氢渗透可能导致管道氢鼓泡、氢致开裂[4]或导致管道的力学性能下降[5]。同时,氢可能穿透管壁,到达管道外壁,并在外壁面进行重组,产生氢气分子[6],当管道外壁有涂层存在时,极可能导致涂层剥离。
研究认为,水的渗透[7-8]、氧气的扩散[9-10]、侵蚀性离子的传输[11]、杂散电流[12]是造成涂层剥离的主要因素。目前,专门针对氢渗透导致的涂层剥离行为的研究并不多见,而研究氢渗透对酸性气体管道外表面的涂层剥离行为影响对管道的运行安全十分重要。因此,本工作采用电化学技术和微观分析手段,研究了不同充氢电流密度下L360QS钢表面环氧涂层的剥离行为。
1 试验
1.1 试样制备
试验材料为L360QS钢,其化学成分(质量分数)为:94.84% Fe,3.58% C,1.32% Mn,0.26% Si。试样尺寸为35 mm×35 mm×0.5 mm。试验前,用3 000号砂纸打磨试样表面,再依次用去离子水冲洗、丙酮除油、乙醇冲洗,然后用氮气将试样吹干。将环氧树脂清漆刷涂在试样表面,室温固化24 h后,在60 ℃的烘箱中继续固化48 h,得到厚度为100~120 μm的涂层。
1.2 试验方法
采用Devnathan-Stachursk[13-14]双电解池法研究氢渗透对L360QS钢表面涂层剥离的影响,即以涂覆涂层侧为检测面,另一侧(无涂层)为充氢面。向检测面的容器中注入NS4[15-16]溶液,其化学成分为0.483 g/L NaHCO3,0.181 g/L CaCl2·2H2O,0.122 g/L KCl,0.131 g/L MgSO4·7H2O。试样作为工作电极,饱和甘汞电极作为参比电极,铂电极作为辅助电极。用科思特CS350电化学工作站监测检测面的开路电位,待开路电位稳定后,再向阴极池中注入充氢液体(0.1 mol/L H2SO4+1 g/L CH4N2S),阴极充氢电流密度为0、5、10、20 mA/cm2。每隔一定时间测一次电化学阻抗谱,电化学阻抗谱测试在开路电位下进行,扰动电位幅值为30 mV,频率为10 mHz~10 kHz。最后,进行极化曲线的测量。采用ZEISS EV0 MA15型扫描电子显微镜(SEM)观察涂层剥离前后试样的表面形貌和截面形貌。
2 结果与讨论
2.1 电化学阻抗谱
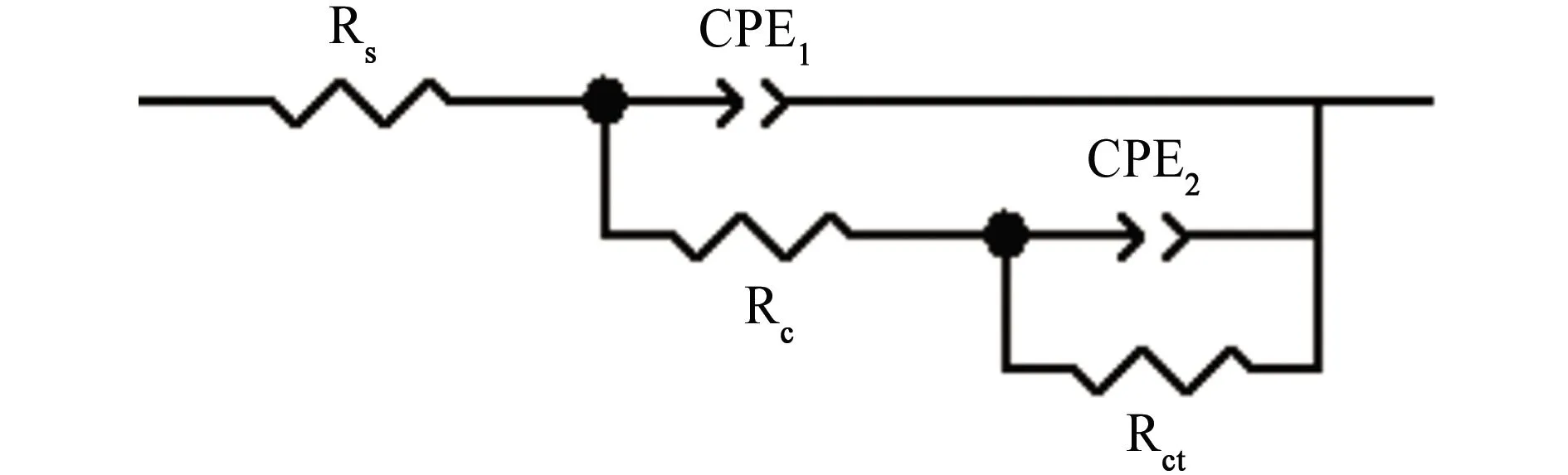
图1~4为不同充氢条件下带涂层L360QS钢的电化学阻抗谱。采用图5所示的等效电路对电化学阻抗谱进行拟合,拟合结果见表1~4。
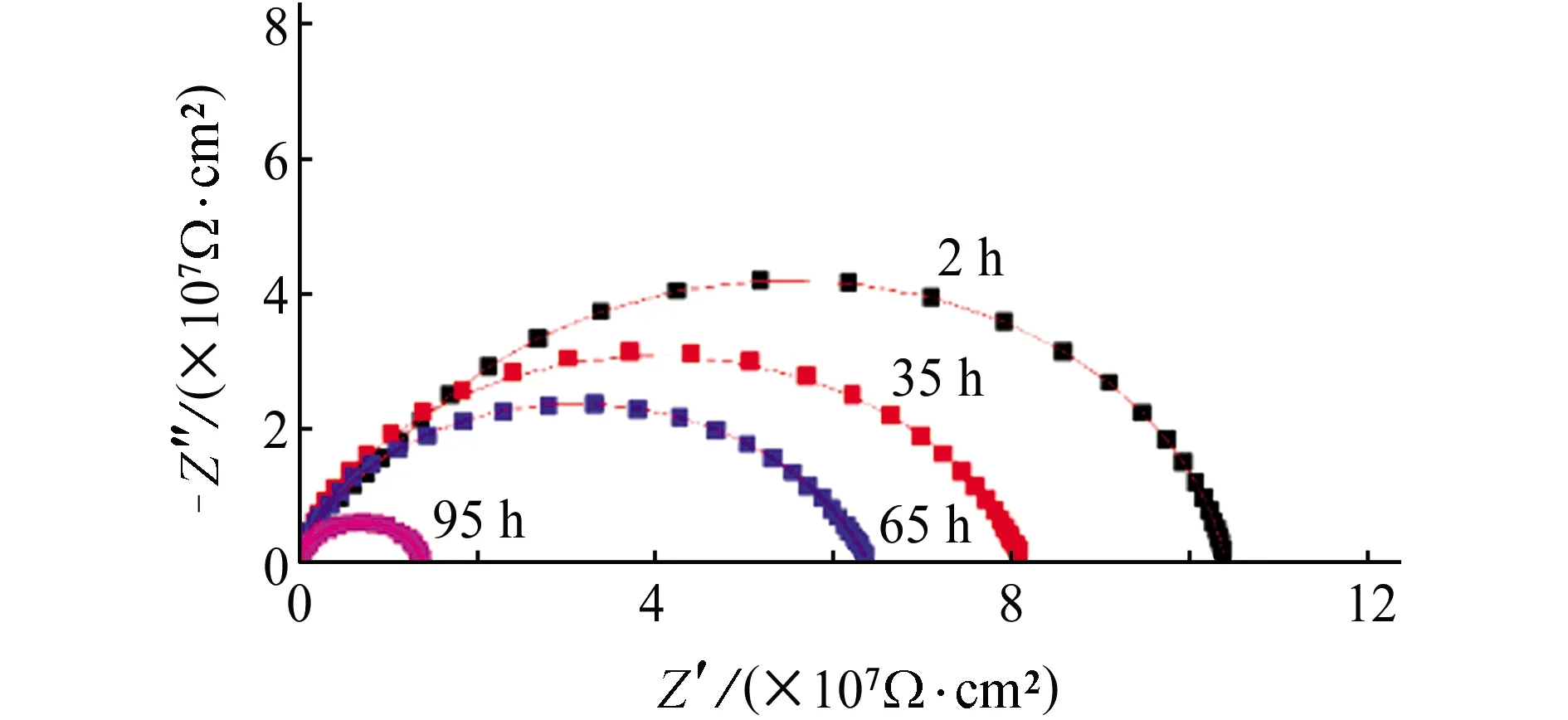
图1 无氢渗透条件下带涂层L360QS钢在NS4溶液中 的电化学阻抗谱Fig. 1 EIS of coated L360QS steel in NS4 solution without hydrogen permeation
由图1可见,无氢渗透条件下,Nyquist图中容抗弧直径随着浸泡时间的延长不断减小。由表1可见,涂层电阻Rc和电荷转移电阻Rct也随着浸泡时间的延长而不断减小。经过95 h浸泡后,涂层电阻为1.39×107Ω·cm2,是浸泡2 h后涂层电阻的8.08%,电荷转移电阻为3.70×107Ω·cm2,是浸泡2 h后电荷转移电阻的44%。这表明水分子或者其他侵蚀性离子逐渐渗透过涂层,导致涂层的防护性能下降。尽管如此,浸泡95 h后,涂层仍然具有较高的涂层电阻和电荷转移电阻,即涂层仍然具有较好的保护性能[17]。

表1 无氢渗透条件下带涂层L360QS钢在NS4溶液中电化学阻抗谱的拟合结果Tab. 1 Fitted results of EIS of coated L360QS steel in NS4 solution without hydrogen charging
由图2可见,当充氢电流密度为5 mA/cm2时,Nyquist图中容抗弧直径随着充氢时间的延长不断减小;充氢65 h后,低频区出现了线性上升的War-burg阻抗。充氢后期,由于越来越多的氢原子聚集骤,因此引入图5(b)所示等效电路进行充氢后期电化学阻抗谱的拟合。由表2可见,涂层电阻和电荷转移电阻也随着充氢时间的延长而不断减小。经过95 h充氢后,涂层电阻为6.08×106Ω·cm2,是充氢2 h后涂层电阻的6.32%,电荷转移电阻为5.08×106Ω·cm2,是充氢2 h后电荷转移电阻的5.20%。这表明氢原子逐渐渗透过涂层,导致涂层的防护性能下降,充氢95 h后,涂层电阻较低,即涂层已经失效。

图2 充氢电流密度5 mA/cm2条件下带涂层 L360QS钢在NS4溶液中的电化学阻抗谱Fig. 2 EIS of coated L360QS steel in NS4 solution at hydrogen charging current density of 5 mA/cm2

表2 充氢电流密度5 mA/cm2条件下带涂层L360QS钢在NS4溶液中的电化学阻抗谱的拟合结果Tab. 2 Fitted results of EIS of coated L360QS steel in NS4 solution at hydrogen charging current density of 5 mA/cm2
到金属/涂层界面,而涂层作为阻挡层,对氢原子向溶液方向的扩散具有阻碍和抑制作用,在此阶段中,氢原子的扩散过程可能成为了法拉第过程的控制步由图3可见,当充氢电流密度为10 mA/cm2时,Nyquist图中容抗弧直径同样随着充氢时间的延长不断减小;随着充氢时间延长,低频区同样出现了线性上升的Warburg阻抗。由表3可见,涂层电阻和电荷转移电阻也随着充氢时间的延长而不断减小;经过30 h充氢后,涂层电阻为5.29×106Ω·cm2,是充氢2 h后涂层电阻的13.22%,电荷转移电阻为7.44×106Ω·cm2,是充氢2 h后电荷转移电阻的17.14%。这表明涂层的防护性能随着氢原子渗透进入而下降,充氢30 h后,涂层电阻较低,此时涂层已失效。
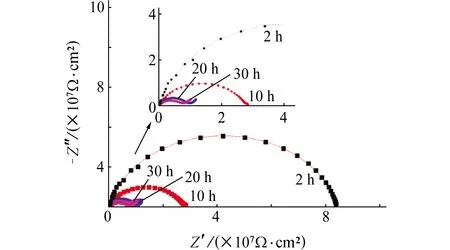
图3 充氢电流密度10 mA/cm2条件下带涂层 L360QS钢在NS4溶液中的电化学阻抗谱Fig. 3 EIS of coated L360QS steel in NS4 solution at hydrogen charging current density of 10 mA/cm2

表3 充氢电流密度10 mA/cm2条件下带涂层L360QS钢在NS4溶液中电化学阻抗谱的拟合结果Tab. 3 Fitted results of EIS of coated L360QS steel in NS4 solution at hydrogen charging current density of 10 mA/cm2
由图4可见,当充氢电流密度为20 mA/cm2时,Nyquist图中容抗弧直径随着充氢时间的延长不断减小,充氢10 h后,低频区同样出现了线性上升的Warburg阻抗。由表4可见,涂层电阻和电荷转移电阻也随着充氢时间的延长而不断减小;经过20 h充氢后,涂层电阻为1.77×106Ω·cm2,是充氢2 h后涂层电阻的3.32%,电荷转移电阻为6.92×105Ω·cm2,是充氢2 h后电荷转移电阻的0.84%。这表明氢原子逐渐渗透过涂层,导致涂层的防护性能下降,充氢20 h后,涂层电阻较低,此时涂层已失效。

图4 充氢电流密度20 mA/cm2条件下带涂层 L360QS钢在NS4溶液中的电化学阻抗谱Fig. 4 EIS of coated L360QS steel in NS4 solution at hydrogen charging current density of 20 mA/cm2

(b) 充氢后期图5 带涂层L360QS钢在NS4溶液中的等效电路图Fig. 5 Equivalent circuit diagrams of coated L360QS steel in NS4 solution: (a) the intial period of hydrogen charging; (b) the later period of hydrogen charging

表4 充氢电流密度20 mA/cm2条件下带涂层L360QS钢在NS4溶液中电化学阻抗谱的拟合结果Tab. 4 Fitted results of EIS of coated L360QS steel in NS4 solution at hydrogen charging current density of 20 mA/cm2
2.2 极化曲线
图6为不同电流密度下充氢后带涂层L360QS钢在NS4溶液中的极化曲线,对极化曲线进行拟合,结果如表5所示。结果表明,未充氢时带涂层L360QS钢试样的自腐蚀电位为-0.099 8 V;随着充氢电流密度的增大,阳极和阴极分支电流均增大,自腐蚀电位也随之负移,这与电化学阻抗谱结果一致。由此可见,随着充氢电流密度的增大,氢原子渗透速率随之增大,涂层剥离程度加剧。

图6 不同电流密度下充氢后带涂层L360QS钢 在NS4溶液中的极化曲线Fig. 6 Polarization curves of coated L360QS steel in NS4 solution after hydrogen charging at different current densities

表5 不同电流密度下充氢后带涂层L360QS钢 在NS4溶液中极化曲线的拟合结果Tab. 5 Fitted results of polarization curves of coated L360QS steel in NS4 solution after hydrogen charging at different current densities
2.3 微观形貌
图7为不同条件下充氢后带涂层L360QS钢表面的微观形貌。在无氢渗透条件下浸泡95 h后,涂层表面有盐离子附着,没有鼓泡产生,如图7(a)所示,这表明带涂层L360QS钢在NS4溶液中浸泡95 h不会引起鼓泡产生。在5 mA/cm2充氢95 h后,涂层表面有小鼓泡产生,还有些鼓泡处于萌发阶段,如图7(b)所示。在10 mA/cm2充氢20 h后,涂层表面充氢区域就有鼓泡产生,如图7(c)所示。图7(d)为20 mA/cm2充氢20 h后,涂层表面充氢区域出现的一个直径6.76 mm的鼓泡。以上结果表明,采用电化学充氢时,充氢侧和涂层侧存在氢原子的浓度梯度,氢原子会从无涂层的充氢侧渗透过试样聚集到涂层/金属界面。当积聚的氢原子产生的压力大于涂层的附着力时,涂层局部起泡[19],发生剥离。

(a) 0 mA/cm2,95 h (b) 5 mA/cm2,95 h (c) 10 mA/cm2,20 h (d) 20 mA/cm2,20 h图7 不同条件下充氢后带涂层L360QS钢表面的微观形貌Fig. 7 Micro morphology of coated L360QS steel surface after hydrogen charging under different conditions
(a) 充氢初期

(a) 0 mA/cm2,95 h (b) 5 mA/cm2,95 h (c) 10 mA/cm2,20 h (d) 20 mA/cm2,20 h图8 不同条件下充氢后带涂层L360QS钢截面的微观形貌Fig. 8 Micro morphology of coated L360QS steel cross-section after hydrogen charging under different conditions
图8为不同条件下充氢后带涂层L360QS钢截面的微观形貌。未充氢时,涂层完整地附着在基体上;随着充氢电流密度的增大,鼓泡半径随之增大,剥离程度加剧。
3 结论
(1) 无氢渗透条件下,环氧树脂涂层的防护性能随着浸泡时间延长而下降,但涂层表面不会发生剥离。
(2) 电化学充氢时,由于氢原子的浓度梯度,氢原子会渗透过试样,聚集到涂层/金属界面。当积聚的氢原子产生的压力大于涂层的附着力时,涂层局部起泡。
(3) 随着充氢电流密度的增大,涂层鼓泡半径随之增大,剥离程度加剧。充氢后期,涂层失效,氢渗透显著加速了涂层的失效过程。
