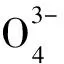地下水水化学组成对Fe(Ⅱ)氧化过程中锰氧化菌失活的影响
2021-06-09孙群群屈婧祎袁松虎
孙群群,屈婧祎,童 曼,袁松虎
(中国地质大学(武汉)生物地质与环境地质国家重点实验室,湖北 武汉 430078)
锰(Mn)是地壳中含量第二高的过渡金属元素,在还原性地下水中通常以Mn(Ⅱ)存在。当环境受到O扰动时,Mn(Ⅱ)会被氧化为高价锰氧化物。高价锰氧化物因其强氧化能力和强吸附能力,显著影响着生源元素的循环、污染物的迁移转化和微生物的厌氧代谢,在多种生物地球化学过程中具有非常重要的作用。在中性条件下,Mn(Ⅱ)的生物氧化速率比化学氧化速率快1×10倍,而锰氧化菌是驱动Mn(Ⅱ)氧化的主导因子。因此,环境中锰氧化菌的活性对锰的生物地球化学行为及其主导的其他生物地球化学过程具有重要的作用。

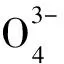
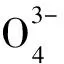
1 材料与方法
1.1 微生物菌株及其培养
锰氧化模式菌株Pseudomonas
putida
MnB1购于美国模式培养物集存库(American Type Culture Collection,ATCC),该菌株编号为23483,采用胰酪大豆胨肉汤培养基(TSB)于25℃、220 r/min条件下活化后用于后续实验。先将活化12 h(达对数生长期后期)后的MnB1菌液以8 000 r/min的转速离心5 min并收集菌体,再用5 mmol/L硫酸钠溶液洗涤3次,最后将菌体重新悬浊,得到初始菌浓度约为1×10CFU/mL的菌液,按照1%的比例加入实验体系。1.2 实验试剂
七水合硫酸亚铁(FeSO·7HO,99.9%)、硫酸钠(NaSO,99%)、硼酸(HBO,99.5%)、四硼酸钠(NaBO·10HO,99.5%)、二水合柠檬酸钠(NaCHO·2HO,99.5%)、草酸(HCO,99.8%)、磷酸三钠(NaPO·12HO,98%)、氯化镁(MgCl·6HO,99%)、氯化钙(CaCl·2HO,99%)均购于中国国药控股股份有限公司,胰酪大豆胨肉汤培养基(TSB)购于美国BD公司,腐殖酸(HA,C含量为34.2%,N含量为0.75%,S含量为0.30%)购于Sigma Aldrich公司,2-(N-Morpholino) ethanesulfonic acid(MES,99%)购于美国Biosharp公司。其他试验试剂均为分析纯或更高纯度级别的试剂。
1.3 实验方法
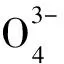
1.4 分析方法
(1) 利用平板涂布法计量MnB1菌株活菌数量。在不同反应时间点各取100 μL样品,逐级连续稀释至适当浓度后,取100 μL稀释后的样品涂布在固体TSB培养基上,每个样品按2~3个浓度梯度进行涂布;涂布后,将培养皿放置于30℃恒温培养箱中培养,待培养基表面长出明显菌落后,对菌落数目进行计数。
(2) 利用邻菲咯啉显色法测定溶解态Fe(Ⅱ)浓度。在不同反应时间点各取1.5 mL样品,用0.22 μm滤膜过滤至5 μL浓度为6 mol/L HCl中,混匀后取400 μL混合液至160 μL的0.5%邻菲罗啉溶液中,显色10 min,加入1 mL乙酸-乙酸铵缓冲液,用去离子水定容至4 mL,摇匀后在510 nm波长下测量吸光度,根据Fe(Ⅱ)的标准曲线换算出溶解态Fe(Ⅱ)浓度。
2 结果与讨论
2.1 pH值对MnB1菌株失活的影响
不同pH值条件下,Fe(Ⅱ)氧化过程中MnB1菌株活菌数量和Fe(Ⅱ)浓度的变化曲线,见图1。

图1 pH值对MnB1菌株活性和溶解态Fe(Ⅱ)氧化的影响Fig.1 Change curves of MnB1 activity and Fe(Ⅱ) concentration upon Fe(Ⅱ) oxygenation under different pH values注:N0和Nt分别为初始和t时刻MnB1菌株的浓度(CFU/mL),其中N0=1×107CFU/mL;C0和Ct分别为初始和t时刻溶解态Fe(Ⅱ)的浓度(mmol/L),其中C0=0.2 mmol/L。
由图1可见,在不同pH值条件下,Fe(Ⅱ)氧化过程中MnB1菌株活菌数量均大量减少。MnB1菌株的失活主要是由以下两个机制引起的:①Fe(Ⅱ)活化O过程中生成的ROS通过损伤DNA、蛋白质和脂质造成细菌失活;②Fe(Ⅱ)氧化生成的铁(氢)氧化物沉淀包被在细胞表面,通过破坏细胞膜的通透性引起细菌失活。此外,由图1(a)可见,不同pH值条件下MnB1菌株的失活速率存在显著差异:当pH值为7.0时,Fe(Ⅱ)氧化5 min即使MnB1菌株活菌数量降低了4.3个数量级(lg);而当pH值为6.6时,反应60 min时MnB1菌株活菌数量下降了4个数量级(lg)。由图1(b)可见,pH值为7.0的实验体系中Fe(Ⅱ)的氧化速率远高于pH值为6.6的实验体系,说明MnB1菌株的失活速率与Fe(Ⅱ)的氧化速率密切相关。另外,pH值为7.0的实验体系中反应60 min时Fe(Ⅱ)几乎全部被氧化,而pH值为6.6的实验体系中反应至60 min时仅有17%的Fe(Ⅱ)被氧化,此时pH值为7.0的实验体系中铁(氢)氧化物的含量远高于pH值为6.6的实验体系。然而,最终两个实验体系中MnB1菌株的失活数量相差并不大,即单位Fe(Ⅱ)氧化量下pH值为6.6的实验体系中MnB1菌株的失活率更高,这是由于pH值的降低能够显著促进Fe(Ⅱ)氧化过程中羟基自由基(·OH)的产生,见图2。

图2 pH值对实验体系中·OH产生量的影响Fig.2 Effect of pH on ·OH production
由图2可见,当pH值由7.0降为6.6时,反应60 min后实验体系中·OH的累积浓度由1.6 μmol/L增加至3.7 μmol/L,因此使得pH值为6.6的实验体系中因·OH的产生造成失活的MnB1菌株数量更多。
2.2 天然有机质对MnB1菌株失活的影响
在pH值为7.0的条件下,本实验考察了柠檬酸钠、草酸和腐殖酸3种天然有机质对MnB1菌株活性和溶解态Fe(Ⅱ)氧化的影响,其实验结果见图3。
由图3可见,3种有机质均抑制了Fe(Ⅱ)氧化过程中MnB1菌株的失活,且草酸和腐殖酸对Fe(Ⅱ)氧化过程中MnB1菌株失活的抑制率远高于柠檬酸钠;反应60 min时,5~20 mg/L柠檬酸钠对MnB1菌株失活的抑制率为16.6%~30.3%[见图3(a)],5~20 mg/L草酸对MnB1菌株失活的抑制率为 64.3%~68.7%[见图3(b)],10~30 mg/L腐殖酸对MnB1菌株失活的抑制率为63.6%~73.4%[见图3(c)]。

图3 3种天然有机质对MnB1菌株活性和溶解态Fe(Ⅱ)氧化的影响Fig.3 Change curves of MnB1 activity and Fe(Ⅱ) concentration upon Fe(Ⅱ) oxygenation under three different natural organic matters conditons
天然有机质对Fe(Ⅱ)氧化过程中细菌的失活有两种相反的作用:一方面,天然有机质可通过与Fe(Ⅱ)发生配位络合作用,从而促进了Fe(Ⅱ)的氧化和ROS的产生,如加入10 mg/L柠檬酸钠、10 mg/L草酸和10 mg/L腐殖酸反应60 min后实验体系中·OH的累积浓度由1.6 μmol/L分别增加至1.7 μmol/L、2.3 μmol/L和3.5 μmol/L,该机制会促进细菌的失活[见图4(a)];另一方面,天然有机质可能与Fe(Ⅲ)发生配位络合作用,从而抑制铁(氢)氧化物沉淀的生成,该机制会抑制Fe(Ⅱ)氧化过程中细菌的失活,即加入3种天然有机质后促进了反应体系中水相Fe(Ⅲ)的产生,从而抑制了铁(氢)氧化物沉淀的生成,且腐殖酸和草酸对铁(氢)氧化物沉淀的抑制作用明显高于柠檬酸。该研究结果表明,天然有机质对铁(氢)氧化物沉淀的抑制作用在本实验体系中占主导地位,由此导致了天然有机质实验体系中MnB1菌株失活率的降低。
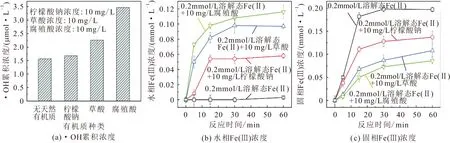
图4 不同天然有机质种类对·OH累积浓度、水相Fe(Ⅲ)浓度和固相Fe(Ⅲ)浓度的影响Fig.4 Effect of natural organic matters on the production of ·OH,aqueous Fe(Ⅲ) and solid Fe(Ⅲ)
2.3 阴阳离子对MnB1菌株失活的影响
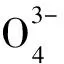
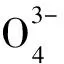

图5 不同P、Mg2+和Ca2+浓度对MnB1菌株活性和溶解态Fe(Ⅱ)氧化的影响Fig.5 Change curves of MnB1 activity and dissolved Fe(Ⅱ) concentration upon Fe(Ⅱ) oxygenation under different concentrations of P,Mg2+ and Ca2+
由图5(b)、(c)可见,Mg、Ca的加入明显抑制了Fe(Ⅱ)氧化过程中MnB1菌株的失活,反应60 min时,1 mmol/L、3 mmol/L和6 mmol/L的Mg对MnB1菌株失活的抑制率分别为52.7%、54.2%和70.2%,1 mmol/L、2 mmol/L和4 mmol/L的Ca对MnB1菌株失活的抑制率分别为49.0%、53.8%和66.5%。Mg、Ca对Fe(Ⅱ)氧化过程中·OH的产生量无明显影响。
Mg、Ca的加入使实验体系中的pH值由7.0最终降为6.6(见图6)。由图1(a)可知,当pH值由7.0降为6.6,反应60 min时,MnB1菌株的失活量仅缓解了约0.3个数量级(lg),而加入Mg和Ca后实验体系中MnB1菌株的失活量被缓解了约2.5个数量级(lg),远高于0.3个数量级(lg),这表明实验体系pH值的降低只是Mg和Ca抑制MnB1菌株失活的次要因素。Cl与·OH的反应常数达4.3×10[mol/(L·s)],且有研究表明Cl因消耗反应体系中的·OH进而抑制了活性氧物质对污染物的降解,因此Cl可通过竞争·OH进而抑制MnB1菌株的失活,该过程是抑制MnB1菌株失活的主要因素。

图6 Mg2+、Ca2+体系中pH值的变化Fig.6 pH variations in the presence of Mg2+ and Ca2+
2.4 环境意义
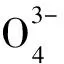
3 结 论
(1) pH值为7.0的实验体系通过促进Fe(Ⅱ)的氧化速率提高了MnB1菌株的失活总量,但pH值为6.6的实验体系中由于促进了·OH的产生进而导致单位Fe(Ⅱ)氧化量下MnB1菌株的失活率更高。
(2) 柠檬酸钠、草酸和腐殖酸均通过阻止铁(氢)氧化物沉淀的生成来抑制实验体系中MnB1菌株的失活。其中,草酸和腐殖酸的抑制作用大于柠檬酸钠,其原因为前两者对铁(氢)氧化物沉淀生成的抑制作用更强。