氢氧化钙改性沸石对磷酸盐的吸附特性
2021-06-07陈广王梦玉安莹周振何玥涵袁瑶
陈广,王梦玉,安莹,周振,何玥涵,袁瑶
(1.上海城投污水处理有限公司,上海 201203;2.上海电力大学 环境与化学工程学院,上海 200090)
磷富集会引起水体富营养化,导致水环境质量下降[1]。除磷的方法有化学沉淀法[2-3]、生物法[4-5]和吸附法[6]等。吸附法具有操作简单、高效低耗、产泥量少等优点,是国内外研究热点之一[7]。沸石吸附能力强,储量丰富,价格低廉,表面带有恒定负电荷,常用作吸附氨氮、碱金属等阳离子,而对于磷酸盐等阴离子选择吸附性较低,这使沸石在水处理中的应用受到限制[8]。为提高沸石对水中磷酸盐的吸附能力,本研究制备了一种氢氧化钙改性沸石,考察其对水中磷酸盐的吸附性能,以期为利用氢氧化钙改性沸石去除水中磷酸盐提供理论和技术支持。
1 实验部分
1.1 试剂与仪器
沸石,采用河北石家庄天然绿色沸石(粒径4~5 mm),主要化学成分见表1;抗坏血酸、钼酸铵、KH2PO4、NaOH、Ca(OH)2、KCl均为分析纯。
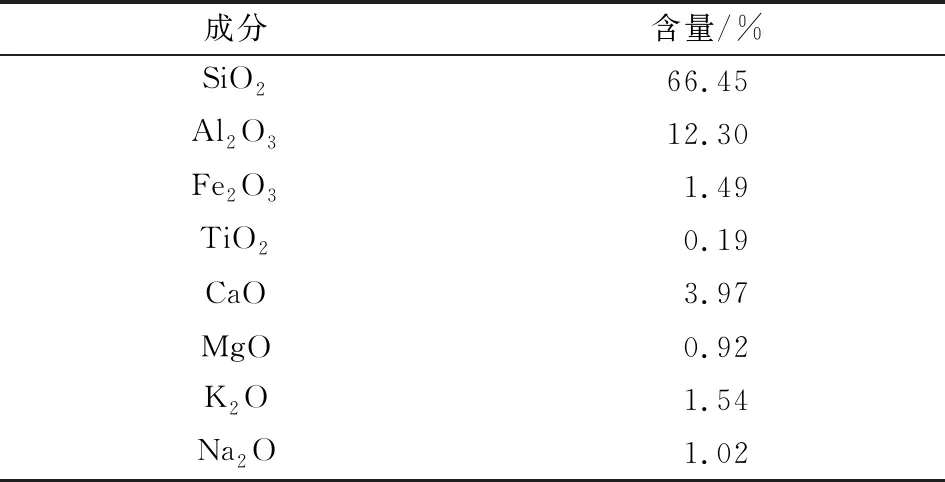
表1 沸石的主要化学成分
L6S型紫外可见分光光度计;H01-1B型精密pH计;FA2004型分析电子天平;DZ-6020型电热恒温干燥箱;TS-100B型恒温培养振荡器。
1.2 改性沸石的制备
称取一定量天然沸石于锥形瓶中,加入200 mL浓度为0.25 mol/L的氢氧化钙溶液,在25 ℃、200 r/min 转速下振荡反应24 h,弃去溶液,去离子水洗涤数次,105 ℃下烘干,密封保存。
1.3 吸附实验
磷酸盐溶液采用蒸馏水与KH2PO4进行配制,并稀释至所需浓度,用0.1 mol/L的NaOH和HCl溶液调节pH值。
在200 mL浓度为10 mg/L磷酸盐溶液中投加60 g/L改性沸石(CaT-Z)和天然沸石(NZ),于 25 ℃、200 r/min转速下振荡反应24 h,静置、过滤后,采用钼锑抗分光光度法测定上清液中磷酸盐质量浓度。计算对磷酸盐的去除率及吸附量。
2 结果与讨论
2.1 氢氧化钙浓度对沸石吸附磷效果的影响
氢氧化钙浓度对改性沸石去除磷酸盐效果的影响见图1。
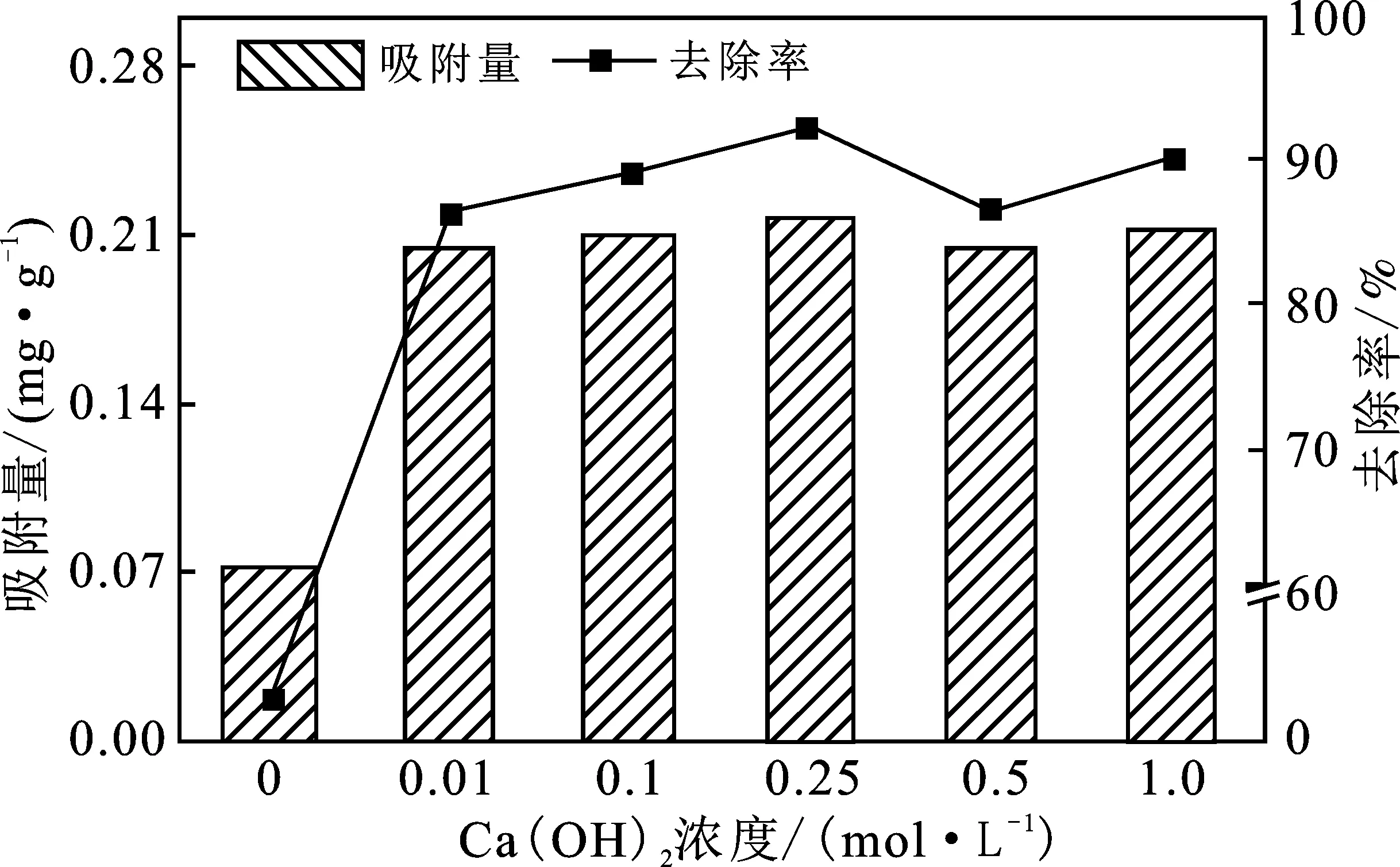
图1 氢氧化钙浓度对磷酸盐去除率及吸附量的影响
由图1可知,与天然沸石相比,改性沸石对磷酸盐的吸附量明显增加,对磷酸盐的去除率均在80%以上。氢氧化钙浓度为0.25 mol/L时,氢氧化钙改性沸石对磷酸盐的吸附容量最大。所以,采用 0.25 mol/L 氢氧化钙改性沸石。
2.2 沸石投加量对吸附性能的影响
沸石改性前后,沸石投加量对磷酸盐溶液吸附效果的影响见图2。
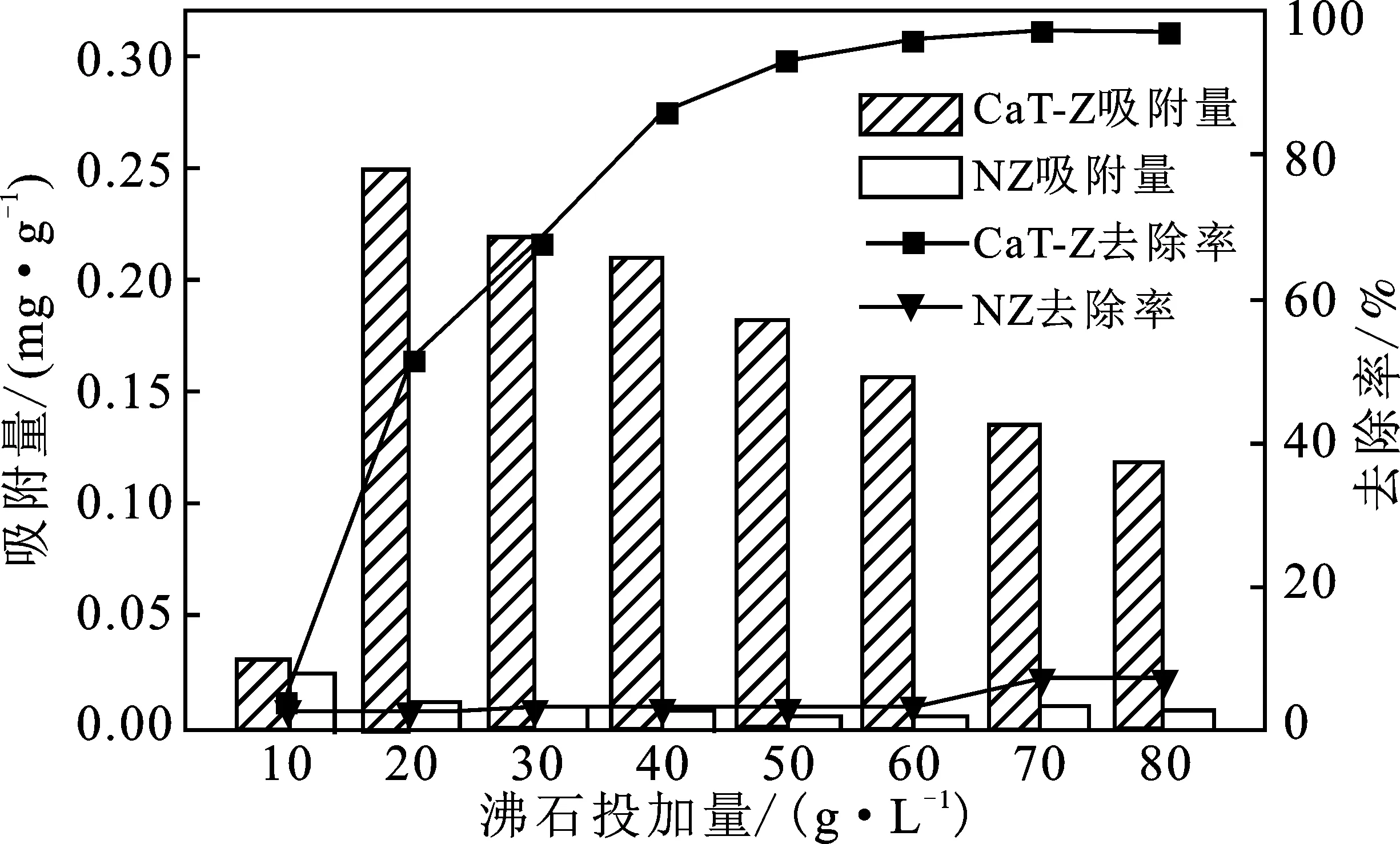
图2 沸石投加量对磷酸盐去除率及吸附量的影响
由图2可知,CaT-Z对磷酸盐的去除率随CaT-Z投加量的增加而增加,CaT-Z投加量>60 g/L时,去除率变化逐渐趋向平缓。CaT-Z对磷酸盐的吸附量呈现先升高后下降的趋势,投加量20 g/L时,吸附量达最高0.249 mg/g。分析原因是,在磷酸盐浓度一定的条件下,CaT-Z投加量增多,可提供的吸附位点越多,磷酸盐越容易与吸附位点结合而被吸附,去除率也就越大。当CaT-Z投加量增加到一定程度后,可引用“配给比”的概念分析原因,配给比是单位吸附剂所能分配的吸附质的量[9]。当初始磷酸盐浓度不变时,CaT-Z投加量增多,单位CaT-Z的磷酸盐配给比减少,即单位吸附剂的吸附位点不能被充分利用,产生空余活性位置,使得吸附容量的利用率下降。综合考虑后,选取60 g/L作为氢氧化钙改性沸石的最佳投加量。天然沸石(NZ)对磷酸盐的去除率和吸附量也有同样变化趋势,但远低于改性沸石。
2.3 pH值对吸附性能的影响
沸石改性前后,pH值对磷酸盐溶液吸附效果的影响见图3。
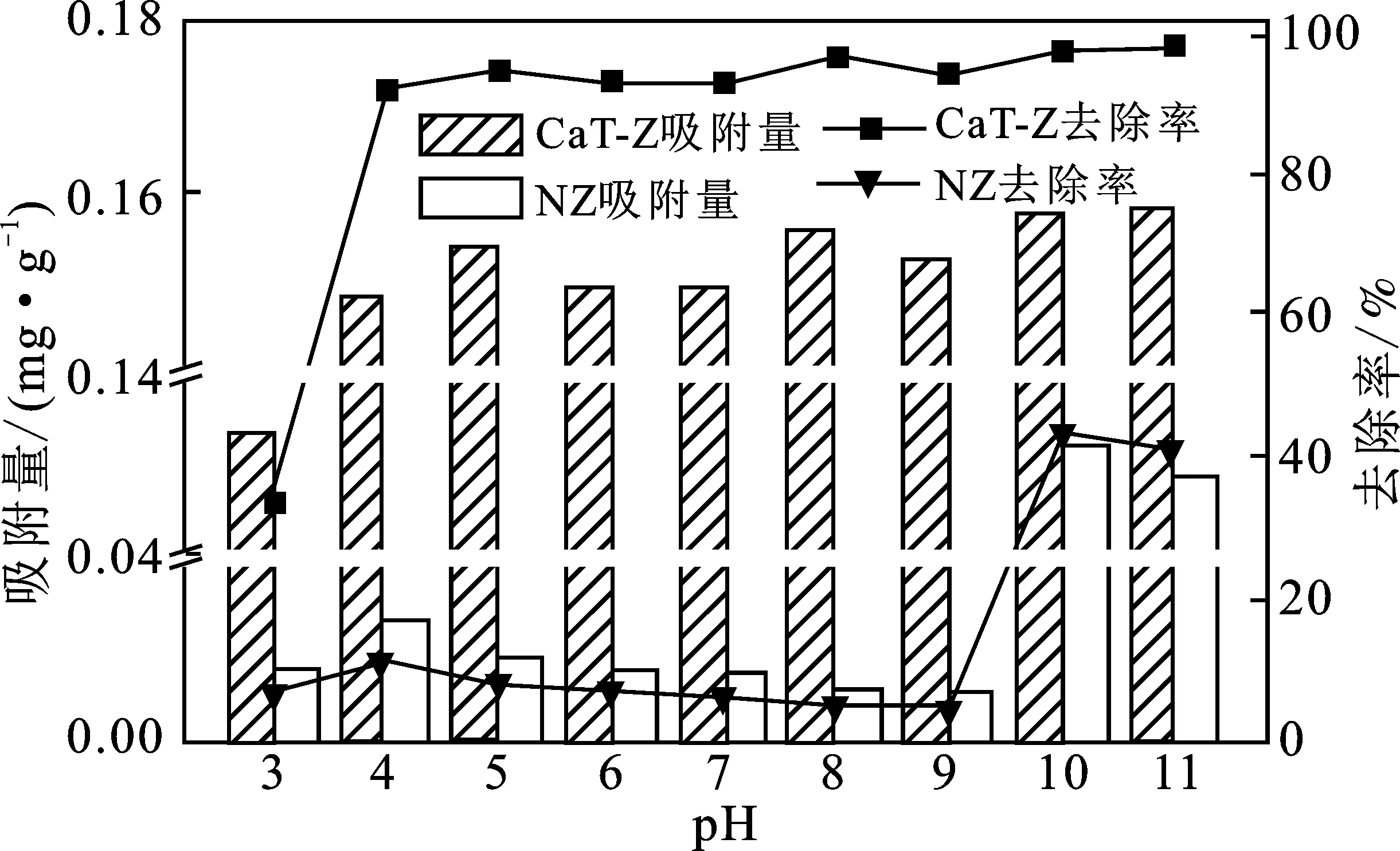
图3 pH值对磷酸盐去除率及吸附量的影响

2.4 吸附时间对吸附性能的影响
沸石改性前后,吸附时间对磷酸盐溶液吸附效果的影响见图4。
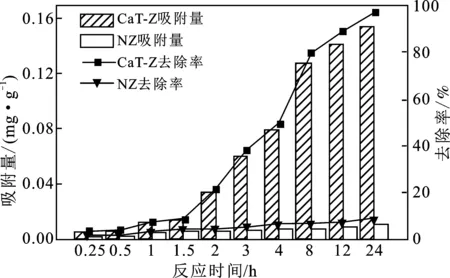
图4 吸附时间对磷酸盐去除率及吸附量的影响
由图4可知,CaT-Z和NZ对磷的吸附均呈现“吸附缓慢、平衡缓慢”的特点。磷酸盐的吸附过程是一个缓慢过程,CaT-Z吸附4 h时的吸附量仅为平衡吸附量的1/2。在吸附平衡时间为24 h时,CaT-Z的吸附容量达0.155 mg/g,与NZ相比提高了近14倍。可能是改性增加了沸石表面的吸附活性位点;也可能是改变了沸石内部结构,利于吸附质进入内部吸附位点,提高了吸附量。
选择准一级动力学方程、准二级动力学方程、Elovich动力学方程和颗粒内扩散方程对CaT-Z和NZ的吸附动力学结果进行拟合,结果见表2、表3[12]。

表2 天然沸石及改性沸石对磷酸盐的吸附动力学方程拟合结果
准一级动力学方程
ln(qe-qt)=lnqe-k1t
(1)
准二级动力学方程
(2)
Elovich动力学方程
qt=(1/βE)ln(αEβE)+(1/βE)lnt
(3)
颗粒内扩散方程
(4)
式中qe,qt——分别对磷酸盐吸附平衡时和t时吸附量,mg/g;
k1——准一级吸附动力学常数,h-1;
k2——准二级吸附动力学常数,g/(mg·h);
αE——初始吸附速率常数,mg/(g·h);
βE——脱附速率常数,g/mg;
kw——颗粒内扩散速率常数,mg/(g·h0.5);
C——与边界层厚度相关的常数。
由表2可知,NZ准二级吸附动力学的相关系数较准一级吸附动力学和Elovich动力学的更高,对磷酸盐的平衡吸附值(qe)与准二级吸附动力学所计算的(qe,cal)相接近,且两者相对误差较小,表明NZ吸附特性更符合准二级吸附动力学,CaT-Z吸附特性更符合准一级吸附动力学。NZ对磷酸盐的吸附行为也比较符合Elovich方程,其相关系数(R2)为0.984;而CaT-Z对Elovich方程式的拟合结果较差,表明CaT-Z对磷酸盐的吸附具有非均质分布的表面吸附能。
将内扩散曲线分两段或多段拟合,结果见图5。
由图5可知,图中拟合直线均不过原点,表明颗粒内扩散不是唯一限速步骤,存在液膜扩散的影响[13]。比较CaT-Z和NZ的吸附速率常数(kw)值可知,CaT-Z内扩散速率远大于NZ,说明氢氧化钙改性有利于提高颗粒的扩散速率,截距(C)表征边界层效应,由表3可知,随吸附进行,CaT-Z的边界层厚度减小(C1>C2),说明随吸附进行,边界层阻力效应减小,液膜扩散速率因阻力减小而增大;而NZ随吸附进行,液膜扩散速率因阻力增大而减小。表明氢氧化钙改性降低了液膜扩散的影响。
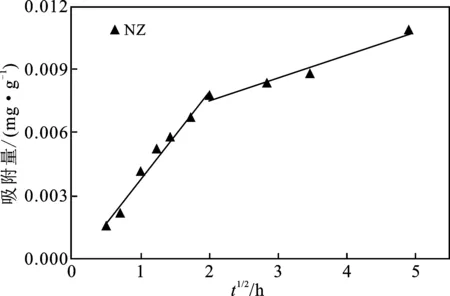
图5 颗粒内扩散方程拟合曲线

表3 颗粒内扩散方程拟合结果
2.5 吸附等温线
选择Langmuir、Freundlich、Dubinin Radushkevich、Temkin和Koble Corrigan等温方程对不同初始磷酸盐浓度下平衡吸附数据进行拟合,结果见表4[12]。
(5)
(6)
Dubinin Radushkevich等温方程
lnqe=lnqm-KDRε2
(7)
Temkin等温方程qe=BTlnAT+BTlnCe
(8)
BT=RT/bT
式中qm——理论饱和吸附量,mg/g;
qe——平衡吸附量,mg/g;
ce——平衡时溶液中磷酸盐浓度,mg/L;
KL——Langmuir吸附常数;
KF——Freundlich吸附常数;
KDR——Dubinin Radushkevich吸附常数;
ε——polenyi势;
AT——平衡结合常数,L/g;
bT——与吸附热相关的常数,J/mol。
由表4可知,对于NZ而言,在20 ℃和30 ℃时,Freundlich等温方程式的R2值均高于其他三者的拟合结果,说明NZ对磷酸盐的吸附更符合Freundlich等温方程式。CaT-Z在20 ℃时,对磷酸盐的吸附更符合Freundlich等温方程式;而在30 ℃时,对磷酸盐的吸附更符合Langmuir等温方程式。
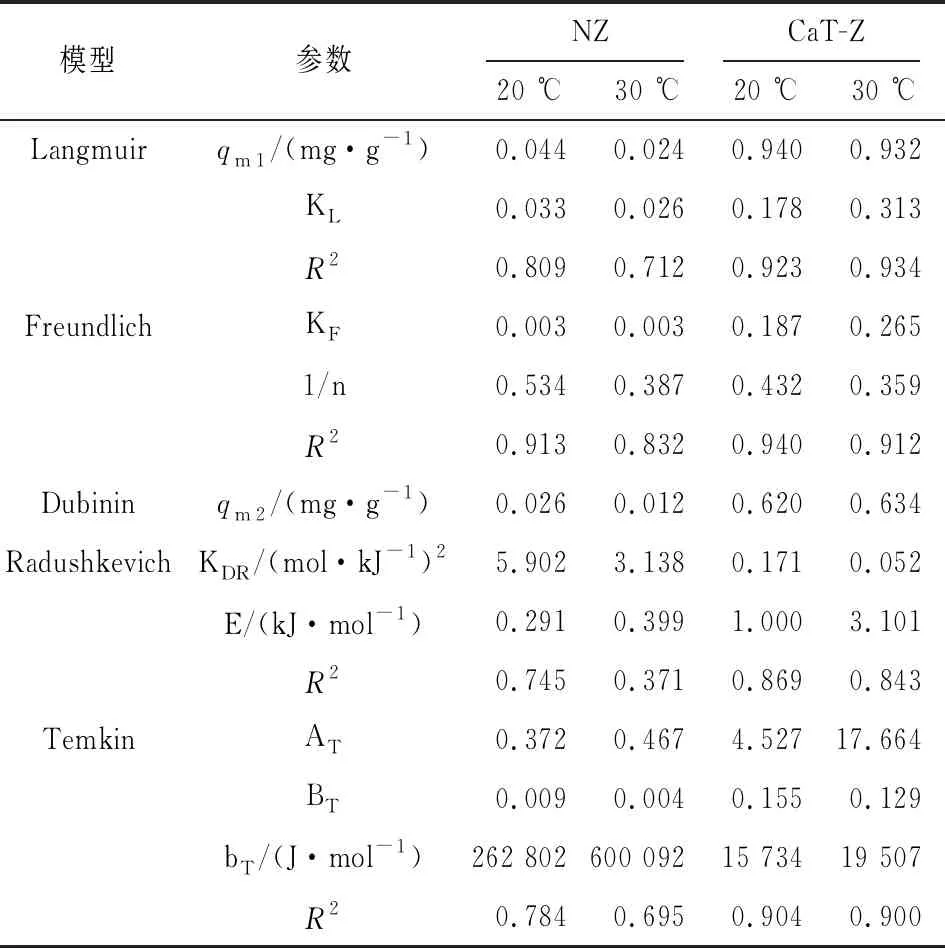
表4 天然沸石及改性沸石对磷酸盐的吸附等温方程拟合结果
在Langmuir等温方程式中,CaT-Z的最大理论吸附容量(qm)远大于NZ,经氢氧化钙改性后,qm在20 ℃时提高了21倍,在30 ℃时提高了39倍。由此可见,氢氧化钙改性明显提高了沸石对磷酸盐的吸附能力。在Freundlich等温方程式中,1/n<1.0表明磷酸盐易被吸附[14-15]。CaT-Z的1/n值 将吸附磷酸盐的改性沸石洗净、烘干,置于锥形瓶中,采用KCl-NaOH-HCl逐级浸提法解吸[18],在35 ℃、170 r/min转速下振荡反应24 h,解析后得到的磷的形态分别是可溶解性P、Fe或Al与磷酸盐结合态的磷(Fe、Al-P),Ca或Mg与磷酸盐结合态的磷(Ca、Mg-P),结果见表5。 表5 吸附饱和改性沸石在不同解析液中的解吸率 由表5可知,在KCl溶液中未检测出磷酸盐含量,表明CaT-Z没有吸附水溶液中的可溶性磷酸盐,物理吸附不是改性沸石除磷的主要机理。磷酸盐在HCl溶液中的解吸率最高,可见主要以Ca或Mg与磷酸盐结合态的磷为主。CaT-Z中Mg含量较低,磷主要以Ca-P形式存在,表明以Ca2+与KH2PO4之间化学反应为主的化学吸附是CaT-Z吸附除磷的主要途径,与等温吸附结果一致。结合图3,CaT-Z对磷酸盐的去除率在pH值为4~11之间时无明显变化趋势,可分析出:随pH值的增加,CaT-Z表面正电荷减少,通过静电引力对磷酸盐的吸附变少,而减少的吸附量与CaT-Z表面生成的磷酸钙沉淀抵消[4]。表明去除率对pH值的无关性与吸附机理有关,其反应机理如下: Ca(OH)2Ca2++2OH- Ca5(PO4)3·OH-+4H+ (1)氢氧化钙改性能够显著提高沸石对磷酸盐的吸附性能,最佳改性条件为:氢氧化钙浓度为0.25 mol/L,改性时间为24 h。 (2)对于初始磷浓度为10 mg/L的模拟废水,沸石投加量为60 g/L,吸附时间为24 h时,改性沸石对磷酸盐的去除率可达97%,平衡吸附量为0.155 mg/g。pH值对吸附过程影响较小。 (3)天然沸石对磷酸盐的吸附符合Freundlich等温方程式;改性沸石在20 ℃时,对磷酸盐的吸附符合Freundlich等温方程式,在30 ℃时符合Langmuir等温方程式。 (4)改性沸石吸附磷的主要机理是化学吸附。2.6 解吸实验

3 结论
