铁线莲‘朱卡’组织培养技术及再生体系的建立
2021-06-04莫建彬付艳茹奉树成
高 燕,莫建彬,付艳茹,奉树成
(上海植物园,上海城市植物资源开发应用工程技术研究中心,上海 200231)
铁线莲(Clematisflorida)被誉为“藤本皇后”,为毛茛科(Ranunculaceae)铁线莲属多年生草质或木质藤本植物,少数直立草本或灌木[1]。铁线莲萼片花瓣状,着色丰富,几乎包括了所有常见的花色,花型多变;花期长,可以做到三季开花;应用形式多样,近些年在注重拓展城市绿化空间、增加绿量、关注立体绿化的城市,特别在大中型城市精致园艺中受到广泛关注,具有很大的观赏和应用价值。铁线莲除南极洲外,在全球范围内广泛分布,全世界记录铁线莲属植物约15组350余种,主要分布在热带、亚热带,我国有9组140余种(不包括变种)[2],是该属的主要分布中心之一。国内铁线莲育种工作起步较晚,现在应用的多数品种来自欧洲等国。然而由于价格昂贵、品种数量少,极大影响了铁线莲在中国园林绿化中的应用。
波兰铁线莲品种Clematis‘Julka’(‘朱卡’)属早花大花型类群(early large-flowered group),在2002年的荷兰Plantarimu植物展会上获银奖。‘朱卡’萼片长6~8 cm,宽4 cm左右,花径可达10~15 cm,紫红色带有深红色条纹。在上海地区4—8月开花。目前由于种苗市场垄断,进口品种价格高,种子繁殖困难,母株少,分株或扦插繁殖受限,难以满足市场需要。因此,研究铁线莲‘朱卡’组织培养快繁技术对规模化生产以开拓国内市场具有重要意义。
对铁线莲的组织培养研究,黄鑫[3]分别以铁线莲‘蓝天使’和‘紫铃铛’的茎段和叶片为起始材料研究了器官发生两种途径的组织培养方式并建立再生体系。铁线莲‘蓝天使’和‘紫铃铛’利用不同的NAA和6-BA组合诱导出腋芽和愈伤组织,再经过芽增殖—壮苗—生根和愈伤组织增殖—分化的方法,构建组织培养体系。张丽琼等[4]对绿花重瓣铁线莲以MS为基本培养基,添加不同浓度2,4-D和6-BA形成愈伤组织;马育珠等[5]以Clematis‘Bill MacKenzie’的幼嫩茎段为起始材料,以MS为基本培养基添加6-BA和IBA形成愈伤组织,但绿花重瓣铁线莲和C. ‘Bill MacKenzie’的后续愈伤组织分化及生根等均鲜见报道。宋微等[6]铁线莲‘波兰精神’(C. ‘Polish Spirit’)带芽茎段为外植体,直接诱导丛生芽获得完整植株。吴红等[7]进行了钝齿铁线莲根尖组培再生体系的研究。魏淑云等[8]以铁线莲‘里昂城’(C. ‘Ville de Lyon’)为材料建立再生体系。近些年对铁线莲组织培养的研究开始增多,利用组织培养技术获得大量铁线莲是快速实现铁线莲推广应用最优的手段之一。
本研究以铁线莲品种‘朱卡’的幼嫩茎段为起始材料,进行腋芽诱导—不定芽增殖和愈伤组织诱导—愈伤组织再分化两种途径的研究,旨在建立该品种的组织培养再生体系,为进一步促进铁线莲优良品种的推广和应用奠定基础。
1 材料与方法
1.1 试验材料及培养条件
两年生铁线莲‘朱卡’,取自上海植物园种苗基地。春季3—4月下旬,取‘朱卡’顶端20 cm以内部分,截取带顶芽或腋芽的0.6~1.2 cm茎段作为试验材料。
试验培养温度为(23±2) ℃,光照度1 500~2 500 lx,光周期为16 h/d,相对湿度为60%~80%。
1.2 灭菌处理
对以下试验用品进行高压灭菌锅灭菌:蒸馏水、培养基、带盖三角瓶、镊子、解剖刀、滤纸。准备体积分数75%乙醇、质量分数10%次氯酸钠溶液、酒精灯。
将截取的铁线莲‘朱卡’茎段用体积分数2%洗洁精溶液震荡清洗并浸泡20 min,后流水冲洗30 min,置于灭菌的超净工作台中。将植物材料移入灭菌三角瓶中,加入75%乙醇震荡漂洗30 s,再用无菌水漂洗1次,接着用10%次氯酸钠溶液浸泡,设置时间梯度。植物材料接种25 d后,根据污染和诱导情况确认最适合的灭菌方式。每个处理接种13个茎段,重复5次。
1.3 直接器官发生途径
以幼嫩茎段为外植体诱导腋芽,增殖不定芽后生根,形成完整植株。
1)腋芽诱导。①基本培养基的筛选:采用MS、1/2 MS、WPM为基本培养基,添加NAA 0.05 mg/L、6-BA 0.5 mg/L、蔗糖30 g/L和琼脂6.9 g/L。观察并统计25 d后的诱导率。每个处理接种30个茎段,重复5次。②植物生长调节剂的筛选:采用MS为基本培养基,添加植物生长调节剂6-BA和NAA并设置梯度浓度。诱导30 d后,统计腋芽诱导率和芽苗生长状态,并综合确定最佳诱导培养基,每个处理接种21个茎段,重复5次。
2)不定芽增殖。增殖培养基以MS为基本培养基,添加植物生长调节剂6-BA、IBA和GA3并设置梯度。培养25d后,比较几种培养条件的增殖系数,观察不定芽的生长和增殖情况,每处理接种9个芽,重复5次。确定最佳不定芽增殖培养基。
1.4 间接器官发生途径
以幼嫩茎段为外植体诱导愈伤组织,愈伤组织再分化形成不定芽且生根后形成完整植株。
1)愈伤组织诱导。①基本培养基的筛选:采用MS、1/2 MS、WPM为基本培养基,添加6-BA 1.0 mg/L、NAA 0.05 mg/L、蔗糖30 g/L和琼脂6.9 g/L,观察愈伤组织状态,统计25 d后的诱导率,每个处理接种16个茎段,重复3次。②植物生长调节剂的筛选:以MS为基本培养基,添加不同浓度的6-BA和NAA。统计25 d后的诱导率,观察愈伤状态。每个处理7个茎段,重复5次。
2)愈伤组织增殖。以MS为基本培养基,添加蔗糖30 mg/L、琼脂6.9 mg/L,并添加不同浓度的植物生长调节剂6-BA和NAA,统计25 d后的愈伤增殖情况,观察愈伤组织状态。每处理接种7个愈伤组织,重复8次。
3)愈伤组织分化。以MS为基本培养基,添加蔗糖30 mg/L、琼脂6.9 mg/L,并添加不同浓度的植物生长调节剂6-BA、NAA,观察并统计25 d后的愈伤组织分化不定芽数量、不定芽生长情况,综合统计出最佳的不定芽分化培养基。每个处理接种愈伤组织12个,重复6次。
1.5 不定芽生根
以1/2 MS为基本培养基,分别添加植物生长调节剂IBA或NAA并设置梯度,经过25 d生长,对比生根数和根的生长状况,得出最佳的生根培养基。每处理接种4个芽,重复5次。
1.6 数据统计
各评价指标的计算公式如下:
污染率=污染数量/外植体总数×100%;
腋芽诱导率=诱导30 d后的萌芽数/外植体总数×100%;
腋芽增殖率=增殖培养25 d后的不定芽数/起始接种的腋芽数×100%;
出愈率=诱导30 d诱导出的愈伤组织数/外植体总数×100%;
愈伤组织增殖倍数=继代培养后愈伤质量/继代培养接种时愈伤质量×100%;
增殖倍数=25 d分化后不定芽数(每颗不定芽至少包含1个节);
生根率=生根数/接种数×100%;
平均根长=总根长/总根数;
平均根数=总根数/总生根苗数。
试验数据采用Excel 和SPSS软件统计,采用方差分析和多个独立样本非参数检验方法进行分析。
2 结果与分析
2.1 灭菌时间对铁线莲消毒效果的影响
采用10%次氯酸钠溶液对起始材料灭菌,灭菌时长如表1所示,采用多个独立样本非参数检验分析。灭菌时间越长,污染率越低,对应的出芽率和出愈率均呈现先上升后下降的趋势。灭菌12 min(A2)可以达到比较好的灭菌效果,污染率为14.6%,对应的出芽率和出愈率分别达到41.8%和56.4%。因此,以10%次氯酸钠溶液灭菌12 min(A2)为最佳的灭菌方法。
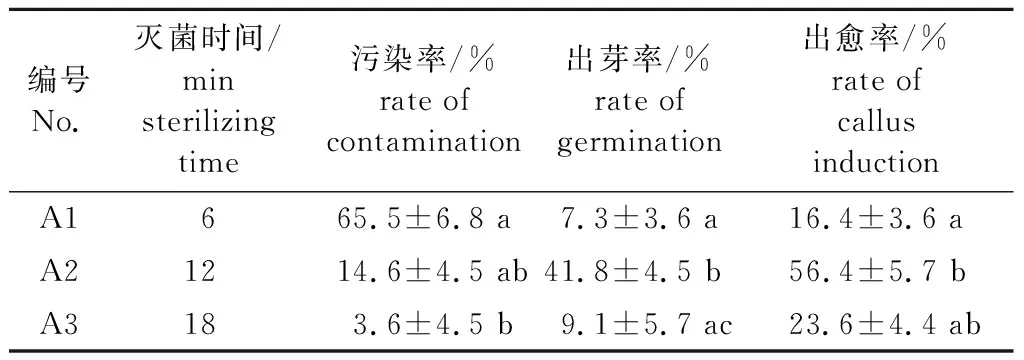
表1 不同灭菌时间对铁线莲消毒效果的影响
2.2 芽诱导基本培养基的筛选
以MS、1/2 MS、WPM为起始诱导基本培养基,均添加NAA 0.05 mg/L和6-BA 0.5 mg/L,采用多个独立样本非参数检验方法,比较不同基本培养基的芽诱导情况,结果如表2所示。当MS为基本培养基时出芽率最高,腋芽生长健康,叶片舒展、叶绿,无黄化、枯萎、玻璃化等不正常的现象,芽生长速度较快。以1/2 MS为基本培养基时,植株矮,叶片小,生长缓慢。以WPM为基本培养基时,出芽率极低,且生长30 d以后观察,植株矮小,叶片逐渐发黄后期枯萎。因此,MS为最适合铁线莲‘朱卡’的基本培养基。

表2 不同基本培养基对铁线莲诱导的影响
2.3 芽诱导植物生长调节剂的筛选
以MS为基本培养基,添加生长素NAA和细胞分裂素6-BA,观察芽生长情况,采用多个独立样本非参数检验方法,比较不同植物生长调节剂下的出芽率,结果如表3所示。

表3 不同植物生长调节剂对铁线莲腋芽诱导的影响
在不含生长素(C4、C7)、不含分裂素(C2、C3)或者完全不含植物生长调节剂(C1)的培养基上,诱导的出芽率均较低,叶片发黄,或生长缓慢。当6-BA增加为1.0 mg/L,腋芽诱导率上升,其中NAA 0.1 mg/L时,诱导率达到72.4%;NAA 0.3 mg/L时,出芽率达到38.1%,这两种情况下腋芽生长迅速,叶片舒展,无畸形,为最佳的诱导植物生长调节剂浓度配比。但过高的分裂素含量对诱导有抑制作用,且腋芽绿色,生长迅速,没有形成愈伤组织。
2.4 芽增殖生长调节剂的筛选
诱导出的芽转入增殖培养基。以MS为基本培养基,添加不同浓度IBA、6-BA和GA3。利用方差分析的方法比较不同植物生长调节剂条件下不定芽增殖速率,并观察芽生长状况,结果如表4所示。

表4 不同植物生长调节剂对铁线莲芽增殖的影响
因生长调节剂浓度及配比的不同,增殖倍数、芽生长状况均有差异。增殖过程中采用3因素3水平中L9(34)正交试验,随着6-BA浓度的增加,芽的增殖数出现先增加后略微下降的情况。在浓度较低时,茎段细,单节略微生长,较少出现分节。当添加6-BA 1.0 mg/L、IBA 0.20 mg/L、GA30.2 mg/L时,增殖倍数达到最大,茎段粗壮,分节较多,生长迅速,叶片深绿。因此,几种处理中D5为最佳增殖方案,增殖系数达5.52,且植株健康,即MS+6-BA 1.0 mg/L+IBA 0.20 mg/L+GA30.2 mg/L为最优方案。
2.5 愈伤组织诱导基本培养基的筛选
MS、1/2 MS、WPM作为愈伤组织起始诱导基本培养基,均添加NAA 0.05 mg/L和6-BA 1.0 mg/L,利用多个独立样本非参数检验方法,比较不同基本培养基下的出芽率及芽生长状况,结果如表5所示。

表5 不同基本培养基对铁线莲愈伤组织诱导的影响
3种培养基条件均可形成愈伤组织。当以1/2 MS为基本培养基时,16 d左右从茎段两侧切口处开始膨胀,形成浅黄色愈伤组织,出愈率为33.3%。以MS为基本培养基,12 d左右开始形成浅黄色愈伤组织,出愈率为56.3%。以WPM为基本培养基,获得愈伤组织很少,且呈黄色,致密,在后期培养过程中未能分化成芽,因此,最优的基本培养基为MS培养基。
2.6 愈伤诱导植物生长调节剂的筛选
以MS为基本培养基,添加6-BA和NAA两种生长调节剂,形成9种不同的配比。利用多个独立样本非参数检验方法,比较不同植物生长调节剂对铁线莲愈伤组织诱导的影响,结果如表6所示。

表6 不同植物生长调节剂对铁线莲愈伤组织诱导的影响
愈伤组织从11 d开始长出。整体来说,浓度较低的情况下,形成的愈伤组织呈淡黄白色且疏松,有利于后期愈伤组织分化成芽。高浓度的愈伤组织黄色且致密,后期愈伤组织基本无法分化成芽。其中F5、F7两种培养基的出愈率,均超过70%。比较两者的生长状况,其中F5为浅黄色,疏松;F7为黄色,愈伤组织增殖速度快但过于致密,在后期无法分化成芽。因此以F5(6-BA 2.0 mg/L、NAA 0.05 mg/L)为更优的植物生长调节剂配比。
2.7 愈伤组织增殖植物生长调节剂的筛选
不同植物生长调节剂对铁线莲愈伤组织增殖的影响见表7。愈伤组织增殖过程中,低浓度愈伤组织呈浅黄色,增殖极为缓慢,长时间增殖后愈伤组织僵化。高浓度下愈伤组织出现褐化。当6-BA 4.0 mg/L时,愈伤组织从淡黄色转至黄色,硬化,后期愈伤组织无法分化成芽。G4和G5培养基增殖倍数均接近4,两种培养基无显著差异,愈伤组织生长状态好,浅黄色,与诱导出的愈伤组织状态相似。考虑到植物生长调节剂宁低勿高的原则,以NAA 0.2 mg/L、6-BA 2.0 mg/L的G4培养基为愈伤组织增殖最优培养基。
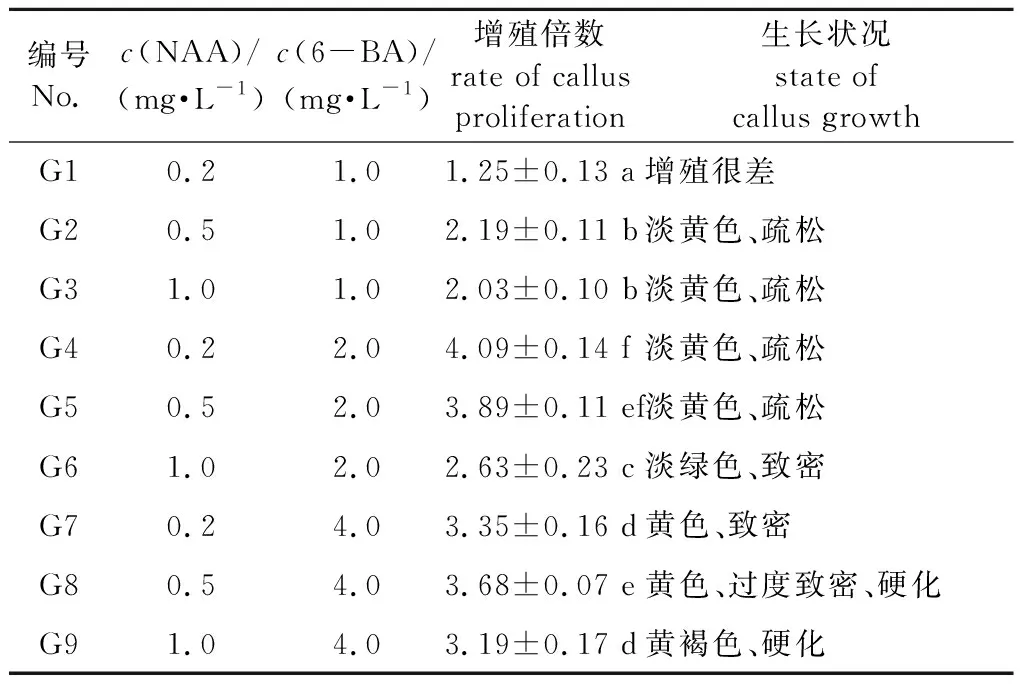
表7 不同植物生长调节剂对铁线莲愈伤组织增殖的影响
2.8 愈伤组织分化植物生长调节剂的筛选
将状态较好的愈伤组织转移至分化培养基上,9种分化培养基如表8所示,按照多个独立样本非参数检验方法,比较不同植物生长调节剂对铁线莲愈伤组织分化的影响。当6-BA为1.0 mg/L时无法分化成芽;当6-BA为3.0 mg/L时,愈伤组织生长状态发生变化。当NAA 0.03 mg/L时,愈伤组织黄绿色,有突起,可分化成芽,芽在经过15 d左右生长至1.5~3.5 cm的高度,且可分化出1~3个节间的茎段,叶片略小,分化率可达76.7%,平均不定芽为3.1;而NAA增至0.05 mg/L时,分化率和不定芽数均下降。因此,最优分化培养基为6-BA 3.0 mg/L、NAA 0.03 mg/L。

表8 不同植物生长调节剂对铁线莲愈伤组织分化的影响
2.9 不定芽生根植物生长调节剂的筛选
以1/2 MS为基本培养基,分别添加IBA 和NAA两种生长调节剂,比较不同植物生长调节剂对铁线莲生根的影响,如表9所示。根据根的生长情况、生根数、植株生长状况综合考虑,筛选植物生长调节剂及配比。添加NAA无法形成根;添加IBA时,从生根率看,I1和I2处理没有显著差异,但生根数有显著差异。当IBA 0.3 mg/L时,平均生根数为4.10,明显高于IBA 0.1 mg/L条件下的生根数,且I1和I2两种情况下根的生长状态没有太大差异,根系粗壮,生长较快,因此,添加IBA 0.3 mg/L为更优的生根方案。
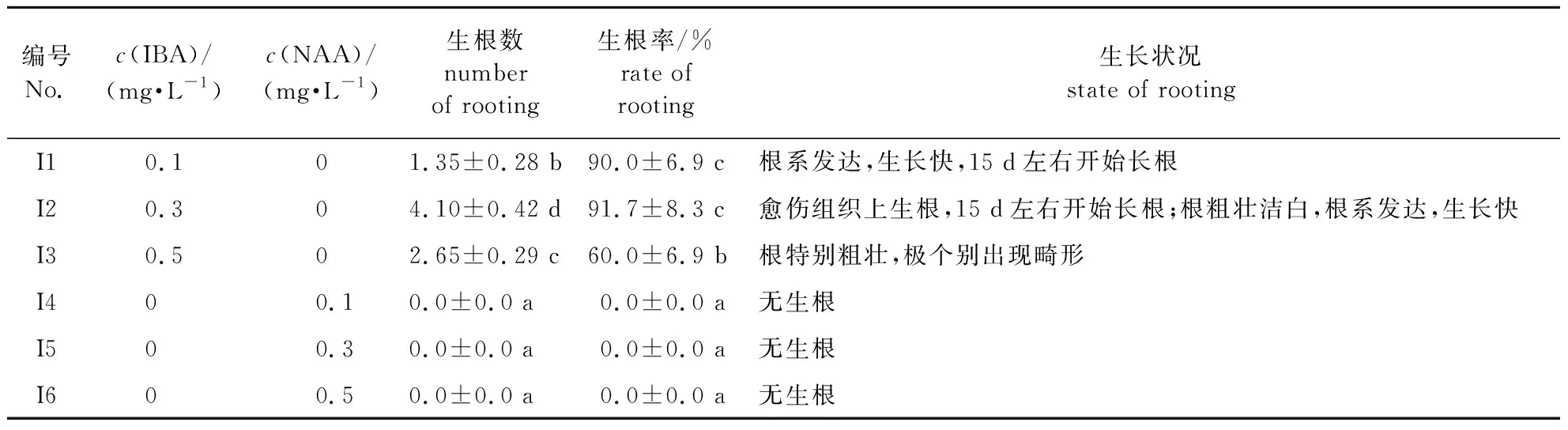
表9 不同植物生长调节剂对铁线莲生根的影响
3 讨 论
组织培养能加速植物种苗繁殖,提高植物产量和品质。德国植物学家 Haberlandt于1902年提出植物细胞全能性(cell totipotency)理论,即植物体的每个细胞都有发育成完整个体的潜能[9]。组织培养是在离体条件下利用人工培养,在无菌情况下培养、生长、发育再生出完整植株的过程[9]。起始材料选取茎尖分生组织、形成层、木质部、韧皮部、表皮组织、胚乳组织等部位[10]。顶芽或腋芽再生是观赏植物离体再生的主要途径[11],在铁线莲‘朱卡’组织培养中,选用顶芽和靠近顶端的腋芽部位,该部分细胞分裂旺盛,是组织培养中常用的起始材料。
起始材料的灭菌要求较高,一般表面积越大,越难灭菌。铁线莲表面有细小绒毛,更易附着病原菌,增加了灭菌难度。组织培养的灭菌剂可以选用体积分数70%~75%乙醇、次氯酸钙、次氯酸钠、过氧化氢、硝酸银、氯化汞等溶液。其中,体积分数70%~75%乙醇具有较强的杀菌力、穿透力和润湿作用,可以排除材料上的空气以利于其他消毒剂的渗入,因此常常和其他灭菌剂共同使用。本试验使用75%乙醇结合10%次氯酸钠溶液对铁线莲‘朱卡’灭菌,不同的灭菌时间对腋芽和愈伤组织诱导率的影响均呈现先上升后下降的趋势,时间过短会导致灭菌不彻底,外植体污染严重;时间过长会加大灭菌剂对材料的伤害。随后需用灭菌水多次漂洗材料并用滤纸吸收残留水,尽量减少残留灭菌液对外植体的伤害[12]。
基本培养基在植物组织培养中起到支撑作用,包含了植物生长所需的基本元素。黄鑫[3]在对铁线莲‘蓝天使’的带芽茎段诱导中,腋芽萌发以MS为最适合的基本培养基,而不定芽增殖以1/2 MS基本培养基为佳;在对铁线莲‘蓝天使’的愈伤组织诱导和增殖中以MS为佳。宋微等[6]在对铁线莲‘波兰精神’的腋芽诱导中,以1/2 MS基本培养基为佳。铁线莲‘朱卡’在芽和愈伤组织的诱导中尝试采用MS、1/2 MS和WPM基本培养基,均以MS基本培养基最佳。由此可见,铁线莲不同品种之间、不同组培阶段对各种元素的需求不同,需要根据培养过程中的表现进行调节。这一结论与板栗品种组织培养的基本培养基相似,对不同树种或者同一树种采用不同的诱导途径,选用的基本培养基有所差异,甚至需要在常用基本培养基上对某些元素含量进行调整[13]。
植物生长调节剂对细胞生长、组织和器官的分化发育、植物离体培养中的细胞分化和形态建成都有明显的调节作用[14]。天然植物生长调节剂包括生长素、细胞分裂素、赤霉素、乙烯和脱落酸。本试验中添加的生长调节剂包括生长素(NAA、IBA)、细胞分裂素(6-BA)和赤霉素(GA3)。生长素参与植物根和茎的发育、器官衰老和维管束组织的形成等植物生长分化过程。生长素浓度较低时,导致增殖缓慢,植株长势弱;但生长素浓度过高时,导致叶片和芽苗畸形。在对喜树和红松组培生根的过程中,添加生长素类植物生长调节剂可以形成大量不定根[15]。黄鑫[3]在对铁线莲‘蓝天使’诱导生根时添加0.05 mg/L NAA,生根率可以达到70.22%。本试验对铁线莲‘朱卡’的诱导生根中尝试用IBA和NAA 两种生长素,只有在添加IBA时可诱导生根。细胞分裂素可以促进细胞分裂扩大,抑制衰老,诱导芽分化和侧芽生长[12]。在对铁线莲相关研究中应用较多的分裂素包括6-BA、KT、TDZ。在绿花重瓣铁线莲中6-BA更有利于愈伤组织诱导。本试验分裂素6-BA可以起到较好的芽和愈伤组织诱导、增殖的作用。过低的分裂素导致芽或愈伤组织生长缓慢,但过高的分裂素在增殖过程中导致芽增殖过密,芽苗细弱、节间短,个别出现新芽失色转至枯黄现象,可能是因为浓度过高导致顶端分生组织停止分化或细胞坏死所致[16]。细弱芽苗在后期炼苗过程中影响移栽存活率。
生长素与细胞分裂素常常一起使用,植物生长调节剂的组合效应大于单种植物生长调节剂的效应[14],生长素与细胞分裂素的比值控制着植物形态建成的发展方向。以茎段为起始材料诱导时,细胞分裂素6-BA和生长素NAA浓度配比不同,诱导出的结果不同。较高浓度6-BA加上较低浓度NAA有利于愈伤组织诱导,铁线莲‘朱卡’在愈伤组织诱导中采用NAA 0.05 mg/L +6-BA 2.0 mg/L的浓度配比,腋芽诱导中采用NAA 0.1 mg/L+6-BA 1.0 mg/L的浓度配比效果最好。这与铁线莲‘蓝天使’诱导结论类似[17]。浓度过高会影响植株生长发育,引起畸形或褐化等情况。相比较铁线莲‘朱卡’愈伤组织诱导和增殖过程,高浓度细胞分裂素有助于愈伤组织分化,但高浓度NAA抑制愈伤组织分化,因此分化过程中考虑提高细胞分裂素和降低生长素浓度。在铁线莲‘朱卡’分化过程中,提高细胞分裂素6-BA浓度至3.0 mg/L并降低生长素NAA浓度至0.03 mg/L,在此浓度配比下可得到较好的分化率和不定芽数。这与铁线莲‘蓝天使’[17]和木本油料作物美藤果(Plukenetiavolubilis)[18]愈伤组织分化结论一致。
赤霉素对高等植物的各个生长发育阶段,特别是茎段延展[19-20]、叶片生长[21-22]等生理过程起到重要的调控作用。赤霉素(GA3)在马铃薯试管苗快繁中应用较多。张志军[23]研究表明,马铃薯在IAA、GA3和BAP 3种植物生长调节剂共同作用下,相比较使用IAA和BAP的处理,其鲜质量和平均直径分别提高409.6%和184.4%,由此证明GA3和IAA在马铃薯块茎形成中互作增强。本试验中,添加GA3后芽苗明显伸长,叶片舒展。铁线莲‘朱卡’不定芽增殖阶段,最佳培养基为MS+IBA 0.20 mg/L+ 6-BA1.0 mg/L+GA30.2 mg/L。
生根培养时,大多数植物都需要经过愈伤组织诱导分化形成根,这个过程经常需要植物生长调节剂的参与。铁线莲‘朱卡’的芽基部形成颗粒状愈伤组织,并在愈伤组织上生根,属于愈伤型生根。这种生根方式与重瓣榆叶梅[24]、柑橘等情况相似[25]。
