氮杂环卡宾催化的亲核取代反应
2021-06-03赵明杨立庆许玉荣
赵明,杨立庆,许玉荣
合肥师范学院化学与化学工程学院,合肥 230601
醛、酮是大学有机化学中的重点学习内容,醛的一个重要化学性质就是和醇、亚硫酸氢钠、氨衍生物、Grignard试剂等发生的反应[1]。由于醛羰基中氧原子的电负性比碳原子的电负性大,即氧原子吸电子能力更强,使得碳氧双键的电子云偏向于氧,导致碳带有正电性,因此和这些试剂发生的反应都属于亲核反应[1]。醛典型的反应就是作为亲电试剂和亲核试剂发生亲核加成反应;在有机催化剂氮杂环卡宾的催化作用下,醛的反应极性可以发生改变,由亲电性转变为亲核性,极性反转的醛作为亲核试剂可以发生亲核加成反应和亲核取代反应(图1)[2–4]。氮杂环卡宾能够催化醛和醛、醛和酮、醛和亚胺之间发生安息香缩合反应,也能够催化醛和Michael受体发生Stetter反应以及催化醛和未活化双键、三键发生氢酰化反应,这些反应都属于加成反应[5–12]。在本文中,我们介绍在氮杂环卡宾催化作用下,改变醛的反应极性,具有亲核性的醛与带有离去基团底物发生的取代反应。

图1 醛发生的反应
1 氮杂环卡宾催化亲核取代反应
在反应中,氮杂环卡宾和醛进行结合,经质子转移,形成Breslow中间体,Breslow中间体具有亲核性,等同酰基负离子,使得醛的反应极性由亲电性转变成亲核性,然后与含有离去基团的底物经过不同的反应路径发生取代反应(图2)。对于含有较活泼离去基团底物或仲卤代烷,在反应过程中离去基团首先离去形成碳正离子,然后具有亲核性的Breslow中间体进攻碳正离子,得到相应的取代产物;对于苄基卤代烃、烯丙基卤代烃、α-卤代酮等,Breslow中间体经过双分子亲核取代反应过程(SN2)得到取代产物;对于烯丙基卤代烃,Breslow中间体也可以进攻双键上的碳,通过SN2’过程得到取代产物。

图2 氮杂环卡宾催化的取代反应
1.1 氮杂环卡宾催化SN1反应
厍学功教授课题组[13]利用较活泼的OTs (对甲苯磺酰氧基)作为离去基团,在反应中首先形成碳正离子或者碳正离子进一步重排,然后与Breslow中间体反应,实现氮杂环卡宾催化的SN1取代反应(图3)。通过底物不同可以选择性构筑苯并吡喃酮或苯并呋喃酮化合物,当底物R2为H时,产物为苯并吡喃酮2,当R2为苯基时,产物为苯并呋喃酮3。

图3 选择性合成苯并吡喃酮和苯并呋喃酮
Glorius教授课题组[14]利用二芳基溴甲烷作为反应底物对氮杂环卡宾催化的取代反应进行了研究(图4)。二芳基溴甲烷6在反应过程中溴原子可以先离去形成碳正离子,然后碳正离子与芳香醛5在噻唑类氮杂环卡宾催化剂8作用下形成的Breslow中间体反应,得到偶联产物7;二芳基溴甲烷6在反应过程中也可以不经过碳正离子中间体,直接和Breslow中间体,通过SN2过程,得到偶联产物7。

图4 芳香醛和二芳基溴甲烷偶联
1.2 氮杂环卡宾催化SN2反应
邓卫平教授课题组[15]报道了氮杂环卡宾12催化的分子间取代反应,使用含有离去基团的苄基型底物10,经过SN2过程,得到α-芳基酮化合物11 (图5)。在有氧气的条件下,此反应会得到成酯的副产物,并且含有离去基团的苄基型底物和DBU (1,8-二氮杂双环[5.4.0]十一碳-7-烯)也会反应生成铵盐副产物,导致反应底物失去反应活性,影响反应的产率。随后,Yadav教授课题组[16]报道了氮杂环卡宾催化的以α-溴代酮为底物的分子间取代反应;芳香醛13在氮杂环卡宾16催化作用下形成的Breslow中间体与α-溴代酮14经SN2过程,得到了1,3-二酮化合物15 (图6)。

图5 α-芳基酮化合物的合成

图6 1,3-二酮化合物的合成
同年,Yadav教授课题组[17]发展了氮杂环卡宾催化芳香醛与活泼烯丙基溴类底物之间的亲核取代反应。芳香醛17在氮杂环卡宾16作用下,与活泼烯丙基溴类底物18经过SN2反应过程,得到烯丙基酰化产物19 (图7)。
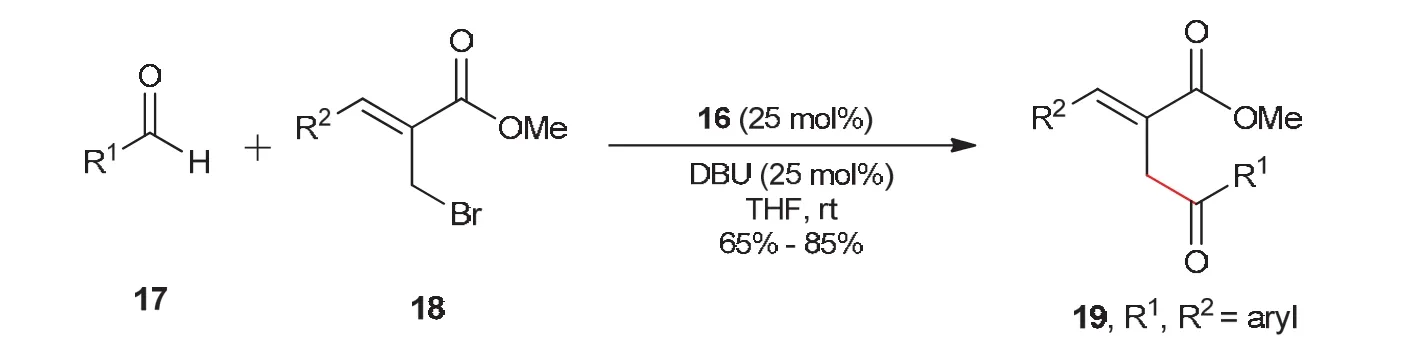
图7 NHC催化的分子间SN2反应
1.3 氮杂环卡宾催化SN2’反应
在氮杂环卡宾催化作用下,对于含有离去基团的烯丙型底物,极性反转的醛不仅可以进攻连有离去基团的碳原子,也可以进攻双键的碳原子;当进攻双键的碳原子时,双键上的电子再进攻离去基团,发生SN2’反应。
周岭教授课题组[18]以含有烯丙基溴的芳香醛为底物报道了氮杂环卡宾催化的分子内SN2’取代反应(图8)。反应经过SN2’取代异构化过程,得到α,β不饱和酮产物21,除了离去基团为Br的底物,离去基团为OTs、Cl的底物也可以发生反应。通过对机理的研究,也证实了反应的过程,排除了α,β不饱和酮产物21是经过加成-消去过程得到的。随后,周岭教授课题组[19]对氮杂环卡宾催化的不对称分子内SN2’反应进行了报道,实现氮杂环卡宾催化取代反应的手性控制。对于含有烯丙基溴的芳香醛底物,增加双键上的取代基,有助于手性中心的构筑,防止产物的进一步重排,经过不对称分子内SN2’反应,最终以好的产率和高的立体选择性得到具有全碳季碳手性中心的苯并吡喃酮产物23 (图9)。此反应对双键上的取代基具有良好的适用性,而底物醛的电性对整个反应有较大影响。

图8 NHC催化的分子内SN2’反应
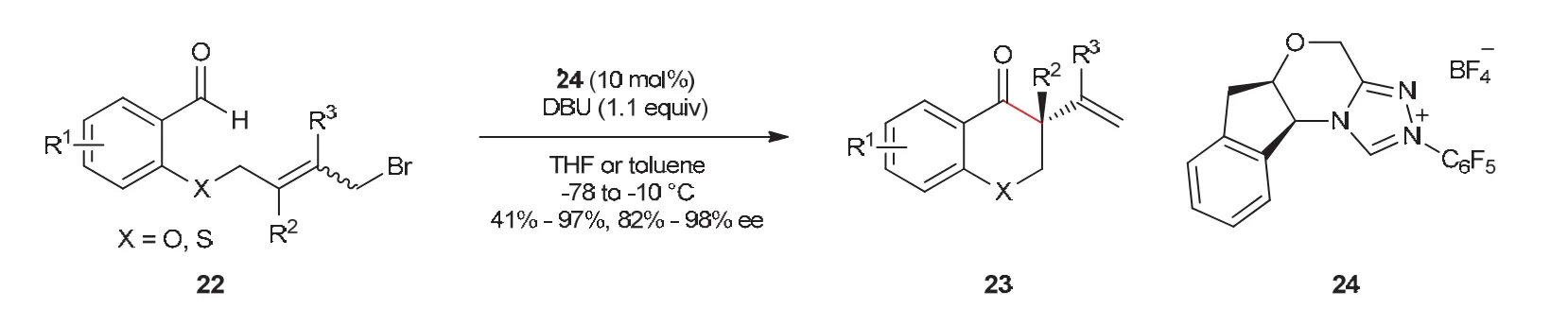
图9 NHC催化的不对称取代反应
1.4 其他反应过程
在上述氮杂环卡宾催化的取代反应中,极性反转的醛可以和相应的底物经SN1、SN2、SN2’过程得到最终的取代产物。此外,通过加成-消去、消去-加成反应过程,也能够达到相应取代的产物。Suzuki教授课题组[20]报道了氮杂环卡宾催化芳香醛和对硝基氟苯的反应,通过加成-消去过程,得到对硝基氟苯芳酰基化产物(图10)。对硝基氟苯由于硝基的强吸电子作用,使得氟原子所连的碳具有亲电性,在反应中形成的Breslow中间体首先进攻带有正电性的碳,发生加成反应,然后苯环上的电子转移回来,氟原子离去,再在碱(NaH)的作用下拔去中间体羟基上的质子,接着卡宾离去,同时得到对硝基氟苯芳酰基化产物27。

图10 对硝基氟苯芳酰基化反应
游书力研究员课题组[21]报道了氮杂环卡宾催化苯磺酰基吲哚类化合物酰基化反应,通过消去-加成过程,得到酰化产物(图11)。在反应过程中,吲哚类化合物29在碱性条件下,首先失去氮上的质子,接着电子转移,作为离去基团的苯磺酰基离去,发生消去反应,形成亲电中间体,然后极性反转的醛和亲电中间体发生加成反应,得到酰基化产物31。
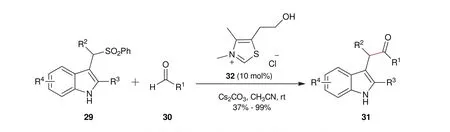
图11 苯磺酰基吲哚类化合物酰基化反应
2 结语
本文主要介绍了氮杂环卡宾催化的取代反应。总的来说,氮杂环卡宾催化的取代反应可以通过SN1、SN2、SN2’、加成-消去、消去-加成过程得到相应的产物。然而,氮杂环卡宾催化的取代反应也存在反应底物有限、反应效率不高、催化剂用量大、碱和底物成盐等问题,进一步丰富和发展氮杂环卡宾催化的取代反应具有重要的研究意义。此外,氮杂环卡宾在催化的安息香缩合反应、Stetter反应、氢酰化反应、环加成反应、酯化反应、酯交换反应等方面都取得了重要的研究进展。氮杂环卡宾催化新型反应也在不断的发展,此部分内容,供大家交流学习、参考,拓展本科的教学内容。
