中性粒细胞/淋巴细胞比值对晚期肝细胞癌FOLFOX肝动脉灌注化疗近期疗效的影响
2021-06-03吴林耿陈猛苟庆麦启聪周泽健
吴林耿,陈猛,苟庆,麦启聪,周泽健
1.广东省人民医院(广东省医学科学院)肿瘤中心介入治疗科,广东广州510080;2.汕头大学医学院,广东汕头515041
前言
肝细胞癌(Hepatocellular Cancer,HCC)症状隐匿,25%~70%的患者确诊时已处晚期,失去根治性治疗的最佳时期[1]。靶向药物治疗(索拉菲尼和仑伐替尼)是目前最受国内外指南推荐的晚期HCC一线治疗,然而因其客观反应率低和对乙肝感染群体不敏感等限制,接受靶向治疗患者的中位总生存期(Overall Survival,OS)仅为4.2~7.9个月[2-3]。因此,如何提高患者长期生存是目前晚期HCC治疗中亟待解决的困局。多项研究表明,运用FOLFOX方案的肝动脉灌注化疗(Hepatic Arterial Infusion Chemotherapy,HAIC)已被揭示可能作为晚期HCC一线治疗有效的替代治疗方法[4-5]。虽然HAIC可显著提高晚期HCC患者的疾病无进展时间(Progression Free Survival,PFS)和OS,但其客观缓解率(ORR)仅29.4%~40.0%。在此情况下,对治疗反应提早预测并筛选出对HAIC反应不佳的人群,对晚期HCC临床管理具有重要临床意义。
机体的免疫微环境及慢性炎症与肿瘤的发展、复发及转移具有明确的相关性。外周血中性粒细胞/淋巴细胞比值(Neutrophil to Lymphocyte Ratio,NLR)是机体慢性炎症反应的重要指标[6],其对多种肿瘤的疗效、复发等具有良好的预测效能[7]。有报道表明在HCC患者中NLR能有效预测介入栓塞化疗术、根治性外科切除及HAIC术后的疗效及复发风险[8]。然而,目前尚未有探索NLR对FOLFOX方案的HAIC术后疗效评估;此外,目前国内缺乏对NLR预测HAIC治疗晚期HCC疗效的研究。本研究通过对接受HAIC治疗的晚期HCC患者进行回顾性研究,旨在探讨FOLFOX方案的HAIC的有效性、安全性,以及NLR对疗效预测的价值。
1 资料与方法
1.1 病例纳入标准
对2018年1月~2019年12月在广东省人民医院接受FOLFOX方案HAIC治疗的92例晚期HCC患者行回顾性分析。需满足以下所有标准方纳入分析:(1)经过病理学诊断或欧洲肝病学会(EASL)影像学标准[9]确诊为HCC患者;(2)对靶向药物不耐受或不同意行靶向治疗患者;(3)有完整的相关病史随访资料及足够长的随访时间;(4)预计生存期超过3个月;(5)ECGO PS评分<2分;(6)Child-Push评分A/B。
1.2 病例排除标准
符合下列条件中的任何一条,将不纳入本研究:(1)同时患有严重的心血管疾病,如心肌梗塞、不稳定型心绞痛、恰当药物治疗后仍无法控制的高血压、充血性心力衰竭、需药物治疗的心律失常;(2)曾患或体格检查显示中枢神经系统疾病(如原发性脑肿瘤、标准治疗无法控制的癫痫、任何脑转移或中风史);(3)有任何HAIC禁忌证者:门静脉闭塞、凝血功能严重障碍、肝肾功能衰竭、严重的其他全身性疾病,如感染或糖尿病等;(4)对灌注化疗所使用化疗药或造影剂过敏者;(5)曾患或现正并发其他恶性肿瘤,已治愈的基底细胞癌、原位癌除外。
1.3 手术方法
患者及家属均对治疗方式知情并签署知情同意书。采用Seldinger穿刺法穿刺单侧股动脉,使用5F RH(Terumo,日本)导管依次行腹腔动脉、肝总动脉造影(必要时行肠系膜上动脉、右肾动脉、膈动脉造影),确认肿瘤位置、数量、大小、靶血管,再使用微导管超选进入肿瘤供血动脉,留置导管及导管鞘,返病房行FOXFOL方案HAIC。具体方案如下:奥沙利铂(130 mg/m2,第1天输注,持续泵注时间3 h)、亚叶酸钙(400 mg/m2,接奥沙利铂,持续泵注时间2 h)、氟尿嘧啶(400 mg/m2,缓慢注射;2 400 mg/m2,最后连续输注46 h)。所有化疗药物均经留置的动脉导管输注,每3周为1个治疗周期。
1.4 术后处理
化疗期间常规予以护肝、护胃、抗肿瘤等支持治疗,根据患者反应酌情使用止呕、抗感染、止痛等对症处理。
1.5 术后随访
所有入组患者均在治疗前1周内行常规血液检查,每间隔3周血常规复查,每6周影像学复查。终止治疗的标准包括影像学评价进展,不可耐受的不良反应,死亡或患者拒绝进一步治疗,另外病灶降期为可接受根治性手术亦作为标准。主要研究终点为PFS和肝内肿瘤无进展生存时间(ITPFS),肿瘤缓解率和安全性。PFS定义为从开始治疗到影像学评估进展或死亡的时间。ITPFS被定义为从开始治疗到影像学评价肝内肿瘤进展或死亡的时间。肿瘤缓解率包括客观缓解率(ORR)和疾病控制率(DCR)。ORR定义为在首次放射学确诊后,具有完全缓解加部分缓解并维持至少4周的患者的百分比,DCR为ORR加稳定疾病的患者的百分比。使用mRECIST标准评估患者治疗疗效,通过两名放射科医师独立评估,以减少误差的可能性。
1.6 统计学方法
采用SPSS19.0统计学软件,符合正态分布的计量资料用均数±标准差表示,采用t检验;计数资料采用χ2检验,Kaplan-Meier描绘PFS生存曲线,生存率比较使用Log-Rank法检验。P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
入选患者年龄(53.4±12.8)岁,男82例、女10例。肝动脉灌注化疗前NLR<4.0组53例,NLR≥4.0组39例。两组中最常见的既往治疗方法是靶向药物治疗,其他既往治疗方法包括中药治疗等(表1)。在配对队列中,各组之间在基线方面的任何主要混杂因素之间均不存在显著差异。入组病例的基线人口统计学和临床特征见表2。共入组92例患者,其中72例(78.3%)感染乙型肝炎病毒(HBV),所有入组HBV患者均进行了抗病毒治疗。所有入组患者在治疗过程中均未出现肿瘤治疗相关死亡,治疗并发症以呕吐、腹痛为主,对症支持治疗后均可缓解。
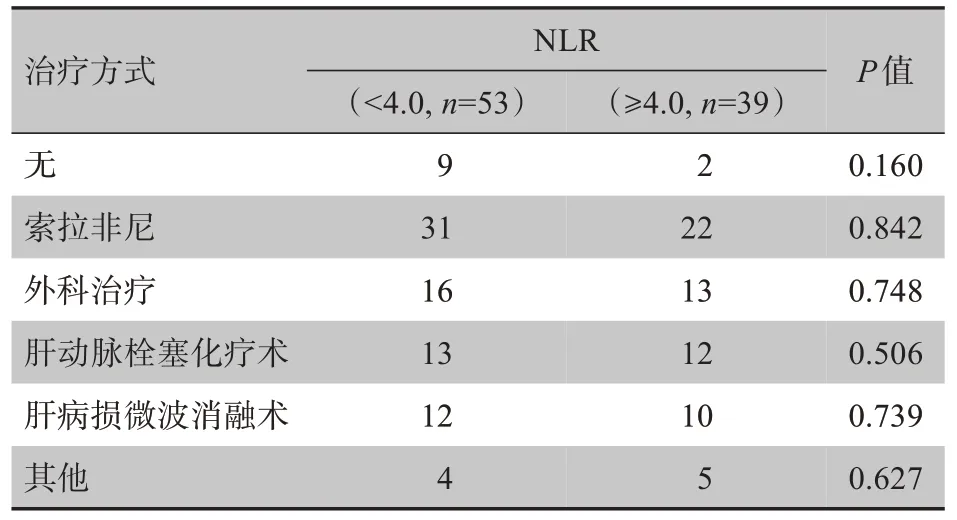
表1 HCC患者按NLR分层的既往治疗Tab.1 Previous interventions of hepatocellular cancer(HCC)patients grouped according to neutrophil to lymphocyte ratio(NLR)

表2 不同NLR分组HCC患者基线特征Tab.2 Baseline characteristics of hepatocellular carcinoma patients grouped according to NLR
2.2 疗效评估
根据mRECIST标准进行评价,没有患者取得完全缓解(CR),29位(31.5%)患者获得部分缓解(PR),ORR为31.5%,同时10位(10.9%)患者获得疾病稳定(SD),DCR为42.4%,而53位(57.6%)患者疾病进展(PD)。NLR<4.0组患者的ORR显著高于NLR≥4.0组患者(41.5%vs17.9%,P=0.016)。NLR<4.0组患者的DCR显著优于NLR≥4.0组(52.8%vs28.2%;P=0.018)。
2.3 近期生存
中位随访时间为14.5个月(范围为6.3~20.6个月)。在随访期间,所有患者均发生疾病进展。中位PFS为3.9个月(95%置信区间为3.1~4.7个月),中位ITPFS为5.4个月(95%置信区间为4.7~6.1个月)。单独针对肝内病灶进行疗效评估,NLR<4.0组的中位PFS(月)较NLR≥4.0组更长(6.1vs4.1,P=0.013)。针对全身肿瘤病灶进行疗效评估,NLR<4.0组和NLR≥4.0组之间的中位PFS(月)也有显著差异(4.3vs3.1,P=0.022)。
2.4 多因素Cox分析
将影响HAIC术后HCC近期疗效的危险因素[NLR≥4.0、AFP≥400 ng/mL、肿瘤直径>5 cm、肝硬化病史、HBsAg阳性、血管侵犯及远处转移]列入多因素Cox风险回归模型,结果显示术前高NLR是预测HAIC术后近期疗效的独立不良影响因子[OR(95CI%)=2.448(1.138~5.265),P=0.031]。见表3。
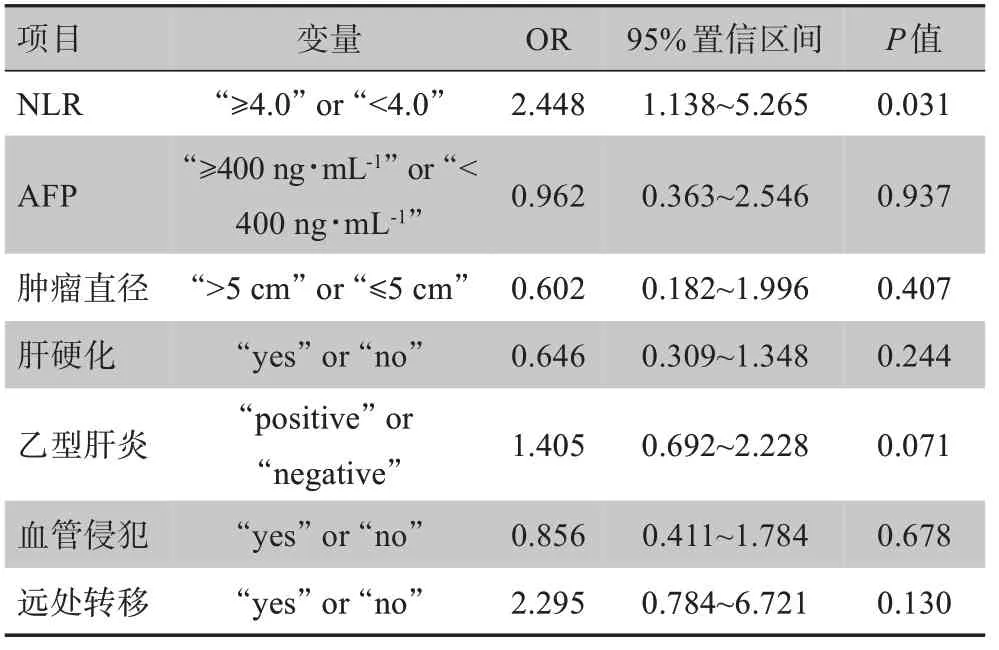
表3 HCC患者HAIC术后影响PFS的多因素Cox风险回归模型分析Tab.3 Multivariate Cox risk regression model analysis of factors affecting postoperative progression free survival in HCC patients receiving hepatic arterial infusion chemotherapy
3 讨论
慢性炎性改变在肿瘤发生、发展中的作用已经被广泛研究[10]。实体肿瘤自身可诱导周围炎性微环境,NLR作为检测指标反映身体对肿瘤的炎性反应。肿瘤微环境中含有多种细胞因子或趋化因子,可促进肿瘤生长并抑制白细胞对肿瘤细胞的攻击[11]。中性粒细胞在肿瘤微环境中可在TGFβ作用下获得非炎症表型,从N1型(促炎症)变为N2型(抗炎症),使肿瘤得以生长而不受任何免疫干扰,增强肿瘤细胞侵袭、转移能力并逃避机体免疫系统监视[12]。淋巴细胞在肿瘤或病毒感染的先天性或适应性免疫反应中起重要作用,通过抑制肿瘤细胞增殖及转移的能力,维持癌细胞免疫平衡起到抑制肿瘤进展作用[13-14]。因此,NLR作为一种反映机体炎症反应及免疫应答状态的良好标记物,可用于预测肿瘤患者的治疗反应及预后。
近年来,晚期HCC患者一线治疗的局限性一直备受关注,如何提高晚期HCC患者长期生存已是目前临床研究的热点。多种免疫检查点抑制剂被推荐用于晚期HCC联合或二线治疗,然而晚期HCC患者总体5年生存率仍然<12%。因此临床上亟需新的补救治疗方法或替代治疗。基于FOLFOX方案HAIC治疗晚期HCC已被既往研究证实可显著提高患者的生存期,且具有可接受的毒性作用。本研究回顾性分析92例接受HAIC治疗的晚期HCC患者,ORR和DCR分别是31.5%和42.4%,与Lyu等[4]研究结果相似。这提示虽然HAIC对晚期HCC有良好的治疗效果,但较低的ORR极大地限制晚期HCC的预后,特别是对于伴有静脉侵犯的病人,如何在术前高效地评估晚期HCC患者的治疗反应及预后是临床上亟需解决的问题。
根据国内外多个研究发现,NLR可能是HCC或肝病研究领域的一个独立预后指标[15-16]。NLR作为一种无需繁杂检测、价格低廉的临床参数,拥有良好的临床应用前景。本研究中,我们分别评估了高NLR组及低NLR组患者治疗反应情况,发现NLR<4.0组患者的ORR、DCR显著比NLR≥4.0组患者高,尤其对于肝内病灶的疗效评估中,该差异更为显著;在生存获益方面,NLR<4.0组的中位PFS较NLR≥4.0组更长,虽然有肝外转移患者的PFS较短[4],但肝内病灶进展是引起肝功能衰竭死亡的主要原因[17],肝内病灶的有效控制有利于提高患者远期生存期。Bruix等[18]研究发现病灶无肝外扩散、丙型肝炎病毒患者、NLR≤3.1的肝癌患者使用索拉菲尼治疗疗效更佳。此外,有研究报道认为索拉菲尼联合FOLFOX方案的HAIC治疗对伴有门静脉侵犯的晚期HCC患者总生存率高于索拉菲尼,且具有较高的安全性[19]。由此可见,FOLFOX方案HAIC可能是晚期HCC患者一项有效的替代治疗,而NLR作为一个疗效及预后的预测指标,能够有效帮助临床医师提早识别出可能对HAIC治疗反应不佳的患者,制定更有效的替代治疗方案,极大地改善晚期HCC患者的预后,可为晚期HCC患者的治疗提供新思路。
