超声造影联合弹性超声定量分析对乳腺癌新辅助化疗反应性的预测价值
2021-06-02向斌
向斌
(重庆三峡中心医院超声科,重庆404000)
新辅助化疗(neoadjuvant chemotherapy,NAC)是目前治疗乳腺癌(breast cancer,BC)的有效方法,临床研究显示,NAC对于BC患者生存率及生存质量提升有积极的作用[1]。但经过规范化治疗后仍有部分患者未达到预期目标,从而需接受其他治疗,而对于BC患者前期规范化治疗方式较多,且治疗前进行个体化治疗方案的选择能有效提升治疗效果。目前,临床上将超声造影(contrast-enhanced ultrasonography,CEUS)通过对造影剂的灌注量及速度建立诊断曲线,对于病灶组织的大小、结构及血供等关键因素的判断作用显著[2]。而弹性超声定量(elastic ultrasound quantitative,EU)则是通过对病灶的硬度进行量化,对于BC患者病理、预后等因素判断效能较好[3]。但将上述两种方法运用于判断患者NAC治疗后效果预测的研究较少。本研究探究超声造影联合弹性超声定量分析对乳腺癌新辅助化疗反应性的预测价值,现报道如下。
1 资料与方法
1.1 临床资料 选取2017年1月至2019年2月于本院确诊BC并行NAC治疗的患者61例。纳入标准:①BC符合《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》中的诊断标准[4];②达到NAC适应证指征;③年龄<60岁;④患者及家属签署知情同意书;⑤研究经医院伦理委员会审核批准。排除标准:①造影剂不耐受或NAC禁忌证;②存在既往BC治疗史;③未达到治疗周期导致NAC效果无法判定。
1.2 方法 治疗前患者分别使用CEUS及EU进行检查。
1.2.1 CEUS检查 采用Philips EPIQ 5型超声诊断仪,普通探头频率为12 MHz,造影探头频率为9 MHz,机械指数0.08,动态范围DR51,输出功率4 w。先使用普通探头基本确定病灶位置后,静脉注射造影剂2.4 mL,使用造影探头动态监测病灶及周围组织造影剂灌注情况,保存图像资料后使用软件分析并记录病灶始增时间(arrive time,AT)、峰值时间(peak time,PT)、峰值强度(peak intensity,PI)、上升支斜率(rising slope,K1)。
1.2.2 EU检查 采用Philips EPIQ 5型超声诊断仪,探头频率为5~13 MHz,确定患者病灶位置后选择弹性成像模式,确保取样范围大于病灶范围,以3~4级压力梯度显示值在病灶处做增减压的匀速震动,维持弹性图3 s左右后保存图像并使用软件分析并记录应变率(strain ratio,SR)。
1.2.3 新辅助化疗 化疗方案为《指南》中推荐的FAC方案,尿氟嘧啶500 mg/m2+多柔比星50 mg/m2+环磷酰胺500 mg/m2,21 d为1个治疗周期,共治疗6个周期[4]。
1.3 观察指标
1.3.1 新辅助化疗效果评价 根据WHO颁布的恶性肿瘤治疗标准,将治疗后未达到完全缓解(complete relief,CR)和部分缓解(partial relief,PR)的患者定义为治疗效果不敏感[5]。根据NAC治疗是否有效分为敏感组和不敏感组。
1.3.2 临床资料及辅助检查结果 包括年龄、病程、瘤体直径、家族史、分娩史、绝经期、基础疾病、临床分期、病理分型、分子分型、CEUS及EU检查量化结果。
1.4 统计学方法 采用SPSS 22.0软件进行数据分析,计量资料以“±s”表示,比较采用t检验,计数资料用[n(%)]表示,比较采用χ2检验,影响因素分析采用二元Logistic多元回归分析,CEUS及EU对于NAC结果的预测分析采用ROC曲线。曲线下面积(AUC)比较采用Z检验,以P<0.05为差异有统计学意义。
2 结果
2.1 NAC治疗后效果 治疗后,未达到CR及PR患者24例(不敏感组),不敏感率为39.34%;达到CR及PR患者37例(敏感组),敏感率为60.66%。
2.2 NAC治疗效果影响因素的单因素分析 敏感组和不敏感组患者的临床资料及辅助检查结果进行单因素分析显示,不敏感组患者瘤体直径、PI、K1及SR值均显著高于敏感组(P<0.05),见表1。

表1 NAC治疗效果影响因素的单因素分析Table 1 Univariate analysis of the influencing factors of NAC treatment effect
2.3 NAC治疗效果影响因素的Logistic回归分析 以NAC治疗后效果为因变量(1=敏感,0=不敏感),以瘤体直径(实测值)、PI(实测值)、K1(实测值)及SR(实测值)进行二元Logistic回归分析,结果显示,K1和SR是影响NAC治疗结果的独立因素(P<0.05),见表2。
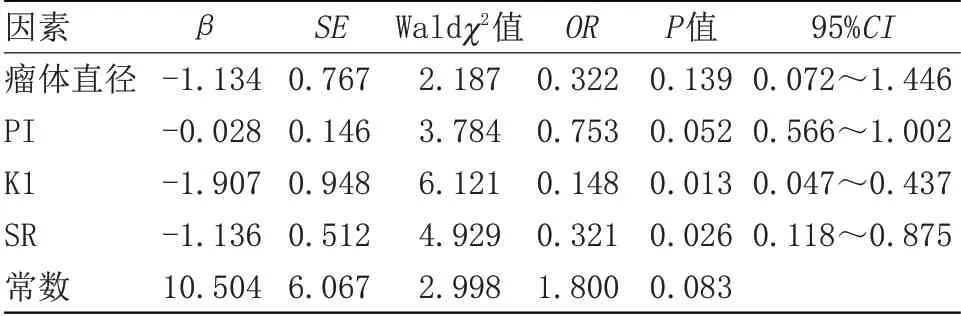
表2 NAC治疗效果影响因素的Logistic回归分析Table 2 Logistic regression analysis of the influencing factors of NAC treatment effect
2.4 CEUS、EU及联合检测对于NAC结果的预测分析 根据Logistic回归分析结果,选择对于治疗效果的独立影响因素作为NAC结果预测的指标分别对CEUS(K1)、EU(SR)及联合检测(K1联合SR)预测NAC的预测效果进行分析。CEUS、EU及联合检测预测NAC的AUC分别为0.695、0.713及0.830。其中CEU检测的cut off值为1.37,SEU检测的cut off值为5.02,联合检测AUC明显较高(P<0.001)。CEUS预测的敏感性、特异性、阳性预测值及阴性预测值分别为83.7%、50.0%、72.1%及66.7%,EU预测的敏感性、特异性、阳性预测值及阴性预测值分别为70.3%、62.5%、74.3%及57.7%,联合检测预测的敏感性、特异性、阳性预测值及阴性预测值分别为59.6%、95.8%、95.6%及60.5%,见表3、图1。

表3 CEUS、EU及联合检测对于NAC结果的预测分析Tab 3 Prediction and analysis of NAC results by CEUS,EU and combined detection
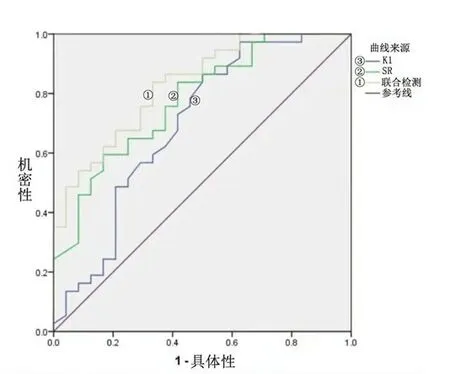
图1 CEUS、EU及联合检测对于NAC结果的ROC曲线Figure 1 ROC curves of CEUS,EU and combined tests on NAC results
3 讨论
NAC可为手术或进一步治疗创造有利条件,而在对于有适应证的BC患者中,可能由于不同因素导致治疗效果欠佳,从而延误手术时机,对患者远期生存影响相对较大,寻找对NAC效果有效的预测指标是临床研究中的热点[1]。本研究结果显示,K1和SR是影响NAC治疗结果的独立因素。NAC开始后对病灶部位血管影响较大,会导致病灶内血管萎缩闭塞,而NAC所致的病灶部位炎性应答诱发的显微组织增生还会将病灶分割,如患者治疗前病灶部位已出现上述改变会导致疗效进一步受影响。化疗药物需通过血液循环到达病灶部位,故病灶部位灌注情况较好,微血管密度丰富的患者化疗效果相对较好,以往研究提示,K1与BC病灶部位大小、灌注情况及微血管密度明显相关,与本研究结果相似[6]。SR是反应病灶部位硬度的指标,Cox等[7]研究结果也显示,通过硬质培养环境的BC细胞株对于新辅助化疗的耐受性更好,说明病灶硬度较大的BC患者接受新辅助化疗的效果较差,因此,EU可明显影响NAC治疗的效果。而以往有研究将肿瘤直径作为影响新辅助化疗疗效的指标[8-9],但仅凭直径无法对瘤体进行全面评估,且该研究中晚期BC患者较多,对研究结果影响也较大。
本研究结果显示,联合检测AUC明显较高,说明联合检测对NAC预测可行性较好。联合检测可提升预测的特异性,本研究中,联合检测的特异性为95.8%,由于CEUS及EU两种方式对于瘤体的评价方向不同,因此,通过联合检测对于瘤体情况评价更完善。EU对于NAC治疗效果预测具有一定可行性,但由于肿瘤异质性等原因,其内部结构并不完全均匀,而CEUS则是对肿瘤内部结构评价相对较好的方法,通过造影可对瘤体构造进行更全面的评价。
本研究为单中心小样本量研究,故纳入患者在病理、分子分型上可能存在偏倚,同时,有研究证实,三维弹性成像对于肿瘤内部构造评价更完善,但对于此项用于NAC预测的研究较少,可行性尚不明确,今后需开展相关研究,进一步完善对于BC患者NAC预测的指标。
综上所述,CEUS联合EU对于BC患者NAC治疗效果预测的可行性较好,临床上可将上述两种检查纳入NAC效果评价中,以更准确选择及调整BC患者治疗方式,提升疗效,延长患者生存期。
