缺氧诱导的UCHL5 增强宫颈癌Hela 细胞辐射抗性
2021-05-27焦圣元高巧慧达飞郭利王晋郭娟李静刘军
焦圣元 高巧慧 达飞 郭利 王晋 郭娟 李静 刘军 叶
空军军医大学军事预防医学系辐射防护医学教研室,西安 710032
宫颈癌是在全球女性疾病中普遍存在的、发病率和致死率最高的癌症之一[1]。放疗适用于各期宫颈癌的治疗,是局部晚期宫颈癌不可替代的治疗手段,而辐射抗性是导致宫颈癌放疗后局部复发和远处转移的重要原因。
缺氧导致的肿瘤辐射抗性是影响放疗疗效的重要因素,缺氧诱导因子α 家族(hypoxia-inducible factor-α family,HIFs)在其中发挥着关键作用。缺氧作为应激源可以调节去泛素化酶(deubiquitinase,DUB),泛素羧基末端水解酶L5(ubiquitin carboxylterminal hydrolase isozyme L5,UCHL5)是DUB 泛素羧基末端水解酶家族成员,它可影响肿瘤细胞的DNA 损伤修复[2]、周期调控[3]、凋亡[4]和增殖等生物进程。本研究旨在观察缺氧对宫颈癌Hela 细胞UCHL5 表达的影响,进一步探讨UCHL5 对宫颈癌Hela 细胞辐射敏感性的作用。
1 材料与方法
1.1 细胞系
人宫颈癌Hela 细胞和人肾上皮293T 细胞购自中国科学院上海细胞生物研究所。
1.2 试剂及仪器
高糖DMEM 培养基、胰蛋白酶、二甲基亚砜(DMSO)、P8340 蛋白酶抑制剂Cocktail 和牛血清白蛋白均购自美国Sigma 公司;胎牛血清购自杭州四季青生物工程材料有限公司;嘌呤霉素(Puromycin)购自美国Gibco 公司;MTT 购自上海索莱宝生物科技有限公司;11668-019 lipofectamine 2000、31985-062 Opti-MEM 和10296010 TRIzol™均购自美国Invitrogen 公司;Dual-Luciferase®Reporter Assay System E1910 报告基因检测系统购自美国Promega 公司。过表达UCHL5 组、过表达对照组、沉默UCHL5 组、沉默对照组慢病毒载体和聚凝胺(polybrene)均由上海吉凯基因化学技术有限公司构建;mRNA 提取试剂盒和Taqman mRNA 试剂盒均购自天根生化科技(北京)有限公司;G4507姬姆萨染液购自德国Merck 公司;559763 PE Annexin V 凋亡检测试剂盒购自美国BD 公司;RIPA 细胞裂解液购自中国(北京)Solarbio 公司;BCA 蛋白检测试剂盒购自中国碧云天公司;增强的化学发光(ECL)试剂和聚偏氟乙烯膜(PVDF)均购自美国Millipore 公司;抗UCHL5 抗体、抗缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)抗体均购自美国Abcam 公司;抗β-actin 抗体、抗Bcl-2 抗体和抗兔HRP 标记的二抗均购自美国Cell Signaling Technology 公司;其他试剂均为国产分析纯。60Co 辐照源由空军军医大学辐照中心提供,辐照剂量率为1 Gy/min;CytoFLEX 流式细胞分析仪购自美国Beckman Coulter 公司。
1.3 细胞培养及乏氧处理
常氧培养:将Hela 细胞置于高糖DMEM 培养基中(含10% 胎牛血清),在37℃、5% CO2培养箱中培养。乏氧培养:将Hela 细胞置于37℃、1%O2、5% CO2、94% N2中,分别培养0、1、2、4、6、8、24 h 后提取细胞总蛋白。
1.4 慢病毒载体构建及感染Hela 细胞
慢病毒载体委托上海吉凯基因化学技术有限公司构建。转录本分为空白对照组、过表达对照组、过表达 UCHL5 组转录本 1~4 和沉默对照组、沉默UCHL5 组转录本 1~2。将处于对数生长期的Hela细胞用0.25%的胰蛋白酶消化后计数,将密度为4×104个/mL 的细胞接种于6 孔培养板中,37℃培养过夜。培养至细胞融合度为70%~80%时,根据病毒感染复数值计算病毒和聚凝胺浓度,然后将其加入至细胞培养基中,感染12 h 后,更换新鲜培养液,继续培养48 h 后,更换含2 μg/mL 嘌呤霉素的DMEM 完全培养基,筛选细胞1 周。
1.5 实时定量PCR
使用TRIzol™和mRNA 提取试剂盒提取细胞总RNA,实时定量PCR 检测UCHL5 mRNA 的表达。引物由杨凌天润奥科生物科技有限公司合成,具体如下。UCHL5 正向:GAGTGGTGCCTCATGG AAAG,反向:CAAGTCGAGTCCTGAACC;β-actin正向:CCTGGGCATGGAGTCCTGTG,反向:TCTT CATTGTGCTGGGTGCC。PCR 反应条件:50℃、2 min,95℃、10 min,95℃、15 s,60℃、1 min,共40 个循环;使用循环阈值量化对照组和实验组细胞的UCHL5 mRNA 水平。采用2−△△CT方法比较对照组和实验组的差异,β 肌动蛋白(β-actin)作为内参基因。
1.6 平板克隆形成实验
实验分组为过表达对照组、过表达UCHL5 组、沉默对照组和沉默UCHL5 组。取处于对数生长期的Hela 细胞,分别以100、100、200、400 个/孔接种于6 孔培养板中,24 h 后分别接受单次0、2、4、6 Gy γ 射线照射,培养2 周后弃去培养基,加甲醇固定15 min,姬姆萨染色20 min,计数50 个细胞以上的克隆并计算克隆形成率。克隆形成率=(克隆形成数/铺板细胞数)×100%。
1.7 MTT 实验
取处于对数生长期的过表达和沉默UCHL5 细胞及其各自对照组细胞,分别以1000 个/孔的数量接种于96 孔培养板中,设置5 个复孔;分别给予0、2、4、6、8、10 Gy γ 射线照射,于0、3、5、7 d 后每孔加入20 μL 5 g/L 的MTT,37℃培养4 h后吸去培养基,加入150 μL 二甲基亚砜,置于摇床上室温避光震荡10 min,使其充分溶解,酶标仪检测490 nm 处的吸光度(optical density,OD)值。细胞增殖率=(实验组OD 值−空白对照组OD 值)/(对照组OD 值−空白对照组OD 值)×100%。
1.8 流式细胞术检测细胞凋亡
分别取处于对数生长期的过表达UCHL5 组、过表达对照组、沉默UCHL5 组和沉默对照组细胞,以5×105个/孔接种于6 孔培养板;分别给予0 Gy和8 Gy γ 射线照射48 h 后,以1000 r/min 离心10 min(离心半径为7 cm)后,收集样本,用PBS洗2 次,加入559763 PE Annexin V 凋亡检测试剂盒里的Binding Buffer 和Annexin V-PE 混匀后,避光反应20 min,检测前5 min 再加入7-氨基放线菌素D(7-AAD),用流式细胞仪检测细胞凋亡情况。
1.9 双荧光素酶报告基因分析
JASPAR 靶基因预测数据库(http://jaspar.genereg.net)检测结果发现,HIF-1α 在UCHL5 的启动子区存在互补结合位点。为进一步验证HIF-1α和UCHL5 之间的靶向关系,构建了野生型(pGL4.10-UCHL5 Promoter Wt)和突变型(pGL4.10-UCHL5 Promoter Mut)UCHL5 荧光素酶重组质粒,将野生型UCHL5(UCHL5Wt)质粒和突变型UCHL5(UCHL5Mut)质粒分别与过表达HIF-1α 对照组及过表达HIF-1α 组的质粒共转染人肾上皮293T 细胞48 h 后,采用Dual-Luciferase®报告基因检测系统检测各处理组293T 细胞的双荧光素酶活性。
1.10 Western blot
用RIPA 细胞裂解液从Hela 细胞中提取蛋白质,并添加P8340 蛋白酶抑制剂Cocktail 进行Western blot 分析。随后在4℃下以13 500 r/min离心15 min(离心半径为5 cm),收集上清液,并用BCA 蛋白检测试剂盒进行定量。采用聚丙烯酰胺凝胶电泳(SDS-PAGE)(10%凝胶)分离蛋白质样品(20 μg)。将蛋白质转移至聚偏氟乙烯膜上,并在室温下用5% 牛血清白蛋白封闭2 h。温育后,使用抗UCHL5 抗体、抗HIF-1α 抗体、抗β-actin抗体、抗Bcl-2 抗体在PBS 中于4℃过夜孵育。将该膜与抗兔HRP 标记的二抗在室温下孵育2 h(稀释比例为1∶1000)。采用增强的化学发光试剂进行显影,通过Quantity one 软件系统拍照获得免疫印迹带。
1.11 宫颈癌组织芯片数据收集及分析
从癌症基因组图谱(官方网站https://portal.gdc.cancer.gov)中获得了宫颈癌和正常组织的基因表达数据,其中包括306 个宫颈癌组织和13 个宫颈正常组织。使用基因表达谱数据动态分析(官方网站http://gepia.cancer-pku.cn)进行基因相关性分析。
1.12 统计学分析
采用SPSS 24.0 软件进行统计学分析。数据均符合正态分布、方差齐性检验后,组间差异比较采用单样本t检验;采用Pearson 检验进行相关性分析。P<0.05 为差异有统计学意义。
2 结果
2.1 缺氧对宫颈癌Hela 细胞UCHL5 表达的影响
宫颈癌Hela 细胞在缺氧条件下分别培养0、1、2、4、6、8、24 h 后,观察发现UCHL5 的表达水平出现上调,且在8 h 时最明显(图1),这说明缺氧可诱导其表达。HIF-1α 表达的改变趋势与UCHL5 一致。
2.2 Western blot 和实时定量PCR 的结果
Western blot 和实时定量PCR 结果显示,慢病毒载体感染Hela 细胞后可显著上调或下调UCHL5的表达。其中,过表达UCHL5 组转录本2 和沉默UCHL5 组转录本2 的调控效率在蛋白和RNA 水平上均较高(图2),所以选择此2 种转录本进行后续实验。
2.3 UCHL5 过表达对宫颈癌Hela 细胞辐射抗性的影响
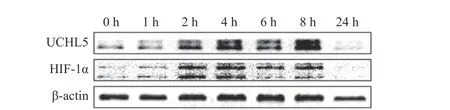
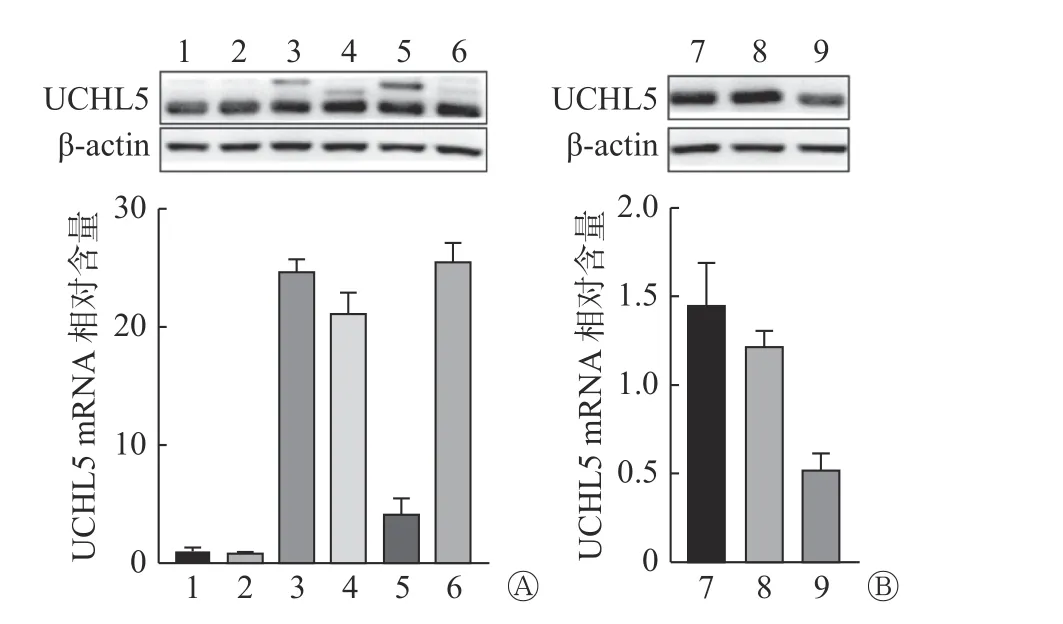
图3 的细胞克隆形成实验结果显示,与对照组(0 Gy)相比,分别给予2、4、6 Gy γ 射线照射后,Hela 细胞的克隆形成数目呈剂量依赖性减少(均P<0.05)。与过表达对照组相比,等剂量照射+过表达UCHL5 组的细胞克隆形成率均增加,且差异有统计学意义(均P<0.05,图3A);与沉默对照组相比,等剂量照射+沉默UCHL5 组的细胞克隆形成率均降低,且差异有统计学意义(均P<0.05,图3B)。
2.4 UCHL5 的表达对宫颈癌Hela 细胞凋亡的影响
图4 的流式细胞术检测结果显示,与沉默对照组相比,沉默UCHL5 组的细胞凋亡率明显增加(P<0.05);与过表达对照组相比,过表达UCHL5组的细胞凋亡无明显变化,可能的原因是UCHL5在宫颈癌Hela 细胞中表达的本底值较高,上调UCHL5 表达后产生的效应不明显。以上结果表明,UCHL5 低表达可促进宫颈癌Hela 细胞的凋亡。
2.5 UCHL5 低表达联合γ 射线照射对宫颈癌Hela细胞凋亡的影响


由图5 可见,与沉默对照+照射组相比,沉默UCHL5+照射组宫颈癌Hela 细胞的凋亡率明显增加,且差异有统计学意义(P<0.05);与过表达对照+照射组相比,过表达UCHL5+照射组宫颈癌Hela 细胞的凋亡率下降,但差异无统计学意义(t=1.15,P>0.05)。这说明低表达UCHL5 可以促进辐射诱导的细胞凋亡。
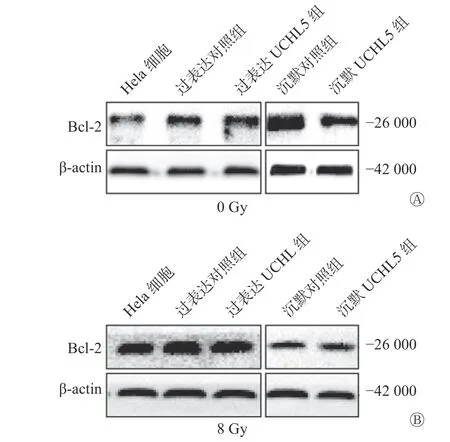
2.6 UCHL5 对Bcl-2 表达的影响
Western blot 结果显示,过表达UCHL5 组的Hela 细胞中Bcl-2 表达水平上升,沉默UCHL5组的Bcl-2 表达水平下降(图6A)。8 Gy γ 射线照射后48 h,过表达UCHL5 组的Bcl-2 表达水平相对于过表达对照组上升,沉默UCHL5 组的Bcl-2表达水平相对于沉默对照组的变化不明显(图6B)。这说明UCHL5 促进宫颈癌Hela 细胞凋亡的发生可以通过促进抑制凋亡相关分子Bcl-2 的表达水平而发挥作用。
2.7 UCHL5 的低表达对宫颈癌Hela 细胞增殖的影响
图7 的MTT 实验结果显示,与过表达对照组相比,过表达UCHL5 组的Hela 细胞增殖率较高,增殖率只有在第3 天时的差异有统计学意义(P<0.05),这可能与UCHL5 在Hela 细胞中的表达的本底值较高有关;沉默UCHL5 组的Hela 细胞增殖率随着照射时间的延长均较沉默对照组降低,且差异有统计学意义(均P<0.05)。与单纯照射组相比,给予不同剂量γ 射线照射后,细胞的活力均呈剂量依赖性下降,过表达UCHL5 组的Hela 细胞的增殖率高于过表达对照组,且差异有统计学意义(均P<0.05);相反,沉默UCHL5 组的细胞增殖率降低,且差异有统计学意义(均P<0.05)(图7),这表明降低UCHL5 的表达可抑制Hela 细胞的增殖。
2.8 HIF-1α 对UCHL5 启动子活性的影响
基因表达谱数据动态分析癌症基因组图谱数据显示,宫颈癌组织中HIF-1α 的表达水平和UCHL5的表达水平呈正相关(P<0.01,图8A)。图8B 的双荧光素酶报告基因结果表明,过表达HIF-1α 可促进UCHL5 启动子3′UTR(非翻译区)的荧光素酶活性,与UCHL5Wt+过表达HIF-1α 对照组相比,UCHL5Wt+过表达HIF-1α 组的活性增加了2.5 倍,且差异有统计学意义(P<0.05),这说明HIF-1α可通过该结合位点调控UCHL5 启动子的活性;而在结合位点突变后,UCHL5Mut+过表达HIF-1α 组的活性高于UCHL5Mut+过表达HIF-1α 对照组,且差异有统计学意义(P<0.05),这说明HIF-1α 对UCHL5 突变型的荧光素酶表达仍具有部分激活作用。以上结果表明,除突变的结合位点外,可能还存在其他非典型的结合位点。


3 讨论
宫颈癌是全球女性中第四大最常见的癌症,由于发展中国家宫颈癌的筛查普及率较低,大多数患者就诊时病情已进展至晚期或预后不良阶段[5]。目前,放疗仍是不可替代的治疗局部晚期宫颈癌的方法。随着科学技术的发展,放疗靶点的精确性不断提高[6]。但是,根治性放疗后宫颈癌患者的淋巴结复发率仍然高达10%~20%[7]。所以,辐射抗性细胞的存在仍是影响宫颈癌放疗疗效的重要因素。
实体瘤中普遍存在缺氧情况[8]。缺氧是影响肿瘤发生发展和治疗耐受性的重要原因。对于某些癌症,例如头颈鳞状细胞癌,缺氧是导致局部放疗失败的主要因素[9-10]。Gray 等[11]首次发现,经高压氧处理后,荷瘤小鼠对辐射的敏感性显著增加,在氧合良好的条件下照射时,肿瘤细胞对X 射线的灵敏度是缺氧条件下的3 倍。我们课题组的前期研究结果表明,对Hela 细胞进行缺氧预处理可以增强细胞的辐射抵抗能力,氧增强比为2.31±0.36[12]。

UCHL5 在多种肿瘤中的表达上调,包括胃癌[13]、乳腺癌[14]、卵巢癌[15]、肝癌[16]、食管癌[17]以及宫颈癌[18],且提示预后不良。有研究报道,DUB 在肿瘤辐射敏感性调节中发挥着重要作用:泛素特异性蛋白酶(ubiquitin-specific protease,USP)28 通过稳定c-Myc/HIF-1α 通路可以增强食管癌细胞的辐射抗性[19];卵巢肿瘤结构域蛋白4 通过促进ATM(毛细血管扩张突变基因)/Chk2(细胞周期检测点激酶2)/p53 信号通路和同源重组修复DNA 双链损伤,增强非小细胞肺癌细胞的辐射抗性[20];USP38与组蛋白去乙酰化酶直接相互作用,稳定表达,促进组蛋白去乙酰化酶对组蛋白H3 第56 位氨基酸的乙酰化修饰,增强了非同源末端的连接效率,促进了肿瘤细胞的辐射抗性[21]。目前,关于UCHL5对肿瘤辐射敏感性影响的研究未见报道。缺氧作为应激源可以调节DUB,比如缺氧时,肺癌A549细胞的USP28 表达下调[22];USP46 在缺氧条件下的表达下调,导致结肠癌中肿瘤抑制因子PHLPP丝氨酸/苏氨酸蛋白磷酸酶的降解,使得多种结肠癌细胞系的化疗耐药性增加[23];在缺氧条件下,USP47 去泛素化β 链蛋白也被诱导表达,进而增强直肠癌细胞上皮间质转化[24-25]。本研究结果显示,缺氧诱导宫颈癌Hela 细胞UCHL5 的表达,提示该基因产物可能是缺氧影响宫颈癌肿瘤辐射敏感性的重要因子。此外,低表达UCHL5 降低了Hela 细胞的增殖能力,增加了细胞的辐射敏感性,促进了Hela 细胞的凋亡以及γ 射线诱导的凋亡。这表明UCHL5 可以促进宫颈癌的辐射抗性,并且通过促进细胞增殖和抑制细胞凋亡发挥作用。有研究报道,HIFs 直接参与缺氧介导的UCHL1过表达,HIF-1α 和HIF-2α 可以结合UCHL1 启动子中潜在的缺氧反应元件(HRE)位点,导致UCHL1 的转录增加,从而促进缺氧诱导的神经元损伤细胞的凋亡[26]。但是,HIF-1α 对UCHL5 的调控作用尚未见报道,本研究结果显示,宫颈癌组织中HIF-1α 的表达与UCHL5 有关,在非氧气依赖的条件下,HIF-1α 对UCHL5 的转录有激活作用,这表明UCHL5 在缺氧条件下表达水平升高可能是通过HIF-1α 转录激活的方式实现的。
近年来,DUB 成为热门的癌症治疗靶标,如果简单地认为促进低氧性癌症中HIF-α 的降解是有益的,那么使用DUB 抑制剂拮抗E3 泛素连接酶对HIF-α 的降解将具有重要的临床意义。然而,连接酶E3 和DUB 也受缺氧的调节,使得这一作用机制变得复杂。此外,DUB 的作用不仅限于缺氧信号传导,还存在于其他信号传导途径,如DNA损伤修复、细胞周期调控等。所以,UCHL5 在HIF 信号通路之内或之外以及两者之间的联系需要进一步探索。
综上所述,本研究证实了缺氧诱导宫颈癌Hela细胞UCHL5 的表达;过表达UCHL5 能增强细胞的增殖能力,抑制细胞凋亡,增强细胞的辐射抗性。在生物机制上,缺氧诱导的HIF-1α 可以激活UCHL5 转录。因此,靶向缺氧诱导的UCHL5 的特异性抑制剂可能成为一种潜在的放疗增敏剂,但缺氧诱导UCHL5 的表达进而影响宫颈癌辐射敏感性的机制还需深入研究。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明焦圣元、高巧慧负责实验数据的整理分析、实验的实施和论文的撰写;达飞、郭利协助实验实施;王晋、郭娟、李静参与实验的设计;刘军叶负责指导课题的设计和论文的审阅。
