响应面优化海风藤多糖提取工艺及其抗氧化活性研究
2021-05-26毛月东金青
毛月东 金青

摘要:利用超声辅助法提取海风藤多糖,通过沙维积(Sevag)法分离、纯化海风藤多糖;以单因素试验结果为基础,采用响应面法对海风藤多糖的提取工艺进行优化,采用自由基体外清除试验对海风藤多糖体外抗氧化性进行探讨。得出最佳超声提取条件为提取时间50 min,液料比30 mL ∶1 g,提取温度60 ℃,提取功率420 W;此条件下测得多糖平均得率为6.97%,相对偏差较小,该提取条件稳定可靠。体外抗氧化试验表明,海风藤多糖质量浓度为 800 μg/mL 时,1,1-二苯基-2-苦基肼(DPPH)自由基与2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基清除率分别为81.20%、55.35%,表明海风藤多糖具有较好的抗氧化作用。
关键词:海风藤;多糖;响应面法;超声提取;抗氧化
中图分类号: R284.2文献标志码: A
文章编号:1002-1302(2021)08-0171-06
收稿日期:2020-07-21
作者简介:毛月东( 1994—),女,山东菏泽人,硕士研究生,主要从事天然产物研究。E-mail:mao17866859787@163.com。
通信作者:金 青,硕士,副教授,硕士生导师,主要从事天然产物研究。E-mail:17854296528@163.com。
海风藤是一种药用藤本植物风藤的干燥藤茎,味辛、苦,性微温,能够抗炎镇痛、祛风祛湿、通经活络、抑制血小板活化因子,保护局部缺血组织等[1-2]。多糖是海风藤的主要成分之一,多糖具有显著的生物活性,在免疫调节、组织保护等生理过程中发挥着重要作用[3],被广泛应用于各种保健产品和药物中。
自由基是人体进行正常生理活动时产生的,氧化性较强,人体内自由基浓度较大时,就会损伤正常细胞和组织,引发一系列疾病,使人体衰老加快[4-5]。植物多糖具有抗氧化、抗衰老、抗肿瘤、免疫调节等作用[6-7],对体内自由基有清除作用。本研究旨在通过响应面法确定海风藤多糖的最优提取工艺,通过自由基清除试验研究海风藤多糖的抗氧化活性,以期为海风藤多糖的药用价值和经济价值的开发提供理论基础[8]。
1 材料与方法
1.1 试验材料
海风藤:闽产海风藤(2019年9月购于青岛市李沧区同仁堂);葡萄糖标准品(四川维克奇生物科技有限公司);1,1-二苯基-2-苦基肼(DPPH)、2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、维生素C、过硫酸钾、苯酚、浓硫酸、双氧水、无水乙醇、丙酮、三氯甲烷、正丁醇(以上试剂均为分析纯)。
1.2 主要仪器
UV-6000 紫外可见分光光度计(上海元析仪器有限公司);H-100S 超声波清洗机(繁花科技有限公司);DZF真空干燥箱(上海坤天实验室仪器有限公司)。
1.3 试验方法
1.3.1 海风藤多糖的制备
海风藤烘干、粉碎、过筛,超声加热水提,减压过滤、浓缩,使用活性炭进行脱色,沙维积(Sevag)法脱蛋白,加入95%乙醇,置于冰箱4 ℃沉淀过夜,离心弃去上清液,将沉淀进行真空干燥,得到海风藤多糖。
1.3.2 葡萄糖标准曲线绘制
多糖含量的测定方法使用苯酚-硫酸法,将葡萄糖标准品干燥至恒质量,精确称取100 mg,蒸馏水溶解,定容至100 mL,稀释得到0.1 mg/mL的葡萄糖标准溶液(2019年9月配制,保存于青岛科技大学天然药物化学研究室)。使用0.1 mg/mL的葡萄糖标准溶液配制浓度为0.01、0.02、0.04、0.06、0.08、0.10 mg/mL的系列葡萄糖标准溶液,各取1 mL置于容量瓶中,加入5%苯酚1.5 mL,混匀,迅速滴加浓硫酸5 mL,充分混匀,50 ℃保温30 min;流水冷却至室温,使用蒸馏水作为空白,490 nm测定吸光度,得到葡萄糖质量浓度与吸光度的回归方程y=7.043 8x+0.072 1,r2=0.999 3。葡萄糖标准品在0.01~0.1 mg/mL浓度范围内呈良好的线性关系[9]。
1.3.3 海风藤多糖含量测定
称取适量海风藤粉末,按“1.3.1”方法制备海风藤多糖溶液,按“1.3.2”方法对样品溶液进行测定,依据样品溶液吸光度计算多糖含量,根据下式计算海风藤多糖得率,计算公式如下:
海风藤多糖得率=C×V/m×100%。
式中:C为海风藤溶液多糖浓度(mg/mL);m为海风藤样品质量(mg);V为提取液体积(mL)。
1.3.4 单因素试验
分别设置不同超声时间、温度、功率以及液料比,探究其对海风藤多糖得率的影响。
1.3.5 响应面优化试验
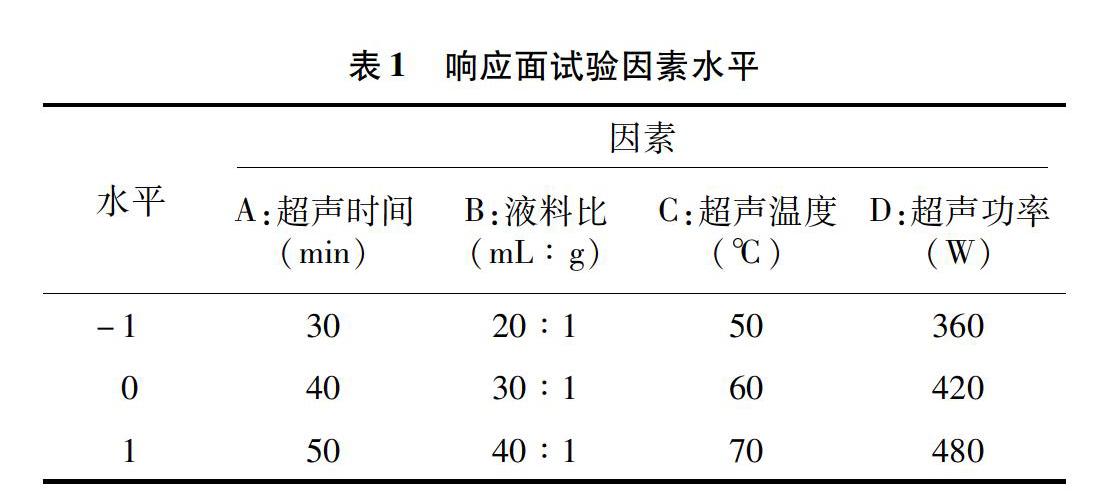
以单因素试验结果为基础,设定海风藤多糖得率为因变量,设置超声时间(A)、液料比(B)、超声温度(C)、超声功率(D)4个因素为响应面自变量,采用四因素三水平中心组合响应面法对海风藤多糖提取工艺进行优化(表1)。
1.3.6 海风藤多糖纯化
取制备的海风藤多糖提取液,使用活性炭脱色,Sevag法脱蛋白,加入5倍量95%乙醇,4 ℃冰箱中静置过夜,将脱蛋白溶液离心,弃去上清液,将下层沉淀进行减压干燥,得粗多糖,计算纯化后多糖得率[10]。计算方法如下式:
纯化海风藤多糖得率=纯化后海风藤多糖质量/海风藤样品质量×100%。
1.3.7 海风藤多糖抗氧化性研究
1.3.7.1 DPPH自由基清除试验
称取适量海风藤多糖,配制不同浓度的海风藤多糖溶液和 0.2 mmol/L DPPH 95%乙醇溶液,取海风藤多糖溶液和DPPH溶液各2 mL,混匀后静置30 min,在 517 nm 測定吸光度D1,同样方法测定2 mL 95%乙醇和2 mL海风藤多糖溶液充分混匀后的吸光度为D2,2 mL DPPH 溶液与2 mL 蒸馏水混合后的吸光度为D0,同时用维生素C标准品作为对照[11-13]。
DPPH自由基清除率=[1-(D1-D2)/D0]×100%。
1.3.7.2 ABTS自由基清除试验
将7 mmol/L ABTS溶液与2.45 mmol/L的K2S2O8溶液混合(体积比1 ∶1),在室温条件下暗处反应12~16 h,得到ABTS储备液。ABTS储备液用70%乙醇稀释,直至在734 nm下测定的吸光度为0.7±0.02。精确量取1 mL样品溶液,加入3 mL ABTS溶液,充分混匀,室温下反应6 min,测定734 nm吸光度为D1′,同法以蒸馏水代替样品测定吸光度D0′,以溶剂代替样品溶液测定吸光度D2′,维生素C作为对照,平行3次测定[14-15]。
ABTS自由基清除率=[1-(D1′-D2′)/D0′]×100%。
2 結果与分析
2.1 单因素试验结果
2.1.1 超声时间对海风藤多糖得率影响
准确称取海风藤粉末2.00 g,加入30倍量蒸馏水,设置超声温度60 ℃,超声功率480 W,超声时间分别为10、20、30、40、50 min进行试验,每组处理3个重复。如图1所示,海风藤多糖得率随超声时间的增加呈现先增加再减小的趋势,当超声时间为40 min 时海风藤多糖得率达到最大。其原因可能是当提取时间较短时,多糖不断从植物组织中释放出来,故随时间增加,多糖得率增加;但超声波对大分子具有机械效应,随着超声时间增长,超声波对多糖分子造成破坏,从而使海风藤多糖得率下降[16]。故提取时间为40 min时,海风藤多糖提取效果最佳。
2.1.2 液料比对多糖得率的影响
准确称取海风藤粉末2.00 g,设置超声温度60 ℃,超声时间 40 min,超声功率为480 W,液料比分别为 10mL ∶1 g、20 mL ∶1 g、30 mL ∶1 g、40 mL ∶1 g、50 mL ∶1 g进行海风藤多糖提取试验,每组处理3个重复。如图2所示,海风藤多糖得率随液料比的增加,呈现先增大后减小的趋势,在液料比为 30 mL ∶1 g 时达到最大。其原因可能是当溶剂含量较少时,溶液黏度较大,多糖分子不易扩散,得率较低。随溶剂量增加,溶液黏度降低,扩散快,得率高。液料比大于30 mL ∶1 g时,得率降低,可能是过多的溶剂会增加超声波破碎细胞的阻力,使细胞破碎程度下降,降低多糖的溶出量[17]。故液料比在 30 mL ∶1 g 时,海风藤多糖提取效果最佳。
2.1.3 温度对得率的影响
准确称取海风藤粉末2.00 g,设置液料比30 mL ∶1 g,超声时间为 40 min,超声功率为480 W,超声温度分别为40、50、60、70、80 ℃进行海风藤多糖提取试验,每组处理3个重复。如图3所示,海风藤多糖得率随温度增加先增大后减小,在提取温度为60 ℃时海风藤多糖得率达到最大。其原因可能是温度较低时,随着提取温度的升高,分子热运动加快,多糖得率亦随之增加,而温度达到60 ℃以上时,可能由于温度过高多糖结构被氧化破坏,造成海风藤多糖得率降低[18-19]。故温度在60 ℃时,海风藤多糖提取效果最佳。
2.1.4 超声功率对得率的影响
准确称取海风藤
粉末2.00 g,在液料比为30 mL ∶1 g,设置超声温度 60 ℃,超声时间40 min,超声功率分别为360、420、480、540、600 W进行海风藤多糖提取试验,每组处理3个重复。如图4所示,海风藤多糖得率随超声功率继续增大呈现出先增加后减小的趋势,在功率为420 W时海风藤多糖得率达到最大。其原因可能是超声功率增大,超声波的机械作用增强,对细胞的破碎作用增强,多糖得率增加。但随着超声功率增大,会加剧体系的空化作用,导致分子聚集并产生局部高温。多糖分子受高温影响容易失去活性并以沉淀形式析出,得率下降[20]。故超声功率在 420 W 时,海风藤多糖提取效果最佳。
2.2 响应面法优化海风藤多糖提取工艺
2.2.1 响应面试验设计方案及结果 采用响应面法对海风藤多糖提取工艺进行优化,不同工艺条件下海风藤多糖提取试验结果如表2所示。
2.2.2 响应面试验结果分析
根据回归系数,建立了响应面回归方程:海风藤多糖得率Y=6.92+0.29A+0.17B+0.16C+0.16D-0.018AB+0.12AC-0.012AD-0.22BC-0.29BD-0.22CD-0.20A2-0.61B2-0.48C2-0.56D2。
由表3中的数据可知,此模型R2=0.999 4,P<0.000 1,失拟项(0.051 0)>0.01,说明该模型具有较高的可靠性,拟合效果良好。对各项影响因子的偏回归系数进行检验分析结果表明:所选取的4个因素对多糖得率有极显著影响,按影响程度从大到小依次为时间(A)>液料比(B)>功率(D)>温度(C);交互因素AC、BC、BD、CD对多糖得率的影响极显著,这与李振等的研究结果[21]相符。
2.2.3 两因素交互作用响应面分析
当响应面图的坡度越陡峭,等高线越密集,等高线呈扁圆形时,两因素交互作用较显著[22]。由图5可知,图5-c~图5-f坡面陡峭,等高线密集,说明AC、BC、BD、CD交互作用对海风藤多糖得率影响较为显著,AB、AD交互作用对海风藤多糖得率影响次之。
综合回归模型的分析可知,海风藤多糖提取最优工艺参数:提取时间为47.71 min,液料比为 30.68 mL ∶1 g,提取温度为62.25 ℃,提取功率为 424.42 W,此条件下海风藤多糖得率的理论值为7.06%。为验证分析结果的可靠性,考虑到试验方案的可行性,设定海风藤多糖提取工艺参数:提取
时间为50 min,液料比为30 mL ∶1 g,提取温度为 60 ℃,提取功率为420 W,测得多糖平均得率为6.97%,相对标准偏差(RSD)=2.57%(n=5),相对偏差较小。因此该模型准确度较高,可用于海风藤多糖提取。
2.3 海风藤多糖纯化结果
按照“1.3.6”节的方法,对海风藤多糖提取液进行纯化,纯化后多糖得率为5.23%,纯化后得率降低,说明脱色脱蛋白过程会对多糖造成破坏,使得多糖含量降低。
2.4 海风藤多糖抗氧化活性研究
2.4.1 海风藤多糖清除DPPH自由基试验
由图6可知,随着维生素C与海风藤多糖浓度的不断提高,二者对DPPH自由基的清除率不断增高。维生素C质量浓度在10~100 μg/mL时,DPPH自由基的清除率明显提高,当维生素C浓度超出 200 μg/mL 時,DPPH自由基清除率增加趋势平缓。海风藤多糖浓度在10~400 μg/mL 时,DPPH自由基的清除率明显提高。当海风藤多糖浓度达到 800 μg/mL 时,二者对DPPH自由基的清除率分别是92.82%、81.20%。
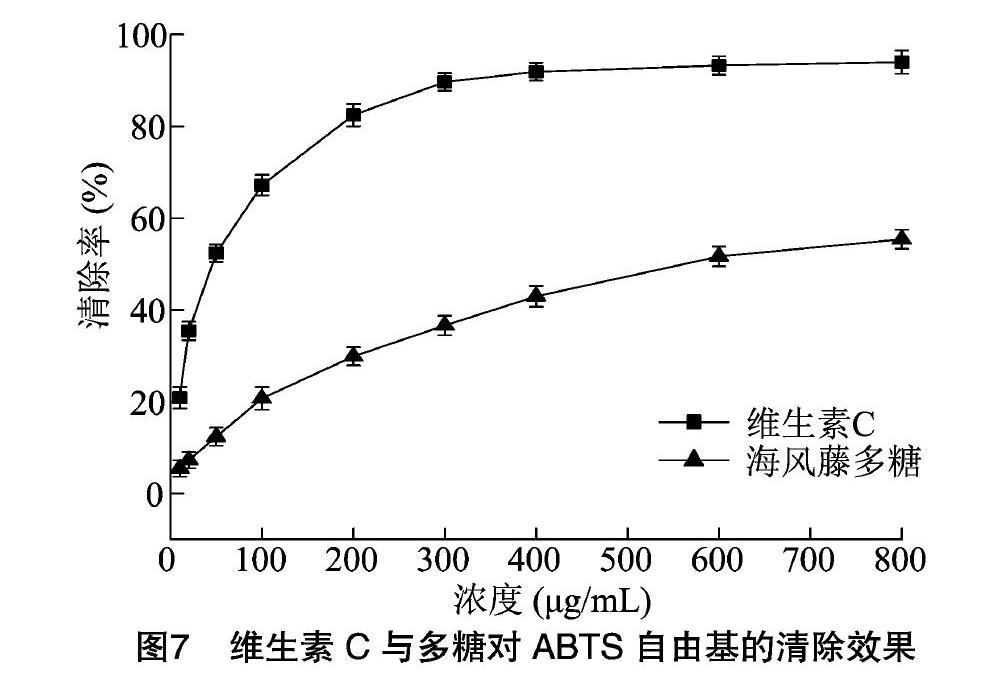
2.4.2 海风藤多糖清除ABTS自由基试验
由图7可知,随着维生素C与海风藤多糖浓度的不断提高,二者对ABTS自由基的清除率不断增高。维生素C质量浓度为10~200 μg/mL时,ABTS自由基的清除率明显提高,当维生素C浓度超过 400 μg/mL 时,ABTS自由基清除率增高较为平缓。海风藤多糖质量浓度在10~600 μg/mL,ABTS自由基的清除率明显提高。当浓度达到800 μg/mL时,维生素C、 海风藤多糖对ABTS自由基的清除率分别是93.94%、55.35%。
3 结论
本研究利用超声波辅助方法提取了海风藤中多糖。通过对单因素试验的结果的分析,利用响应面法得到海风藤多糖最优提取工艺条件:提取时间为50 min,液料比为30 mL ∶1 g,提取温度为60 ℃,提取功率为420 W,多糖平均得率为6.97%。随着海风藤多糖质量浓度的提高,对DPPH自由基与ABTS自由基清除效果也不断增强,当海风藤多糖质量浓度为800 μg/mL时,DPPH自由基与ABTS自由基清除率分别为81.20%、55.35%。由此说明海风藤多糖具有一定抗氧化性,为海风藤多糖开发利用提供理论依据。
参考文献:
[1]宋敬丽,袁 林,刘艳菊,等. 海风藤化学成分和药理作用的研究进展[J]. 湖北中医学院学报,2007,9(3):70-72.
[2]王贞佐,呼海涛,孟庆繁,等. 海风藤的研究进展[J]. 时珍国医国药,2006,17(7):1305-1307.
[3]Jiao R,Liu Y,Gao H,et al.The anti-oxidant and antitumor properties of plant polysaccharides[J]. American Journal of Chinese Medicine,2016,44(3):463-488.
[4]Pomatto L C D,Davies K J A. Adaptive homeostasis and the free radical theory of ageing[J]. Free Radical Biology and Medicine,2018,124:420‐430.
[5]Chen F,Huang G L,Yang Z Y,et al. Antioxidant activity of Momordica charantia polysaccharide and its derivatives[J]. International Journal of Biological Macromolecules,2019,138:673-680.
[6]梁永锋,李嘉会,曹江平. 杏花中多糖提取工艺及其抗氧化活性研究[J]. 江苏农业科学,2018,46(7):208-210.
[7]杨 玲,陈 阳,杨小生,等. 响应面法优化仙茅多糖酶解工艺及体外免疫活性[J]. 江苏农业科学,2020,48(8):229-237.
[8]董兰芳,张 琴,童 潼,等. 方格星虫多糖抗菌和抗氧化活性研究[J]. 广西科学,2013,20(4):289-293.
[9]张 胜. 普通油茶饼粕与果壳中多糖的提取、活性及应用研究[D]. 长沙:中南林业科技大学,2013:41-45.
[10]阿 荣.燕麦醪糟多糖的分离纯化、结构鉴定及其免疫活性的研究[D]. 呼和浩特:内蒙古农业大学,2019:30-37.
[11]王 瑶,吴茂玉,王兆升,等. 芦笋下脚料可溶性纤维的提取及其抗氧化性[J]. 食品工业,2020,41(2):81-85.
[12]周礼元. 金福菇多糖TLH-G的结构鉴定及其抗氧化活性研究[D]. 合肥:安徽大学,2017:26-35.
[13]葛云龙,赵修华,祖元刚,等. 压榨法制备牡丹籽油的α-亚麻酸含量检测与抗氧化研究[J]. 植物研究,2020,40(5):1-6.
[14]郭利芳,吴肖淮,颜 燕,等. 热处理条件下乳清蛋白抗氧化能力的研究[J]. 现代农业,2019(9):17-19.
[15]吴 娟,张立夏,袁 燕,等. 响应面法优化乌榄果总黄酮提取工艺及体外抗氧化活性研究[J]. 江苏农业科学,2018,46(10):190-194.
[16]Tian S Y,Hao C C,Xu G K,et al.Optimization conditionsfor extracting polysaccharide from Angelica sinensis and its antioxidant activities[J]. Journal of Food and Drug Analysis,2016,25(4):766-775.
[17]李 惠,熊忠飞,李喜宏. 响应面法优化芦笋多糖提取工艺及抗氧化性研究[J]. 中国调味品,2020,45(5):1-6,12.
[18]梁永锋. 桃花中黄酮含量的测定及超声波辅助下提取工艺优化[J]. 江苏农业科学,2016,44(9):329-331.
[19]陈 飞,何先元,周卯勤,等. 超声辅助提取四齿四棱草中总黄酮及其抗氧化活性[J]. 天然产物研究与开发,2016,28(1):96-101,70.
[20]李 珊,梁 俭,冯 彬,等. 响应面法优化超声波辅助提取山竹果皮多糖的工艺及其体外抗氧活性研究[J]. 食品研究与开发,2020,41(10):103-110.
[21]李 振,李 萍. 忍冬藤多糖的提取工艺优化及清除亚硝酸盐阻断亚硝胺合成的研究[J]. 现代食品科技,2019,35(4):130-139.
[22]罗春艳,方旭波,孙海燕,等. 南太平洋鱿鱼船上蒸煮加工工艺优化与品质特性[J]. 食品科学,2017,38(20):176-184.
