NLRP3炎症小体激活对水杨酸钠诱导大鼠耳蜗螺旋神经节细胞损伤的作用*
2021-05-22翟思佳尹时华侯涛任毅廖行伟黄巧李念燊
翟思佳 尹时华 侯涛 任毅 廖行伟 黄巧 李念燊
耳蜗螺旋神经节神经元(spiral ganglion neuron,SGN)作为初级听觉神经元,是外周听觉信号传递到中枢神经系统的重要枢纽。SGN是水杨酸钠(sodium salicylate,SS)首要作用的主要靶点[1]。SGN损伤与听力损失息息相关,在水杨酸钠诱导耳鸣的发病机制中占据重要地位。
最新研究发现神经炎症是水杨酸钠诱导听觉损伤的新机制[2],尽管已有研究证实水杨酸钠会导致耳蜗SGN细胞中多种炎症因子如肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-1(IL-1)上调[3-5],但其确切分子机制仍缺乏进一步研究。而过度免疫所激活的NLRP3炎症小体可能是SGN细胞中炎症因子上调的关键原因,NOD-like receptor(NLR)样受体NLRP3作为模式识别受体,可识别各种危险信号,帮助炎症小体组装,促使半胱氨酸天冬氨酸蛋白酶(caspase-1,CAPS-1)前体成熟并释放IL-1β、IL-18,间接促进TNF-α等炎症因子上调,加剧炎症反应,导致耳蜗内重要结构损伤[6]。目前已证实NLRP3炎症小体与老年性聋[7]、巨细胞病毒(CMV)感染诱发的感音神经性聋[8]和Mucklewell综合征[9](由NLRP3突变而引起其在SGN高表达)等多种听觉损害,以及阿尔兹海默病、帕金森病等神经退行性疾病[10]密切相关。
本研究旨在探讨NLRP3炎性小体激活在水杨酸钠诱导SGN损伤过程中的作用以及水杨酸钠诱导耳蜗炎症复合体激活的关键分子机制;并通过给予抑制NLRP3的预处理,观察其否可以减轻炎症因子的释放,减轻听觉系统损伤。
1 材料与方法
1.1主要试剂 人工外淋巴液(arfifical perilymph dluid,APL),配制方法(单位:mM):NaCl 137, KCl 5, CaCl22, NaH2PO41, Glucose 10, NaHCO312, MgCl21的溶液,pH 7.4±0.2;水杨酸钠购于sigma公司;MCC950购自selleck公司(S7809,500 μM);NLRP3抗体购自NOVUS公司(NBP2-12446SS,1∶500倍稀释);Caspase-1抗体购自Gene Tex公司(GTX123675,1∶100倍稀释);IL-1β抗体购自SAB公司(41059-1,1∶500倍稀释);二抗试剂盒购自北京中衫金桥公司;TRIZOL购自TaKaRa 公司;逆转录盒与荧光定量PCR试剂盒购于GeneCopoeia公司。
1.2实验动物分组及造模 选取64只耳廓反应灵敏、未暴露于噪声及耳毒性药物环境的健康雄性SD大鼠(250~300 g)(购自广西医科大学实验动物中心),均耳声发射检查通过,且听性脑干反应(ABR)阈值<40 dB SPL,随机分为4组,每组16只,对照(control)组:腹腔注射等量生理盐水;人工外淋巴液(APL)组:左耳圆窗注入APL100 μl,腹腔注射生理盐水;水杨酸钠(SS)组:左耳经圆窗注入APL,腹腔注射10%水杨酸钠(350 mg·kg-1·d-1);水杨酸钠+NLRP3抑制剂(SS+MCC950)组:左耳圆窗注入溶于APL的caspase抑制剂MCC950约100 μl后,腹腔注射水杨酸钠。各组均连续用药7 d。
圆窗给药方法:10%水合氯醛全身麻醉满意后,将大鼠置于固定板上,左耳后常规备皮、消毒、铺巾,利多卡因局部浸润麻醉,于耳后沟后2 mm做弧形切口约1 cm长,钝性分离软组织,暴露听泡,在解剖显微镜下于听泡后上方钻孔并暴露圆窗龛,以分别浸泡有人工外淋巴液、MCC950的明胶海绵置于圆窗膜表面,关闭术腔,逐层缝合软组织及皮肤,切口涂红霉素软膏,取左耳朝上侧卧位,待自然清醒。
1.3ABR检测 实验前及给药结束后,在处死动物之前,对各组大鼠进行ABR测试。麻醉满意后将大鼠置于隔声室,记录电极扎入额顶正中,参考电极接同侧耳廓,鼻尖接地。click短声刺激,刺激率21次/秒,带通滤波300~3 000 Hz,观察时程15 ms,叠加1 024次,刺激声强度从90 dB SPL开始以10 dB或者5 dB逐渐递减, 以能引出可分辨波Ⅱ的最小刺激强度为ABR反应阈,并重复检测2次。
1.4畸变产物耳声发射(DPOAE)检测 给药结束后,在处死动物之前,对各组大鼠进行DPOAE测试。麻醉后的大鼠置于隔声室,刺激声强度L1=65 dB SPL,L2=70 dB SPL,取2、3、4、6、8、10 kHz共6个频率点进行测试,记录各频率的DPOAE反应幅值。
1.5耳蜗取材及切片制备 各组完成ABR及DPOAE检测后,打开胸腔进行心脏灌注,待眼珠、四肢末端发白后快速断头,取出听泡后剥离出耳蜗,在解剖显微镜下于蜗尖处挑开小孔,用1 ml注射器由蜗顶灌注4%多聚甲醛固定液,再将标本置于4%多聚甲醛中,在4 ℃冰箱内固定48 h;随后将耳蜗置于10%EDTA溶液室温脱钙1个月,隔天更换一次脱钙液。乙醇梯度脱水、二甲苯透明、石蜡定向包埋后平行耳蜗纵轴连续切片,片厚4 μm。
1.6HE染色 耳蜗石蜡切片置于60 ℃烤箱30 min,将切片取出进行二甲苯脱蜡和梯度酒精水化;蒸馏水冲洗,苏木素染色1 min,水洗;蒸馏水浸泡1 min;1%盐酸酒精分化数秒,自来水返蓝30 min,伊红染色2 min;梯度酒精脱水,二甲苯透明,晾干封片,镜检。对形态异常的损伤细胞进行定量分析,在不同的视野下,对SGN区内每100个SGN细胞中形态异常细胞数进行5次计数,取平均数作为结果。
1.7RNA提取 待大鼠麻醉充分,快速断头,迅速取出双侧耳蜗,置入RNA保存液中,在解剖显微镜下剥离蜗壳,取出膜迷路组织,迅速放入已加入300 μl TRIZOL的1.5 ml EP管中,用玻璃研磨棒在EP管中快速研磨碎,另加入700 μl TRIZOL,冰上放置10 min。4 ℃,12 000 g,离心5 min,吸取上清液到另一无酶EP管中,加入200 μl氯仿,震荡15 s,冰上静置5 min。4 ℃、12 000 g,离心15 min,小心吸取上层清液入新的无酶EP管中,切勿吸取到中间层。因耳蜗组织中胶原含量高,本实验采用mRNA改良提取法:用200 μl异丙醇与200 μl高盐溶液(0.8 mol/L柠檬酸钠与1.2 mol/L NaCl的混合液)沉淀RNA,提高RNA纯度,颠倒混匀后冰上静置10 min;4 ℃ 12 000 g离心10 min,弃上清保留沉淀,加入75%乙醇1 ml洗涤沉淀。4 ℃ 12 000 g离心5 min,倒去乙醇,用小枪头吸取残留液体,室温晾干,然后将RNA溶于无酶水中,微量核酸蛋白检测仪测定RNA 浓度,OD260/OD280比值需在1.7~2.0之间,长期保存于-80 ℃冰箱。
1.8荧光定量PCR 取RNA 1 μg,按照逆转录试剂盒说明书合成cDNA,然后通过美国ABI公司的Stepone进行qRT-PCR。以1 μl cDNA为反应模板,按照荧光定量PCR试剂盒说明书配置反应体系进行反应。反应条件:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 32 s,总共40个循环。选取GPHAD作为内参对照,设3 个复孔,采用2-△△CT法进行数据分析。引物序列如下: GPHAD序列为F: 5'-AGTGCCAGCCTCGTCTCATA-3';R:5'-TGAACTTGCCGTGGGTAGAG3-3'。NLRP3序列为F: 5'-ATTACCCGCCCGAGAAAGG-3';R:5'-CATGAGTGTGGCTAGATCCAAG-3'。Caspase-1序列为F:5'-CCGAGTGGTTCCCTCAAGTT-3';R:5'-CAAGACGTGTACGAGTGGGT-3'。IL-1β序列为F: 5'-GAGTGTGGATCCCAAGCAAT-3';R:5'-CTCAGTGCAGGCTATGACCA-3'。以GPHAD为内参,计算2-△△CT作为目的基因 mRNA的相对表达量。
1.9免疫组化染色 耳蜗石蜡切片置于60 ℃烤箱30 min,然后常规脱蜡和梯度酒精水化,自来水冲洗;切片置于EDTA缓冲液放入高压锅高压碱修复4 min,室温冷却后PBS浸洗3次×5 min;将切片移入湿盒中加入阻断内源性过氧化物酶,室温孵育10 min,PBS洗3次;正常山羊血清封闭15 min,甩去封闭液,不洗。标本上滴加足量目的蛋白一抗4 ℃湿敷过夜;室温复温1 h,PBS冲洗3次×3 min;滴加增强酶标羊抗小鼠/兔IgG聚合物,室温孵育10 min,PBS冲洗3次×3 min;滴加辣根酶标记链霉卵白素,室温孵育10 min,PBS冲洗3次×3 min;DAB溶液显微镜下显色约5 min,蒸馏水充分冲洗,苏木素复染1 min,自来水冲洗,1%盐酸酒精分化数秒,自来水返蓝30 min,晾干,中性树脂封片、镜检。细胞膜和/或细胞质棕黄色颗粒者为阳性表达,无棕黄色颗粒者为阴性表达。每张切片在10×40视野下选取5个互不重叠的视野,采用Image-pro plus6.0图像分析软件测定单位面积阳性细胞表达的平均光密度值(average optical densities,AOD),取平均值作为结果。
2 结果
2.1各组ABR阈值比较 实验前大鼠的ABR平均反应阈为31.79±4.13 dB SPL,给药7天后,对照组、APL组、SS组、SS+MCC950组大鼠的ABR反应阈分别为32.5(26.25,35)、32.5(30,35)、50(45,55)、40(35,40)dB SPL。对照组和APL组反应阈与实验前比较差异无统计学意义(P>0.05),而给药7天后,SS组大鼠ABR反应阈较对照组和APL组均显著升高(P<0.001),说明造模成功,大剂量水杨酸钠对大鼠听觉系统造成了一定损伤。给药后,SS+MCC950组ABR反应阈较SS组降低(P<0.05),但较对照组与APL组仍有升高(P<0.01),差异有统计学意义P<0.05。
2.2各组DPOAE比较 造模7天后,在4、6、8 kHz频率,对照组与APL组DPOAE幅值无显著差异(P>0.05),而SS组大鼠DPOAP幅值较对照组及APL组显著下降(分别为P<0.001,P<0.05,P<0.001);SS+MCC950组3、4、8、10 kHz频率DPOAP幅值与SS组差异显著(均为P<0.001),与对照组与APL组无明显差异(P>0.05)(表1、2)。
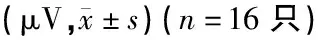
表1 各组大鼠给药后各频率DPOAE幅值
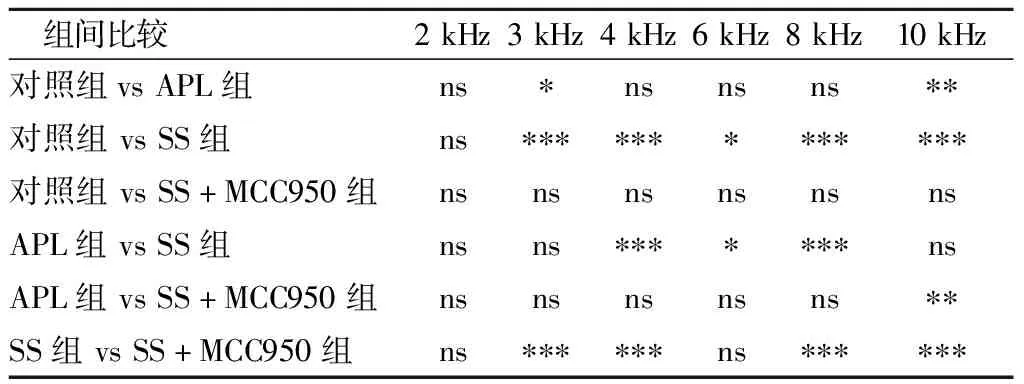
表2 组间各频率DPOAE幅值比较的P值
2.3HE染色观察给药后各组动物SGN损伤情况 对照组和APL组耳蜗结构正常;而SS组和SS+MCC950组则出现不同程度的耳蜗SGN细胞变形、移位、界限不清,部分溶解消失,胞体明显缩小,胞核染色质边集、核固缩、核溶解,具有细胞死亡特征(图1)。对照组、APL组、SS组及SS+MCC950组SGN形态异常的细胞计数分别为16.83±6.555、13.83±3.312、39.33±8.618、23±6.573个,可见,与对照组和APL组相比,SS组的SGN损伤更显著(P<0.001),SS+MCC950组SGN损伤较SS组明显改善(P<0.01),SS+MCC950组、对照组、APL组三组间的差异无统计学意义(P>0.05)。
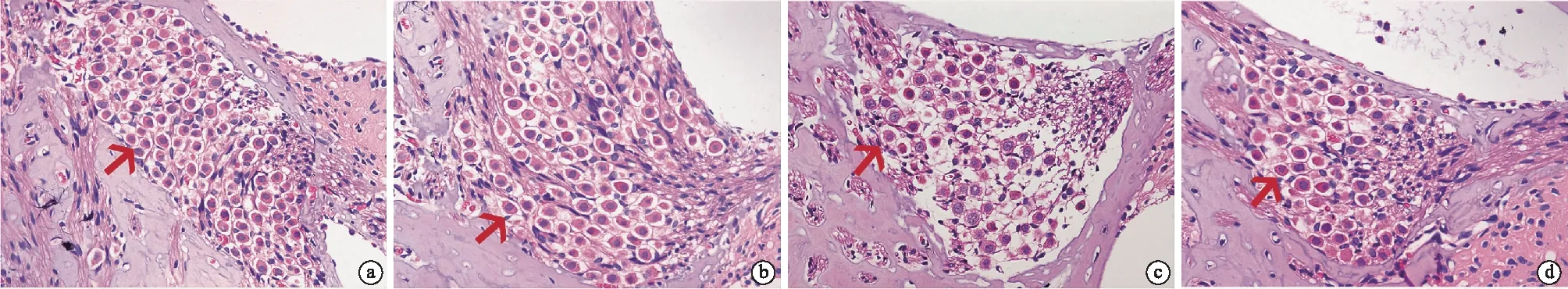
图1 给药后HE染色观察各组耳蜗损伤(×400) a.对照组; b.APL组; c.SS组; d.SS+MCC950组; 箭头所指为耳蜗SGN细胞
2.4荧光定量PCR检测结果 荧光定量反应曲线见图2,可见,NLRP3、Caspase-1和IL-1β的扩增曲线整齐均匀(图2a、b、c),溶解曲线均呈特异性单峰(图2d、e、f),表明扩增产物特异性良好,无二聚体及非特异性扩增。

图2 荧光定量PCR反应曲线 (a、b、c分别为NLRP3、Caspase-1、IL-1β的扩增曲线;d、e、f分别为NLRP3、Caspase-1、IL-1β的溶解曲线)
以GPHAD为内参,经过计算得到各组NLRP3、Caspase-1、IL-1β mRNA的表达量如表3所示,并进一步计算2-ΔΔCT作为目的基因mRNA的相对表达量,ΔCT值越大表达量越低。单因素方差分析示各组间NLRP3、Caspase-1、IL-1β mRNA的表达量有明显差异,均有统计学意义(表4)。三个炎症因子均在对照组中表达水平最低,在SS组表达强烈增加、SS+MCC950组的表达均较SS组降低。说明NLRP3是Caspase-1和IL-1β的上游调控基因,在水杨酸钠诱导听觉损伤的过程中存在NLRP3炎症小体信号转导通路。
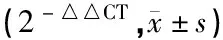
表3 各组 NLRP3、Caspase-1和IL-1β mRNA的表达量(n=8只)

表4 组间NLRP3、Caspase-1、IL-1β表达量比较的P值
2.5免疫组化染色结果 运用免疫组化技术检测各组螺旋神经节处NLRP3、Caspase-1、IL-1β蛋白表达情况,发现其主要表达于SGN细胞胞质中,三种蛋白均在对照组和APL组SGN区域弱阳性表达,SS组呈强阳性表达,SS+MCC950组中呈阳性表达(图3);各组平均光密度值见表5,单因素方差分析示SS组SGN内NLRP3、Caspase-1和IL-1β的表达显著增加,SS+MCC950组NLRP3、Caspase-1和IL-1β蛋白的表达较SS组降低,但SS+MCC950组Caspase-1和IL-1β的表达仍较对照组高,差异具有统计学意义(表6);该蛋白质表达水平与mRNA表达水平变化趋势一致。
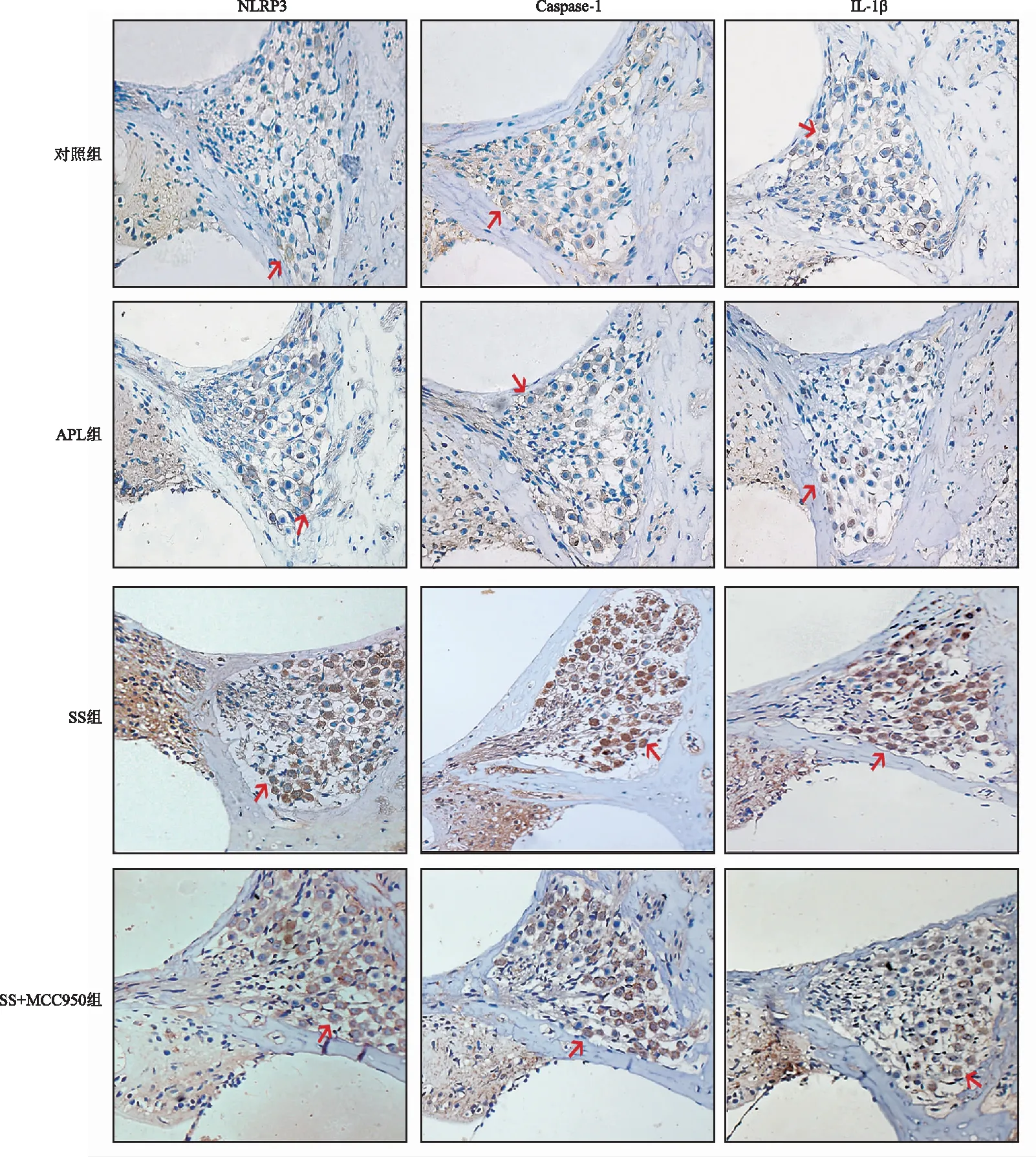
图3 各组免疫组化染色结果(×400) 红色箭头所示为SGN阳性细胞

表5 各组NLRP3、Caspase-1和IL-1β蛋白表达AOD值(n=8只)
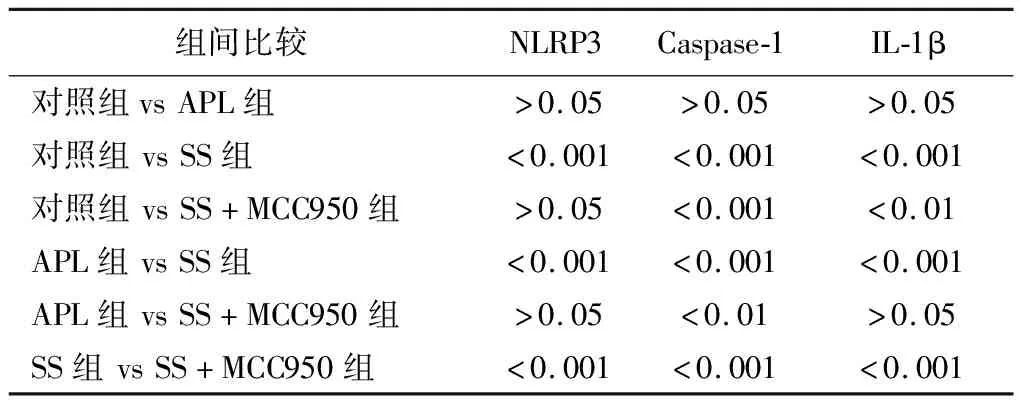
表6 组间NLRP3、Caspase-1、IL-1β AOD值组间比较的P值
3 讨论
内源性免疫炎症反应是机体的一把双刃剑[11],由于内耳自身具有很强的免疫能力,研究发现炎症小体的过度免疫反应在多种听觉损伤中起关键作用[7,8,12]。炎性小体的形成过程依赖于模式识别受体NLRP3,NLRP3炎症小体在收到 “危险”信号时被激活,借助ASC募集并剪切pro-caspase-1为有活性的caspase-1,促使下游的IL-1β和IL-18成熟并释放,并且诱导它们经由非经典分泌途径释放[13],从而引发细胞焦亡(pyroptosis)[14]。NLRP3炎症复合体及其下游因子IL-18、IL-1β还可进一步促进炎症因子如TNF-α和IL-6分泌,引起神经毒性,TNF-α和IL-6再通过结合TLRs 激活NF-κB 信号通路引发细胞凋亡、坏死,后者又能继续激活NLRP3炎症复合体[15],加剧最初的炎症反应,形成循环。
本研究结果显示大剂量水杨酸纳注射造成了大鼠听觉损伤,对照组和APL组中NLRP3 在SGN细胞内的表达量很低,SS组NLRP3、Caspase-1、IL-1β的mRNA转录水平在大鼠明显损伤的SGN区域显著升高,而通过抑制NLRP3炎性小体的活化后,SS+MCCP50组Caspase-1和IL-1β的转录表达减少,SGN的损伤减轻;各组SGN区域NLRP3、caspase-1、IL-1β表达差异变化与水杨酸钠诱导的耳蜗组织细胞损伤死亡情况基本一致,说明在动物模型听觉损伤过程中,水杨酸钠可能通过激活SGN听觉神经元细胞中的NLRP3炎症小体进而调节下游Caspase-1、IL-1β的转录表达,从而损伤听觉系统,引起听力下降。结合本研究结果,推测上述病理途径可能也与水杨酸钠诱导的听觉损伤有关,SS诱导的SGN损伤可能涉及NLRP3相关炎性小体信号传导途径,即NLRP3炎性小体的激活导致了下游的Caspase-1活化和下游IL-1β和IL-18等靶标的加工和释放,这些炎症因子的过量分泌最终导致听觉损伤。
NLRP3炎症小体信号通路可以引发细胞焦亡,细胞焦亡是一种伴随炎症反应的细胞程序性死亡方式,依赖于Gasdermin家族蛋白形成质膜膜孔的可调控的细胞死亡[16]。本研究结果显示SS组SGN细胞死亡率升高显著,而本课题组前期研究发现SS通过激活Caspase-3诱导豚鼠耳蜗SGN细胞凋亡,但经特异性Caspase-3抑制剂处理后细胞死亡率减少并不明显,提示可能有其他死亡途径存在[17]。另有研究发现停止长期水杨酸盐应用后14 天耳蜗核中TNF-α 和NR2B的表达水平恢复正常;而在急性注射水杨酸盐2 小时后IL-1β mRNA 升高,停止水杨酸盐14 天后仍未恢复正常[18];而IL-1β与细胞凋亡程序密切相关,因此推测NLRP3炎症小体激活引发的细胞焦亡程序可能也参与水杨酸钠诱导的SGN损伤机制。然而细胞死亡的类型并不由上游切割的蛋白酶决定,而是由下游的效应分子决定,因此是否确实有细胞焦亡参与SGN的损伤过程仍需后续研究证实。
抑制炎症小体的活化从而减轻由于持续的炎症状态而导致的听觉系统损伤或可提供一种新的治疗策略。NLRP3特异性的小分子抑制剂MCC950已被证明是体内和体外治疗炎症相关疾病的潜在方法[19]。本实验结果显示MCC950可抑制NLRP3和下游炎症因子的激活,对SS诱导的SGN损伤有明显的改善作用,故推测MCC950可能会抑制SS诱导耳蜗SGN炎症级联反应,从而在抗炎和促炎反应之间取得平衡。
综上所述,水杨酸钠诱导的SGN损伤与NLRP3炎性小体的持续活化密切相关,并可能发生细胞凋亡,NLRP3可能成为预防治疗SGN损伤的潜在药物靶标。
