Ang(1-7)通过调节Treg/Th17平衡参与保护NSAIDs相关小肠损伤
2021-05-18潘宜久王连魁
潘宜久 王连魁 熊 华,2#
宁波市杭州湾医院消化内科1(315336)上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所2
背景:非甾体抗炎药(NSAIDs)广泛应用于临床。随着内镜技术的进步,NSAIDs相关小肠损伤越来越多见,但目前尚无明确有效的防治措施。目的:探讨调节性T细胞(Treg细胞)与Th17细胞失衡在NSAIDs相关小肠损伤中的作用以及血管紧张素1-7 [Ang(1-7)]的保护效应。方法:30只雄性Sprague-Dawley大鼠随机分为对照组、模型组和Ang(1-7)治疗组,后两组使用双氯芬酸钠诱导小肠损伤模型。5 d后处死大鼠,取小肠黏膜观察大体和组织学损伤情况;以ELISA法和(或)免疫组化法检测Ang(1-7)以及促炎和抗炎细胞因子水平;流式细胞术分析Treg、Th17细胞占CD4+ T细胞的比例。结果:模型组大鼠小肠黏膜广泛充血、水肿,散在多发糜烂、小溃疡。Ang(1-7)治疗组小肠损伤明显减轻,黏膜轻度充血、水肿,散在少量小糜烂灶。治疗组小肠组织Ang(1-7)、抗炎细胞因子水平、Treg细胞数量和Treg/Th17比值较模型组显著升高,抗炎细胞因子水平和Th17细胞数量较模型组显著降低(P均<0.05)。Pearson相关系数分析显示,小肠黏膜Ang(1-7)含量与Treg/Th17比值呈显著正相关(r=0.847, P<0.05)。结论:Treg/Th17失衡可能是NSAIDs相关小肠损伤的重要发病机制,而Ang(1-7) 可能通过调节Treg/Th17平衡参与保护NSAIDs相关小肠损伤。
非甾体抗炎药(nonsteroidal antiinflammatory drugs, NSAIDs)具有抗炎、解热、镇痛等作用,广泛应用于临床。随着该类药物临床应用的增多,其消化道不良反应越来越受到人们的关注。NSAIDs相关胃肠道损伤可导致溃疡、出血、穿孔等并发症发生[1]。与胃十二指肠损伤不同,NSAIDs引起的小肠损伤症状多为非特异性甚至无症状[2],因小肠损伤住院治疗的患者多以出血、穿孔、梗阻等严重并发症为首发表现。目前对NSAIDs相关小肠损伤尚无明确有效的防治措施,因此,迫切需要进一步明确损伤发生机制,从而为其临床防治寻找新的策略。
血管紧张素1-7 [angiotensin 1-7, Ang(1-7)]是肾素-血管紧张素系统(renin-angiotensin system)的新组分,可发挥舒张血管、降低血压、增加局部血流量以及抗炎等作用。有研究[3]表明Ang(1-7)可显著减轻小鼠结肠炎模型的结肠炎症损伤,然而,关于Ang(1-7)对NSAIDs相关小肠损伤是否具有保护作用,目前尚无明确结论。调节性T细胞(Treg细胞)与Th17细胞是一对免疫平衡细胞,正常情况下两者处于动态平衡状态。近年来,多项研究发现Treg/Th17失衡在炎症和自身免疫性疾病的发生、发展中发挥重要作用[4-5],例如在三硝基苯磺酸(TNBS)实验性结肠炎模型小鼠肠道中存在以Treg/Th17失衡为主导的炎症反应。本研究通过构建双氯芬酸钠诱导的NSAIDs相关小肠损伤大鼠模型,探讨Treg/Th17失衡在NSAIDs相关小肠损伤中的作用以及Ang(1-7)的保护效应,以期为NSAIDs相关小肠损伤的防治提供潜在靶点。
材料与方法
一、实验动物和主要试剂
1. 实验动物:雄性Sprague-Dawley大鼠30只,8周龄,体质量(200±20) g,购自浙江中医药大学动物实验中心(合格证号:2008001664294),使用该中心提供的标准饲料喂养。动物饲养于独立通气笼盒中,每笼5只,清洁级环境(温度22~26 ℃,湿度50%~60%,适宜光照条件),自由进食、饮水,专人管理。
2. 主要试剂:双氯芬酸钠(Sigma-Aldrich®, Merck KGaA);Ang(1-7)(Tocris Bioscience);Ang(1-7)、白细胞介素-6(IL-6)、IL-17A、IL-10、转化生长因子-β1(TGF-β1)ELISA试剂盒(杭州联科生物技术股份有限公司);Ang(1-7)兔抗鼠多克隆抗体(Cloud-Clone Corp.);大鼠CD4 FITC、CD25 APC、CD4 APC、IL-17A PE单克隆抗体,小鼠/大鼠Foxp3 PE单克隆抗体,大鼠IgG2a κ PE同型对照,小鼠IgG2a κ APC同型对照(eBioscienceTM, Thermo Fisher Scientific)。
二、方法
1. 动物分组和模型制备:采用随机数字表法将30只大鼠分为3组:对照组、模型组和Ang(1-7)治疗组,每组10只。参考Cooper等[6]的方法使用双氯芬酸钠制备小肠损伤模型。将100 mg双氯芬酸钠溶于100 mL 0.9% NaCl溶液中,配制l mg/mL溶液,按10 mg·kg-1·d-1的剂量予大鼠连续灌胃5 d。Ang(1-7)治疗组药物剂量参考Tesanovic等[7]的研究,将 9.6 mg Ang(1-7)溶于1 mL灭菌水中,配制成9.6 μg/μL溶液,分别注入10只100 μL胶囊微泵中,于双氯芬酸钠灌胃造模前1 d将胶囊植入大鼠颈背部皮下,以24 μg·kg-1·h-1的速度持续皮下微泵给药至造模结束。对照组予10 mL·kg-1·d-10.9% NaCl溶液灌胃,不作其他处理。5 d后处死各组大鼠,观察腹腔内有无出血、腹水,以及腹水性质和肠道组织粘连情况。
2. 组织病理学检查:分离大鼠小肠组织,肉眼观察大体损伤情况。参考Murano等[8]采用的大体形态损伤评分标准(表1),评估肠黏膜溃疡和炎症程度。于距回盲部5 cm处向口侧切取两段2 cm长的小肠组织备用(肉眼观有糜烂、溃疡等病变的取病变及其周边组织),其中一份4%甲醛溶液固定,另一份置入冻存管后液氮保存,随后转入-80 ℃冰箱冻存待测。

表1 肠黏膜大体形态损伤评分标准
小肠组织标本4%甲醛溶液固定24 h,石蜡包埋、3~4 μm厚连续切片,HE染色,光学显微镜下观察,拍照。参考Chiu氏评分标准[9]进行小肠组织学损伤评分(表2),每只动物5张切片,每张切片随机观察4个高倍视野(×200),结果取均值。

表2 肠黏膜组织学损伤Chiu氏评分标准
3. ELISA法检测小肠组织Ang(1-7)和炎症细胞因子水平:参照相应ELISA试剂盒说明书进行操作,以酶标仪测定小肠组织Ang(1-7)、IL-6、IL-17A、IL-10、TGF-β1水平。
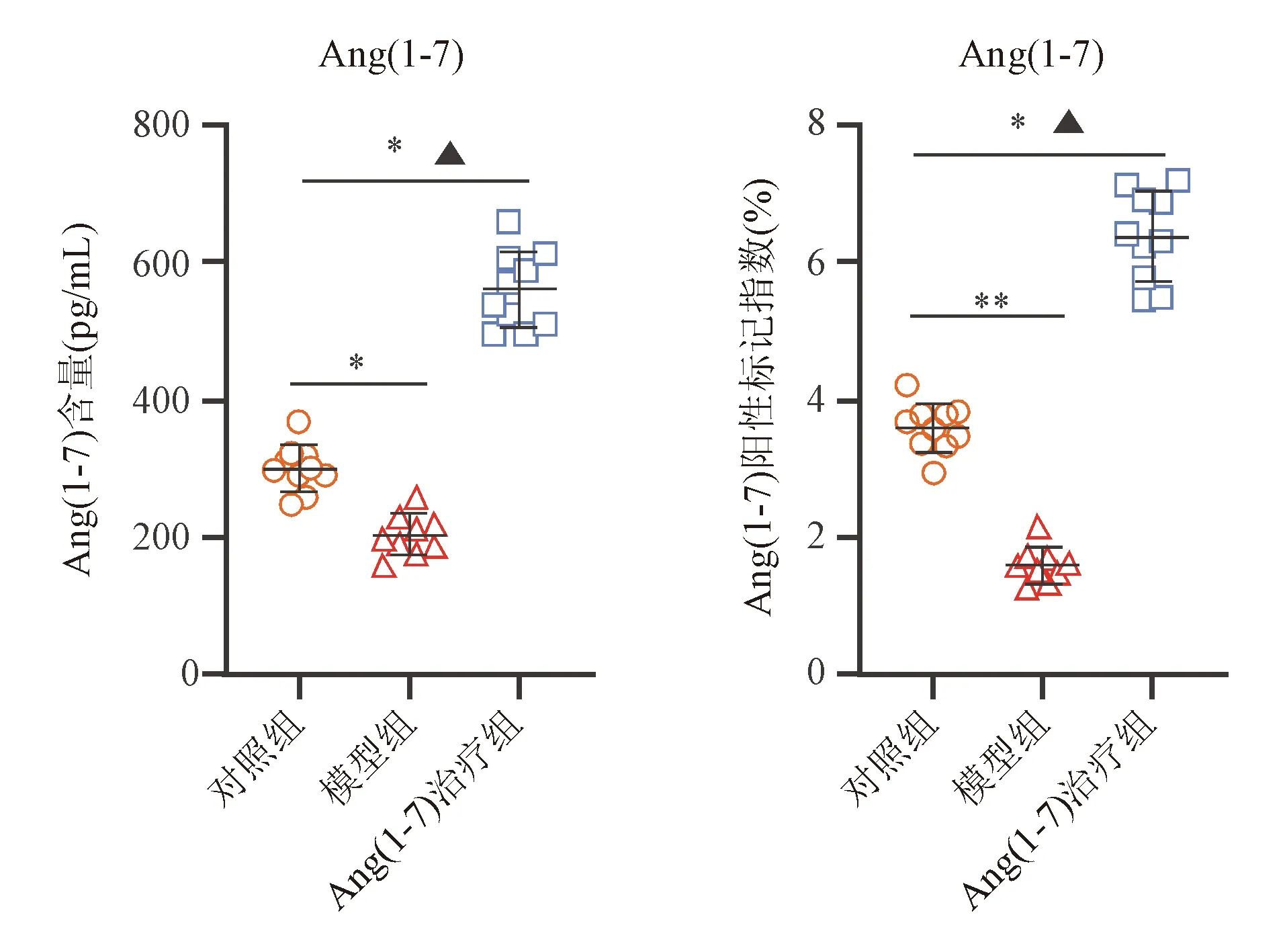
4. 免疫组化法检测小肠组织Ang(1-7)表达:石蜡包埋小肠组织3~4 μm厚连续切片,行SP法免疫组化染色,操作步骤参照试剂说明书进行。每只动物5张切片,每张切片于光学显微镜高倍视野(×200)下选取3~5个视野,每视野计数200个以上细胞中的阳性染色细胞数,计算阳性标记指数(阳性标记指数=视野内阳性细胞数/视野内细胞总数×100%),结果取均值。
5. 流式细胞术检测小肠黏膜Treg、Th17细胞比例:大鼠解剖后迅速取小肠黏膜,0.9% NaCl溶液清洗2~3次,立即置于预冷RPMI1640培养基中,剪碎、研磨、挤压、过滤后得到单细胞悬液,预冷PBS洗涤后离心,调节细胞浓度为2×106/mL,参照试剂说明书进行操作,上流式细胞仪(BD FACSCantoⅡ)检测Treg、Th17细胞占CD4+T细胞的比例。
三、统计学分析
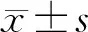
结 果
一、腹腔和小肠组织大体观察
对照组大鼠小肠黏膜光滑,无充血、水肿,无糜烂、溃疡。模型组大鼠造模第3天死亡1只,解剖后见大量血性腹水和肠穿孔;其余大鼠小肠黏膜广泛充血、水肿,散在多发糜烂、小溃疡,偶见小穿孔,伴肠系膜淋巴结肿大,损伤多在系膜侧。Ang(1-7)治疗组大鼠小肠损伤明显减轻,黏膜轻度充血、水肿,散在少量小糜烂灶,未见明显溃疡和穿孔。模型组大体损伤评分较对照组明显升高,Ang(1-7)治疗组评分则较模型组明显降低,差异均有统计学意义(P均<0.05;图1、表3)。
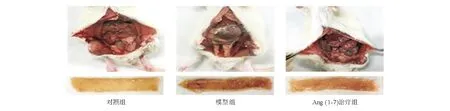
图1 各组大鼠小肠大体损伤
二、小肠组织病理学改变
对照组大鼠小肠黏膜结构未见明显缺损和异常,绒毛排列整齐。模型组大鼠小肠黏膜缺损,部分绒毛倒伏、缺失,上皮坏死严重,可见溃疡,固有层水肿明显,伴大量炎症细胞浸润。Ang(1-7)治疗组大鼠小肠绒毛轻度水肿、增粗,偶见上皮层小缺损,固有层内少量炎症细胞浸润。模型组组织学损伤评分较对照组明显升高,Ang(1-7)治疗组评分则较模型组明显降低,差异均有统计学意义(P均<0.05;图2、表3)。
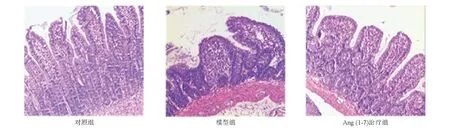
图2 各组大鼠小肠组织病理学改变(HE染色,×100)
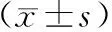
表3 各组大鼠小肠组织大体和组织学损伤评分比较
三、小肠组织Ang(1-7)表达水平变化
ELISA法和免疫组化法检测显示,模型组大鼠小肠组织Ang(1-7)含量和阳性标记指数均较对照组明显降低,Ang(1-7)治疗组相应数据则较模型组明显升高,差异均有统计学意义(P均<0.05;表4、图3、图4),表明外源性Ang(1-7)干预可升高小肠组织中的Ang(1-7)表达水平。
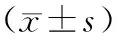
表4 各组大鼠小肠组织Ang(1-7)表达水平比较
与对照组比较,*P<0.05,**P<0.01;与模型组比较,▲P<0.01
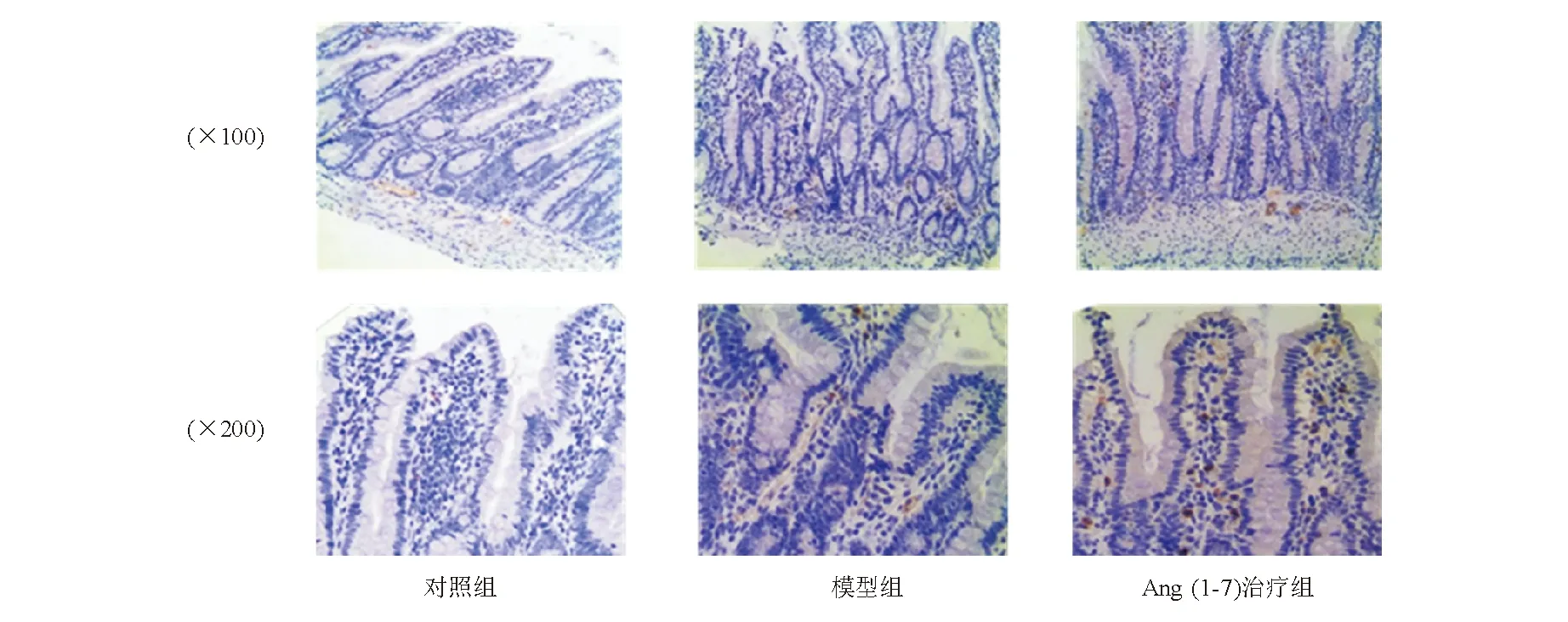
图4 各组大鼠小肠组织Ang(1-7)表达免疫组化染色图
四、小肠组织炎症细胞因子水平
ELISA法检测显示,模型组大鼠小肠组织IL-6、IL-17A水平较对照组明显升高,IL-10、TGF-β1水平较对照组明显降低,差异均有统计学意义(P均<0.05);Ang(1-7)治疗组IL-6、IL-17A水平较模型组明显降低,IL-10、TGF-β1水平较模型组明显升高,差异均有统计学意义(P均<0.05;表5、图5)。
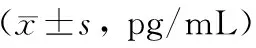
表5 各组大鼠小肠组织炎症细胞因子水平比较
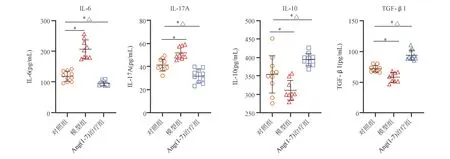
与对照组比较,*P<0.05;与模型组比较,△P<0.05
五、小肠黏膜Treg/Th17比值
流式细胞分析显示,模型组大鼠小肠黏膜Treg、Th17细胞占CD4+T细胞的比例均较对照组明显增加,但Treg/Th17比值较对照组明显降低,差异均有统计学意义(P均<0.05);Ang(1-7)治疗组Treg细胞比例较模型组明显升高,Th17细胞比例较模型组明显降低,Treg/Th17比值较模型组明显升高,差异均有统计学意义(P均<0.05;表6、图6)。
表6 各组大鼠小肠黏膜Treg、Th17细胞比例和Treg/Th17比值比较
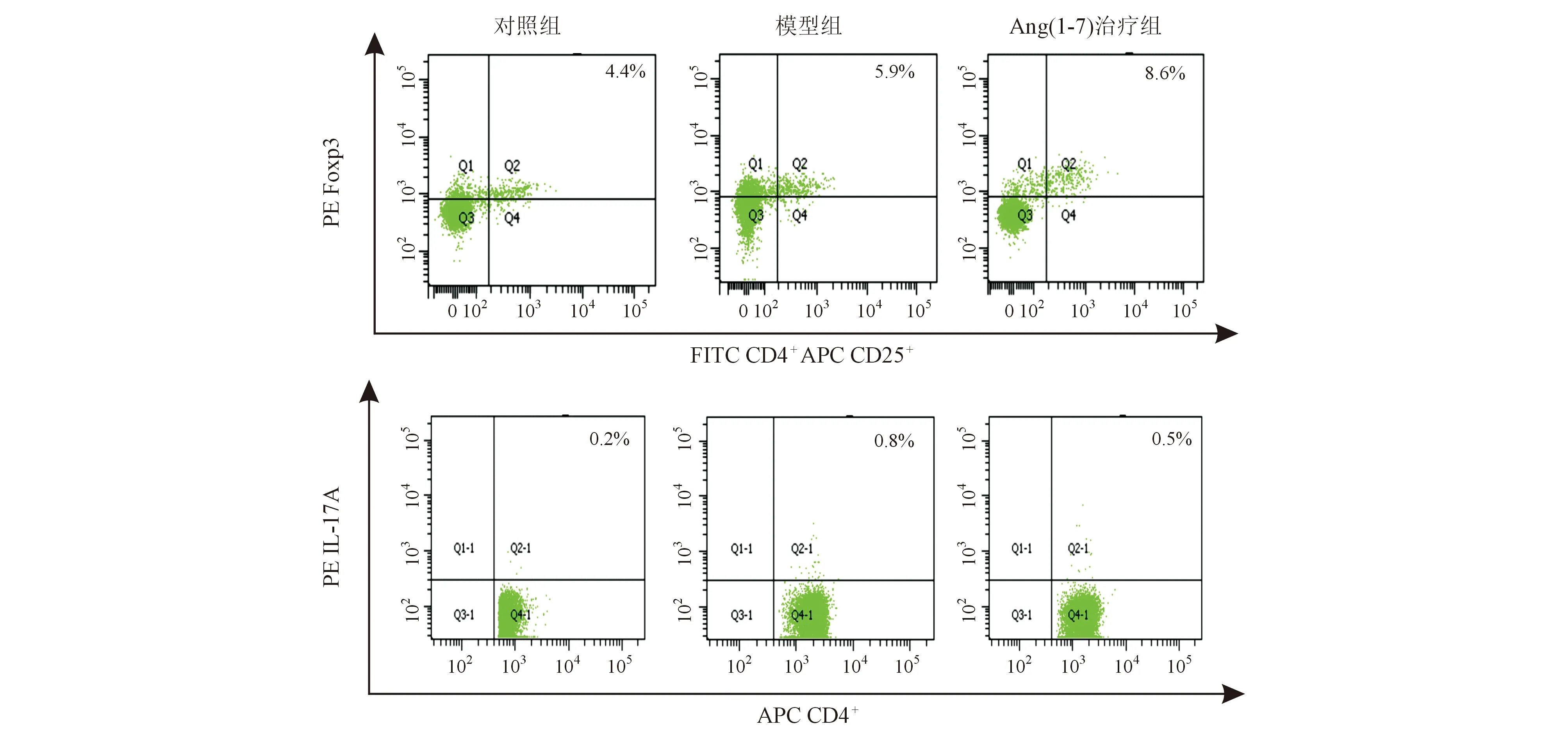
图6 各组大鼠小肠黏膜Treg、Th17细胞比例(流式细胞分析)
六、小肠组织Ang(1-7)含量与Treg/Th17比值的相关性
Pearson相关系数分析显示,小肠黏膜组织中的Ang(1-7)含量与Treg/Th17比值呈显著正相关(r=0.847,P<0.05)。
讨 论
NSAIDs在临床实践中广泛应用于急慢性炎症,如风湿性关节炎、骨关节炎等疾病的治疗。其中阿司匹林因其稳定的抗血小板凝集作用,已成为心脑血管疾病的一级预防用药。此外,其对结直肠癌也有一定的预防作用[10]。然而,随着该类药物适应证的扩大,其不良反应尤其是胃肠道不良反应的发生率逐渐增加。早年由于检查手段的限制,对NSAIDs相关胃肠道不良反应的研究主要集中于胃十二指肠损伤,近年来,由于质子泵抑制剂(PPIs)、黏膜保护剂等的使用,胃十二指肠黏膜损伤的发生率明显下降,但此类药物对包括小肠在内的下消化道损伤并无明确防治作用,甚至有研究表明,长期预防性使用PPIs可能通过影响肠道菌群增加小肠隐匿性出血和溃疡发生率[11]。近年来,随着内镜技术的进步,如胶囊内镜的应用,NSAIDs相关小肠损伤越来越多见,在长期服用NSAIDs的患者中,约50%存在小肠黏膜损伤[2]。而且,大部分NSAIDs相关肠病患者无临床症状,需住院治疗者多以出血、穿孔、梗阻等严重并发症为首发表现。NSAIDs相关肠病的发病机制复杂,迄今尚未完全明确,既往多聚焦于三级打击学说、环氧合酶(COX)双重抑制学说、NSAIDs的肝肠循环以及肠道菌群变化等方面[12],目前临床上缺乏有效的防治措施。因此,进一步明确NSAIDs相关小肠损伤的发病机制是迫切需要解决的问题。
Th17细胞和Treg细胞均由初始CD4+T细胞增殖分化而来,前者主要通过分泌IL-17A、IL-21等细胞因子参与机体自身免疫和炎症反应,后者则通过分泌IL-10、TGF-β1等细胞因子抑制免疫炎症反应,维持机体的免疫耐受。正常情况下两者处于一种动态平衡状态,对维持机体免疫稳态起重要作用。维甲酸受体相关孤核受体γt(RORγt)和叉头蛋白3(Foxp3)分别是参与调控Th17和Treg细胞分化的特异性转录因子[13],Foxp3缺乏可导致Treg细胞分化减少,从而引发过度免疫反应,造成组织损伤。除促进Th17细胞分化、产生大量IL-17A外,RORγt还可抑制T细胞产生IL-10,从而维持Th17细胞的致病性[14]。Treg/Th17平衡在不同疾病模型和病情阶段存在不同的变化趋势。综合相关研究结果,在炎症初发和进展阶段,机体和局部免疫水平上调,Treg和Th17细胞数量均有不同程度的增加,整体上以Th17细胞增加为主,通过分泌IL-17A等促炎细胞因子促进炎症发生、发展;至炎症后期和修复阶段,Th17细胞比例明显降低,Treg细胞比例逐渐升高,通过分泌IL-10等抗炎细胞因子抑制炎症持续,促进机体和局部组织修复。近年已有一系列关于Treg/Th17平衡在炎症性肠病等疾病中作用的研究发表[4-5,15],但其与NSAIDs相关小肠损伤之间的关系尚无确切结论。本研究发现,在双氯芬酸钠诱导的大鼠小肠损伤模型中,Th17细胞占CD4+T细胞的比例显著上升,尽管Treg细胞比例也较对照组升高,但Treg/Th17比值较对照组明显下降,表明NSAIDs相关小肠损伤时存在Treg/Th17失衡。模型组大鼠小肠组织IL-6、IL-17A表达升高,IL-10、TGF-β1表达降低,表明在NSAIDs相关小肠损伤中,Treg/Th17失衡致促炎/抗炎细胞因子失衡,进而促进炎症进展,造成组织损伤。
Ang(1-7)是肾素-血管紧张素系统的新组分,具有明显的抗炎效应,可减轻结肠炎、哮喘等疾病动物模型的炎症程度[3,16-17]。Ang(1-7)在体内主要由AngⅡ水解产生,与其特异性受体MAS结合后发挥抗炎、舒张血管、降低血压等与AngⅡ相反的生物学功能,因而被认为是AngⅡ的内源性拮抗剂[18-19]。本研究予模型大鼠外源性Ang(1-7)干预,探究Ang(1-7)在NSAIDs相关小肠损伤中的作用及其可能机制。实验结果显示,经Ang(1-7)干预的模型大鼠小肠组织Ang(1-7)表达水平明显升高,大体和组织学损伤较模型组明显减轻,Th17细胞占CD4+T细胞的比例以及IL-6、IL-17A水平亦较模型组明显降低,同时Treg细胞比例、Treg/Th17比值以及IL-10、TGF-β1水平较模型组明显升高,且小肠组织中的Ang(1-7)含量与Treg/Th17比值呈显著正相关,表明Ang(1-7)对NSAIDs相关小肠损伤具有保护作用,此种保护作用可能与调节Treg/Th17平衡有关,相关信号通路和分子机制尚待进一步研究。
综上所述,本研究发现NSAIDs相关小肠损伤时存在Treg/Th17失衡,这可能是NSAIDs相关小肠损伤的重要发病机制;Ang(1-7)对NSAIDs相关小肠损伤具有保护作用,其机制可能与调节Treg/Th17平衡有关,Treg/Th17平衡可能是防治NSAIDs相关小肠损伤的潜在靶点。后续研究拟通过干预Treg/Th17相关细胞因子,为NSAIDs相关肠病的临床治疗提供新的思路。
