磁共振弥散加权成像联合波谱分析技术对脑胶质瘤分级及鉴别的诊断价值
2021-05-17吴建恒
吴建恒
(高州市人民医院 神经外科,广东 高州 525200)
0 引言
脑胶质瘤是一种常见的原发性颅脑恶性肿瘤,主要由大脑和脊髓胶质细胞癌变产生,具有高发病率、高复发率、高死亡率和低治愈率等特点。脑胶质瘤的病灶累及脑蛋白,极少数累及灰质,患者临床症状因病灶部位不同而表现不同[1]。临床上,因影像学检查和脑胶质瘤的临床表现缺乏特异性,其诊断准确率相对较低,易出现误诊、漏诊等,影响患者治疗[2]。近年来,随着影像学技术的不断发展,磁共振弥散加权成像和波谱分析技术随之发展和完善。其中,磁共振弥散加权成像可反映水分子在活体组织中的运动扩散情况,波谱分析技术可通过检测活体组织中化合物浓度反映其代谢情况[3]。基于此,本文将分析磁共振弥散加权成像联合波谱分析技术对脑胶质瘤分级及鉴别的诊断价值,内容如下。
1 材料与方法
1.1 一般材料
以2019年1月1日至2020年3月31日为研究时间段,选取于我院就诊的41例脑胶质瘤患者,男31例,女10例,年龄5~80岁,平均(42.53±1.49)岁。术前均行磁共振弥散加权成像扫描和波谱分析技术检查,经手术病理诊断,41例患者均确诊为脑胶质瘤,其中低级别组16例(Ⅱ级16例),高级别组25例(Ⅲ级7例,Ⅳ级18例)。
1.2 方法
所有患者均接受磁共振弥散加权成像和波谱分析技术检查。磁共振弥散加权成像检查:采用3.0T MR扫描仪进行T1WI(TE=7.7ms,TR=500ms)和T2WI(TE=95ms,TR=4000ms)平扫,FLAIR序列(TE=108ms,TR=9000ms,TI=2500ms),FOV 230mm×230mm,间隔1.5mm,层厚5mm,矩阵224×256,NEX 1次,再轴位扫描层面平行于前后联合连线。弥散成像采用SE-EP1序列,将梯度场强切换率调整为200mT/m·s,梯度场强调整为40mT/m,并在相位编码、频率编码和层面选择三个方向增强扩散敏感梯度,b值分别取1000s/mm2、500s/mm2和0s/mm2,再调整TE=84ms,TR=2900ms,NEX 3次,扫描68s。扫描结束后,将图像传送至磁共振工作站,在肿瘤实质部分中央进行直径约为0.8~1.2cm的圆形感兴趣区选取,再进行表面弥散系数(ADC)测量,注意避免周围水肿区、坏死区和瘤内血管的容积效应。波谱分析技术检查:选择肿瘤层面最大、实性最好的区域进行三维定位,数据采集范围为层厚1.5cm,16.0cm×16.0cm,再根据肿瘤大小确定感兴趣区,左右径和前后径均8~12cm不等,体素大小约1.0cm×1.0cm×1.5cm,避免囊变、坏死和含脑脊液的部位。扫描参数调整为TE=135ms,TR=1500ms,采集4次,得到波谱曲线后,分析脑组织代谢产物之间的数值差异,包括含胆碱的化合物(Cho)、肌酸(Cr)和氮-乙酰天门冬氨酸(NAA)之间的关系,及Cho/Cr、NAA/Cr和Cho/NAA。
1.3 脑胶质瘤病理学分析
肿瘤标本经石蜡固定、切片和HE染色后,在光镜下观察其细胞形态、组织学结构等,并根据WHO分级标准进行病理分级。
1.4 观察指标
分析和对比不同级别的脑胶质瘤磁共振ADC和NAA/Cr及 Cho/Cr和Cho/NAA之间的差异。
1.5 统计学分析
2 结果
根据WHO分级将脑胶质瘤分为低级别组和高级别组,分别有16例和25例。低级别胶质瘤的ADC和NAA/Cr值高于高级别胶质瘤(P<0.05),低级别胶质瘤的Cho/Cr和Cho/NAA值低于高级别胶质瘤(P<0.05),见表1。
表1 对比不同级别脑胶质瘤的磁共振参数()
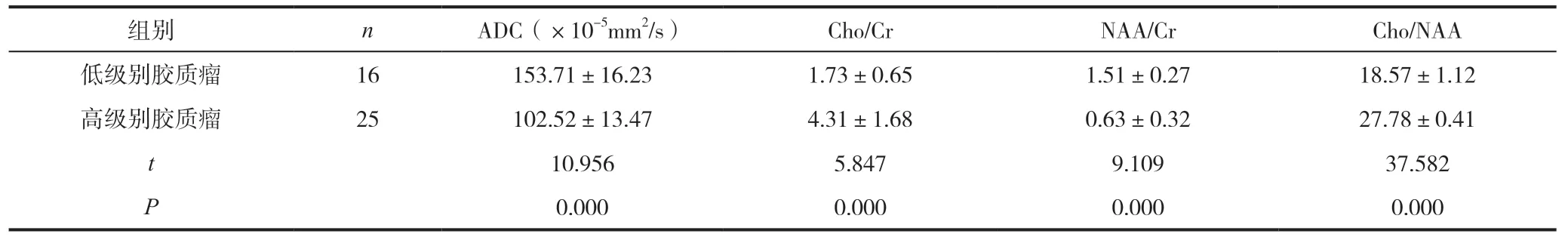
表1 对比不同级别脑胶质瘤的磁共振参数()
3 讨论
近年来,随着传统磁共振成像技术的不断发展,功能磁共振成像技术应运而生,可提供组织代谢、灌注等功能的变化情况。其中,磁共振弥散加权成像可反映活体组织中的水分子弥散运动情况,采用ADC值表现,值越小则水分子的弥散运动越受限[4]。波谱成像技术是通过探测原子核化学位移对分子结构进行分析,不同的磁共振波峰代表着不同的原子核,而共振核数目与峰面积成正比,可用于反映化合物浓度,从而有利于观察活体组织细胞的代谢变化。并且,波谱图像以频率分布,表示随时间变化的相对信号强度[5]。基于此,本文特针对磁共振弥散加权成像联合波谱分析技术对脑胶质瘤分级及鉴别的诊断价值展开分析,内容如下。
本次研究发现,低级别胶质瘤的ADC和NAA/Cr值高于高级别胶质瘤,低级别胶质瘤的Cho/Cr和Cho/NAA值低于高级别胶质瘤。分析其原因可知,脑胶质瘤的病灶区域境界不清,伴有轻微弥漫性肿胀。并且,肿瘤细胞主要浸润生长在神经细胞、神经束间和血管周围,而浸润区域的脑实质结构不会被明显破坏,极少出现出血或坏死等现象,故常规影像学检查难以鉴别[6]。相关研究[7]发现,胶质瘤出现在患者脑部时,瘤性组织将取代正常组织,从而对水分子的弥散运动产生影响。瘤性细胞越多,组织间质处的水分越少,水分子的弥散运动越弱,故ADC值越低。高级别胶质瘤含有丰富的细胞,细胞排列紧密,导致间质间的水分相对较少,并且细胞内的复合蛋白质较多,将进一步对水分子的弥散运动造成限制[8]。因此,高级别胶质瘤的ADC值低于低级别胶质瘤,在ADC图上呈现低信号。相关研究[9]发现,典型的脑组织代谢产物包括Cho、Cr和NAA,其中Cho是一种磷脂代谢的中间产物,主要用于细胞膜生物合成,与细胞增生有密切相关性,当Cho值上升时,代表有脑肿瘤出现。Cr是一种能量代谢的中间产物,在脑组织细胞中属于恒量能量代谢,而肿瘤浸润时,Cr值不会产生明显变化,因此Cr不能用于区分高低级别胶质瘤[10]。NAA是一种神经元标志物,只存在于神经元中,且含量较高。NAA可有效反映神经元状态,当其值下降时,代表着神经元出现不可逆转的损伤。相关研究[11]发现,脑胶质瘤主要由异常增生的胶质细胞组成,多源于神经上皮,将减少正常的神经元数量,因此脑胶质瘤的细胞膜转换增强、组织细胞增殖和能量代谢增强,从而在波谱分析中表现为Cr波中度降低、NAA波显著降低,而Cho波显著增高,因此波谱成像技术对鉴别脑胶质瘤有重要的诊断意义。相关研究[12]发现,脑组织代谢产物的比值与肿瘤级别之间有着密切关联。肿瘤恶性程度增加,将加快细胞合成代谢,导致Cho值增加,可有效反映高级别胶质瘤的代谢能力和浸润破坏力更强。当胶质瘤细胞破坏神经元及导致其移位时,NAA值将随着胶质瘤级别的增高而降低,因此Cho和NAA值可用于区别高低级别胶质瘤。并且,胶质瘤级别越高,NAA/Cr比值呈下降趋势,而Cho/Cr和Cho/NAA比值呈上升趋势。因此,脑胶质瘤及其分级采用磁共振弥散加权成像与波谱分析技术联合鉴别更好,能从脑胶质瘤的水分子弥散情况和化合物浓度两方面进行诊断,可提高诊断准确率,为临床治疗提供更可靠的数据支持。朱震方[13]等学者研究结果表明,低级别胶质瘤瘤灶实性成分ADC值明显高于高级别胶质瘤实瘤灶实性部分;低级别胶质瘤NAA/Cho和NAA/Cr明显高于高级别胶质瘤,Cho/Cr明显低于高级别胶质瘤,差异具有统计学意义,与本文研究结果相符,进一步说明磁共振弥散加权成像与波谱分析技术联合鉴别脑胶质瘤分级有意义,值得应用。总而言之,本文采用磁共振弥散加权成像与波谱分析技术联合鉴别脑胶质瘤分级,可有效提高对高低级别脑胶质瘤的鉴别准确率。但是,脑组织中的水弥散运动较为复杂,将受到细胞膜通透性和细胞内外水分子的黏滞度影响。并且,脑胶质瘤具有不成熟的血管构造和迂曲的血管走形,水分子的弥散运动将受到脑胶质瘤容积和血流量的影响。目前,波谱的体素较大,在确定脑胶质瘤的病灶及周围浸润范围时可能存在一定误差,需提高波谱分辨率进行改善。检查时间对于病人来说,越短越好,但MRS耗费的检查时间较长,且肿瘤具有异质性,所以MRS的可重复率较低,因此,本文在脑胶质瘤的病理分级结果中仍将存在一定局限性。
4 结论
综上所述,在脑胶质瘤及其分级鉴别中,磁共振弥散加权成像与波谱分析技术的联合诊断可为临床治疗提供一定的参考价值。
