连作对藜麦生长和生理特性的影响
2021-05-16刘文瑜王旺田杨发荣王宝强
杨 科,刘文瑜,王旺田*,杨发荣,杨 晨,王宝强
(1.甘肃农业大学 生命科学技术学院,甘肃 兰州 730070;2.甘肃省干旱生境作物学重点试验室,甘肃 兰州 730070;3.甘肃省农业科学院畜草与绿色农业研究所,甘肃兰州 730070;4.甘肃省藜麦育种栽培技术及综合开发工程研究中心,甘肃兰州 730070)
【研究意义】藜麦(Chenopodium quinoaWilld)是苋科藜亚科一年生双子叶草本植物,氨基酸种类完全且比例平衡,富含矿物质、维生素等多种营养物质,具有低脂、低升糖指数、不含麸质的特质[1],能适应干旱、低温、盐碱等多种生态环境[2],自1988年藜麦被联合国粮农组织(FAO)选为“未来安全粮食”以来,因其可作为一种生产油脂、粮食和动物饲料的多用途作物而被世界各地广泛引种[3-4]。连作作为一种在农业上应用非常普遍的耕作方式,在有限的土地资源上通过连作可以取得最大化的种植效益。但连作也会造成作物生长发育不良、病虫害加重、产量下降、品质变劣等连作障碍问题[5]。因此,明确连作障碍机理,采用合理的措施降低连作障碍已成为改善农田土壤质量、提高作物产量的重要途径。【前人研究进展】连作不仅影响土壤理化性质与微生态环境,还进一步调控作物在形态结构、生理和生化方面的适应性变化[6-8]。为了明确连作与作物生理生化及产量之间的关系和作物应对土壤微生态变化做出的生理响应机制,前人对马铃薯[9]、甜瓜[10]、芸豆[11]和谷子[12]等作物做了大量研究,结果表明,连作年限的增加会使光合作用受抑制,影响干物质的积累;另外,连作引起叶片细胞中活性氧代谢失衡,细胞膜脂过氧化产物丙二醛(MDA)和氧自由基含量增加,导致膜脂过氧化损伤,使株高、叶面积、植物组织含水量和产量、可溶性蛋白质含量,超氧化物歧化酶(SOD)、过氧化物酶(POD)等保护性酶活性均呈下降趋势。【本研究切入点】近年来,由于藜麦价格飙升,企业为追求经济效益而进行连作种植,造成土壤肥力下降,导致减产。虽然前人对作物连作的研究报道很多,但在藜麦上研究相对较少,尤其是连作对藜麦形态特征、抗性生理指标和产量的影响尚不明确。【拟解决的关键问题】本试验旨在明确连作对藜麦形态特征和产量的影响,从生理生化角度初步揭示连作对藜麦生长的影响机制,以期为建立合理的耕作制度提供理论依据和实践指导。
1 材料与方法
1.1 试验材料
以甘肃省农业科学院畜草与绿色农业研究所自繁自育的藜麦品种‘陇藜1号’为供试品种。
1.2 试验地概况
本试验选取甘肃省甘南州临潭县新城镇选择藜麦连作2年及前茬为油菜的没有连作地块作为试验样地,甘南州临潭县(35°0′4.63″N,102°54′32.97″E)地处青藏高原东北边缘,平均海拔2 884.04 m,大部分属高寒干旱区气候,年降水量383.2~668.2 mm,蒸发量93~356 mm,年日照时数2 314 h,年平均气温1.7 ℃,无绝对无霜期。
1.3 试验设计
以藜麦连作3年(以C3表示)及没有连作(以C0表示)的地块为试验地,小区面积为18 m2(3 m×6 m)。播前施基肥(磷酸二铵225 kg∕hm2,腐熟羊粪肥150 kg∕hm2),对土地进行旋耕耙磨。2018年4月4日播种,采用开沟点播,每穴约4~6粒种子,播种深度2 cm,行距30 cm,株距25 cm,播种量3 kg∕hm2,3个重复,4~6叶期进行定苗,每穴留苗一株,13株∕m,同时及时除草,田间管理同当地大田。在生长期内每隔20 d取全株和叶片样品分别用于生物量、生理生化指标测定。
1.4 测定指标与方法
1.4.1 植株生物量 将植株连根取出,洗净根部泥土,后用滤纸吸干根部及叶面水分,分别测定其株高、根长和鲜物质质量。然后将植株鲜样放入105 ℃烘箱中杀青15 min后,在70 ℃下烘至恒质量,取出用电子天平称干物质质量(精确到0.01 g)。
1.4.2 产量构成因素 随机选取10株完全成熟的植株,统计其总分枝数、有效分枝数,测定其主穗长度,后收获并待其完全风干,测定其单株穗质量、千粒质量、单株产量和单位面积产量。
1.4.3 生理指标 叶绿素含量测定采用乙醇丙酮法[13];可溶性糖含量测定采用蒽酮乙酸乙酯法[13];可溶性蛋白含量测定采用考马斯亮蓝比色法[14];脯氨酸含量测定采用酸性茚三酮法[14];MDA含量测定采用硫代巴比妥酸法[14];O2·-产生速率参照王爱国等[15]的方法测定;SOD活性测定参照Huang等[16]的方法并稍作改动;POD活性测定参照Shi等[17]方法;CAT活性测定参照Nakano等[18]的方法;APX活性测定参照Nakano等[18]的方法。
1.5 数据处理与分析
用Excel 2010整理试验数据、绘制图表;用SPSS 17.0软件进行相关性分析,并运用Duncan新复极差法对显著性差异进行多重比较。
2 结果与分析
2.1 藜麦连作对其生长的影响
生长指标的变化是植物应对不良生长环境时所表现最直接的体现。由表1可知,藜麦植株生物量随生长进程的进行呈增加的趋势。C0和C3在株高、根长、鲜物质质量和干物质质量上存在差异。苗期C3比C0株高增加3%,但鲜物质质量与干物质质量分别降低16.5%和7.8%;C3在显穗期和灌浆期的株高、鲜物质质量、干物质质量分别比C0降低16.6%、2.2%、7.6%和7.5%、6.0%、16.4%;C3处理下的根长比C0在显穗期、盛花期和灌浆期增加68.5%、13%和12.8%。由于作物为适应土壤环境的变化,通过增加根长来获取更多的养分和水分来满足生长需求,说明连作抑制了藜麦地上部分的生长,促进了地下部分的生长。
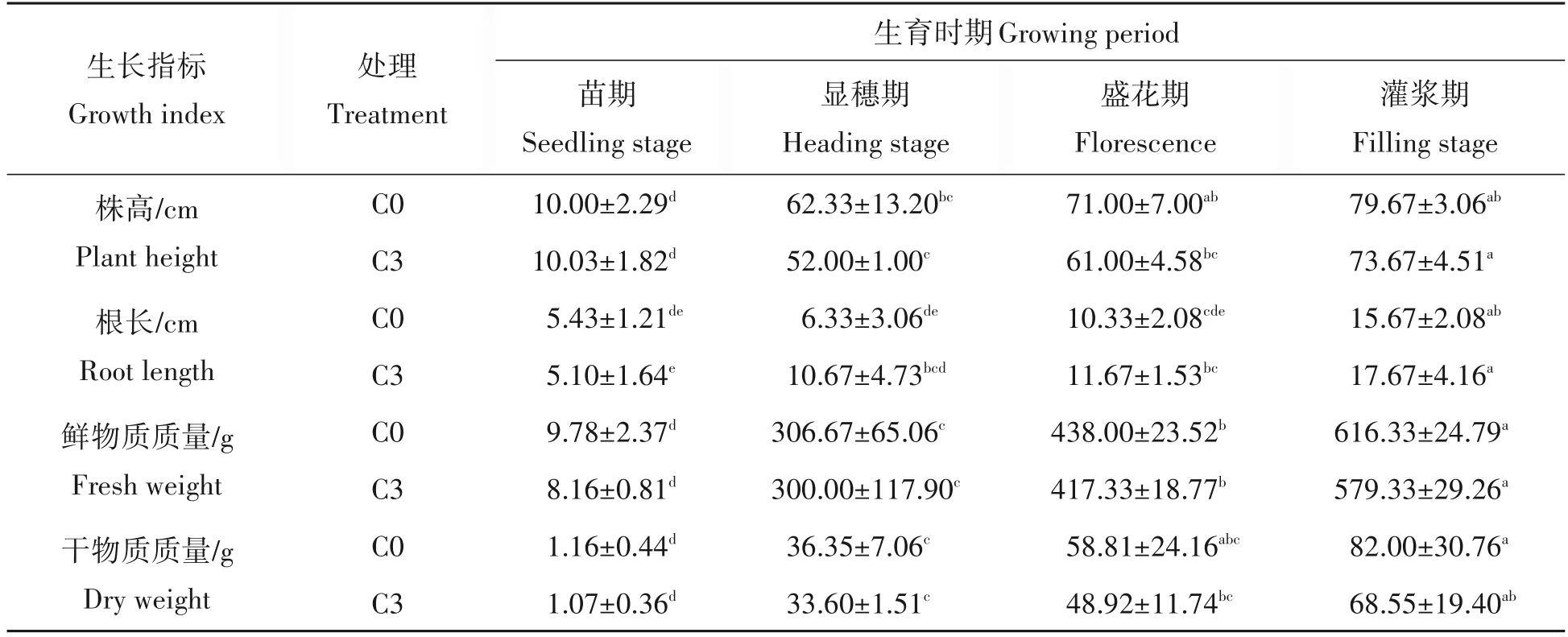
表1 品种效益年连作对藜麦植株生长的影响Tab.1 Effects of continuous cropping on growth of quinoa seedlings
2.2 藜麦连作对其产量构成因素的影响
由表2可以看出,连作降低了藜麦的分枝数、单株主穗长度和质量等影响产量的因素,C3处理下比C0处理下的分枝数、有效分支率、主穗长度和单株穗质量分别下降22.2%、7.4%、18.5%和28.1%;C3处理比C0处理藜麦籽粒千粒质量降低13.9%,单株产量降低37.9%,单位面积产量降低了34.78%。
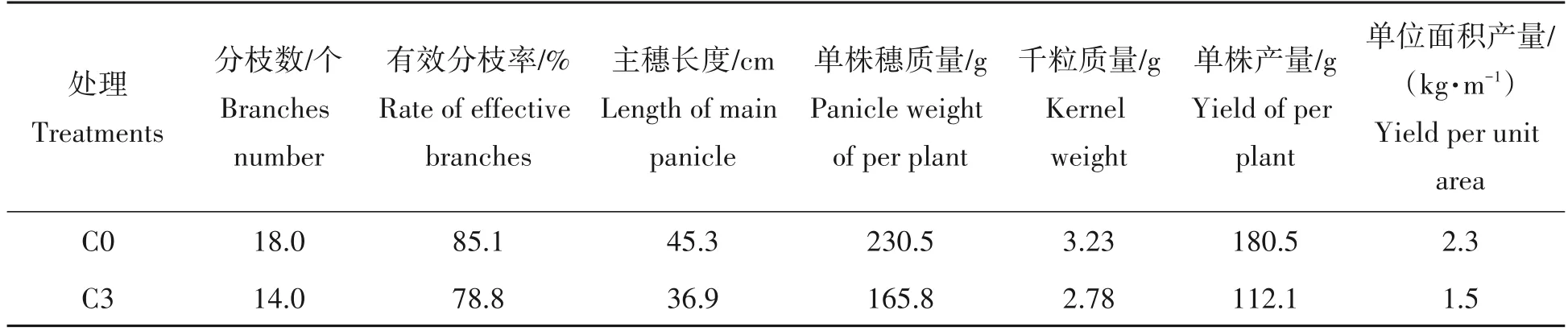
表2 连作对藜麦产量构成因素的影响Tab.2 Effects of continuous cropping on yield components of quinoa
2.3 藜麦连作对其叶片生理特性的影响
2.3.1 藜麦连作对其叶片叶绿素含量的影响叶绿素含量的动态变化可以间接反应叶片的生理活动和光合能力的强弱[19]。如图1所示,藜麦叶片叶绿素含量在整个生育期随着生长进程的进行呈先降低后升高再降低的趋势,在盛花期达到最大值,含量为4.34 mg∕g。整个生育期中C3处理叶绿素平均含量比C0降低21.5%,显著低于C0处理(P<0.05),C3在苗期、显穗期、盛花期和灌浆期分别比C0下降了25.0%、53.6%、5.1%、和62.5%,灌浆期差异显著。盛花期藜麦叶片叶绿素含量显著高于其它3个时期(P<0.05),C0处理下分别比其它3个时期升高了80.8%、309.4%和19.2%,C3处理下分别比其它3个时期升高了151.0%、498.6%和84.4%。由此可见,连作影响藜麦生长期叶片的光合作用,不利于藜麦干物质的积累与产量的形成。
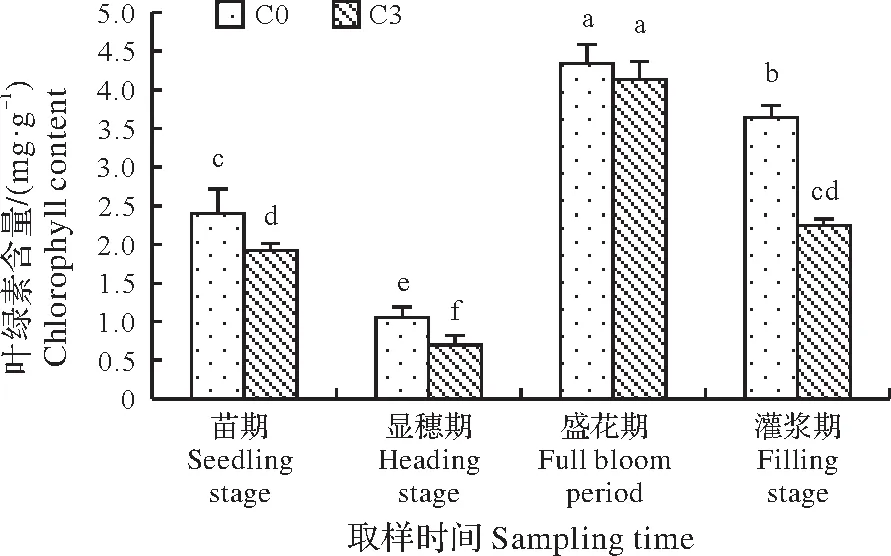
图1 连作对藜麦叶片叶绿素含量的影响Fig.1 Effect of continuous cropping on chlorophyll content of quinoa leaves
2.3.2 藜麦连作对其叶片可溶性糖、可溶性蛋白、脯氨酸含量的影响 如图2A所示,藜麦叶片可溶性糖含量随生长进程的进行呈现先升高后降低再升高的趋势;同一生育期内,C3在苗期、显穗期、盛花期和灌浆期分别比C0可溶性糖含量增加42.4%、27%、50.3%、150.1%,灌浆期升高显著;不同生育期之间,灌浆期藜麦叶片可溶性糖含量显著高于其它3个时期(P<0.05),C0处理下比其它3个时期升高了124.2%、67.2%和170.9%,C3处理下比其它3个时期升高了293.6%、229.2%和350.5%。表明连作影响藜麦可溶性糖含量的升高,在灌浆期对藜麦叶片可溶性糖的含量影响最大。
如图2B所示,随着生长进程的进行,藜麦叶片的可溶性蛋白含量在整个生育期内变化不太明显;在苗期、显穗期、盛花期和灌浆期C3可溶性蛋白含量分别比C0有所增加,增加幅度为18.3%、10.1%、12.9%和16.6%;不同生育期之间,C3处理下藜麦灌浆期比其它3个时期叶片可溶性蛋白含量高1.5%~4.5%。
如图2C所示,C0处理下藜麦叶片脯氨酸含量呈现先降低后升高再降低的趋势,C3处理下藜麦叶片的脯氨酸含量呈现下降的趋势,在苗期、显穗期、盛花期和灌浆期分别比C0脯氨酸含量上升了15.9%、74%、51%和35.4%,显穗期升高明显;不同生育期之间,苗期藜麦叶片可溶性糖含量高于其它3个时期,C0处理下比其它3个时期升高了256.9%、183.9%和256.8%,C3处理下比其它3个时期升高了13.2%、65.6%和174.4%。表明连作在显穗期对藜麦叶片脯氨酸的含量影响最大。

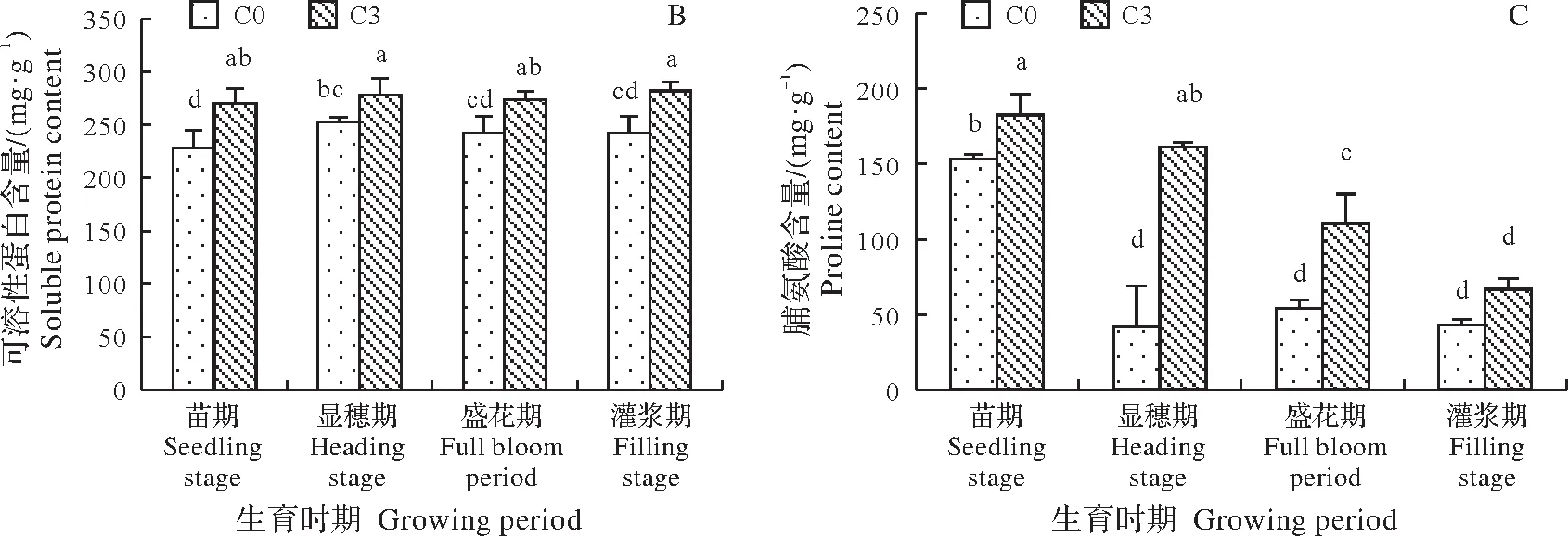
图2 连作对藜麦叶片可溶性糖、可溶性蛋白、脯氨酸含量的影响Fig.2 Effects of continuous cropping on soluble sugar,soluble protein and proline contents of quinoa leaves
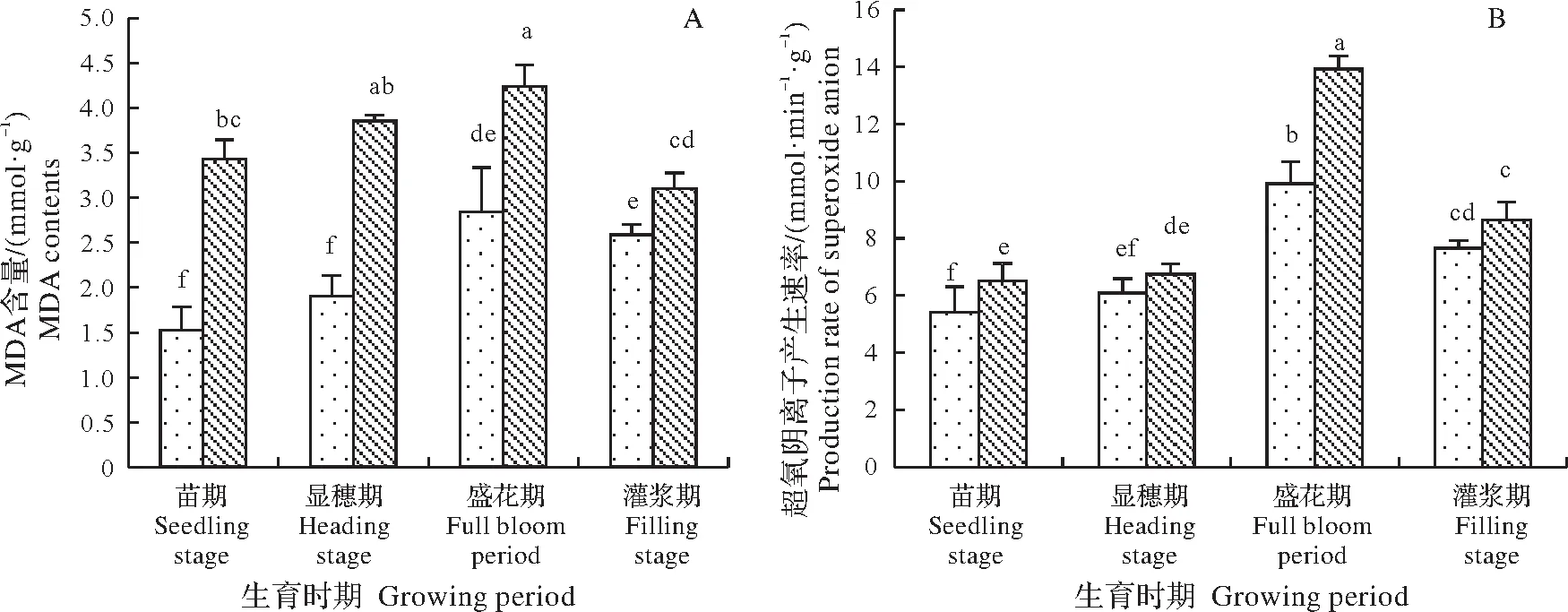
图3 连作对藜麦叶片MDA含量和超氧阴离子产生速率的影响Fig.3 Effects of continuous cropping on MDA content and superoxide anion production rate of quinoa leaves
2.3.3 藜麦连作对其叶片MDA含量和O2·-产生速率的影响 由图3A可以看出,藜麦叶片的MDA含量在整个生育期内总体上呈现先升后降的趋势,同一生育期内,C3处理下藜麦叶片MDA含量显著高于C0处理,在苗期、显穗期、盛花期和灌浆期分别升高了124.2%、103.6%、49.3%和19.2%,苗期和盛花期升高明显。两种处理之间,盛花期MDA含量比其它3个时期均高,C0处理下分别升高了85.6%、49.5%和9.7%,C3处理下分别升高了23.6%、10.1%和36.8%。表明连作在盛花期对藜麦叶片MDA含量影响最大,连作条件下苗期和盛花期是藜麦叶片的细胞损伤的主要时期,在此期间影响叶片衰老较快,不利于后期产量的形成。
由图3B可以看出,藜麦叶片的O2·-产生速率在整个生育期内总体上呈现先升后降的趋势,同一生育期内,C3处理下藜麦叶片超氧阴离子产生速率显著高于C0处理,在苗期、显穗期、盛花期和灌浆期分别升高了20.2%、10.8%、40.6%和12.9%。不同生育期之间,盛花期藜麦叶片O2·-产生速率高于其它3个时期,C0处理下分别比其它3个时期升高了114.1%、106.5%和61.3%,盛花期升高明显,C3处理下分别比其它3个时期升高了82.8%、62.7%和29.5%。表明盛花期是连作藜麦O2·-产生速率最大时期,同时也是受连作影响最大时期。
2.3.4 藜麦连作对其叶片SOD、POD、CAT和APX活性的影响 由图4A可以看出,C3处理下藜麦叶片的SOD活性显著低于C0处理,在苗期、显穗期、盛花期和灌浆期分别降低了61%、28.4%、72.8%和28.6%,不同生育期之间,C0处理下花期的SOD活性分别比其它3个时期升高了116.3%、112.5%和60.3%,C3处理下灌浆期的SOD活性分别比其它3个时期升高了146.8%、32.2%和63.8%。表明连作在盛花期对藜麦叶片SOD活性影响最大。藜麦叶片POD、CAT活性在C0处理下呈先升高后下降再升高的变化趋势,C3处理下呈先降低后升高的变化趋势(图4B、C),同一生育期内,C3处理下藜麦叶片POD、CAT活性显著低于C0处理,POD活性在苗期、显穗期、盛花期和灌浆期分别降低了35.6%、67.5%、73.8%和94.1%,盛花期的POD活性最低,表明连作在灌浆期对藜麦叶片影响最大;CAT活性分别降低了40.5%、83.5%、73.2%和69.1%,在显穗期和盛花期影响较大。不同生育期之间,灌浆期藜麦叶片POD活性高于其它3个时期,C0处理下分别比其它3个时期升高了288.3%、100.9%和237.8%,C3处理下分别比其他3个时期升高了58.7%、62.1%和94.0%。C0处理下盛花期的CAT活性分别比其它3个时期升高了25.4%、17.7%和124.6%,C3处理下苗期的CAT活性分别比其它3个时期升高了238.3%、53.6%和298.2%。

图4 连作对藜麦叶片SOD、POD、CAT和APX活性的影响Fig.4 Effects of continuous cropping on activities of SOD,POD,CAT and APX in leaves of quinoa
由图4D可以看出,藜麦叶片的APX活性在整个生育期内总体上呈现先降后升的趋势,同一生育期内,C3处理在苗期、显穗期、盛花期和灌浆期比C0处理的APX活性有所上升,同比上升幅度为22.3%、121.1%、250%和246.7%;不同生育期之间,苗期藜麦叶片APX活性高于其它3个时期,C3处理下分别比其它3个时期升高了7.7%、761.4%和73.7%。表明连作在盛花期灌浆期对藜麦叶片APX活性影响最大。
3 讨论与结论
连作障碍的发生使土壤微生态平衡受到破坏,主要表现在土壤供肥、理化性状、微生物性状、酶活性以及土壤线虫等能力的劣变,植物根系分泌物和化感物质的积累产生的自毒作用,影响植物根系对养分的吸收导致植物生长受抑制[20-21],生物量作为直接衡量植物群体生产力的指标反映着从生态环境中获取的能量大小[22]。本试验表明连作条件下藜麦株高、鲜物质质量和干物质质量等下降,这与张思苏等[23]和高桐梅等[24]在花生与芝麻的连作实验结果一致。连作后藜麦根长在短时间内出现增加的现象,与学者马达灵等[25]研究一年连作对马铃薯的形态特征影响不明显相类似。但有学者在研究长期连作对马铃薯根系生物学特征的研究中表明根冠比增大和根系形态的改变是植物对逆境环境的主动形态学适应[6],理论上认为根系系统越发达,则越有利于土壤中水分养分的吸收。结合本研究结果,说明连作主要影响藜麦地上部分干物质量的减少,而藜麦具有较强的抗逆性是通过根系来实现。
光合作用是植物形成生物产量的过程,是植物获取太阳能源的基础。而叶绿素是植物体内能直接影响光合作用强弱的物质,直接影响着光合效率与光合产物的积累。本试验结果表明藜麦连作使叶片中叶绿素含量降低,可溶性糖、可溶性蛋白和脯氨酸含量都有所增加。而可溶性糖、可溶性蛋白和脯氨酸作为植物体内重要的渗透调节物质抵抗不良环境[26],说明连作导致藜麦叶片生物量的减少和产量的降低主要是由于光合效率减少影响光合产物的积累。由于连作增加了土壤中自毒物质的含量,植物自身通过积累渗透调节物质,从而抵抗连作对植物细胞造成的损伤。
当植物处于胁迫条件下,植株体内会产生大量的活性氧,破坏细胞的生物膜脂和蛋白质等,从而影响植物的正常新陈代谢,这时保护酶系统就会启动从而保护植物免受伤害。王才斌等[27]研究表明,花生连作导致花生叶片SOD、POD、CAT活性显著降低,使植株活性氧积累和膜脂过氧化损伤,产生生育障碍,直接影响其生长发育。李夏等[12]研究表明连作谷子伴随谷子植株的衰老,功能叶片的叶绿素SOD、POD等保护性酶均呈下降趋势。本试验表明,连作使藜麦叶片的SOD、POD、CAT活性呈下降趋势,在花期和灌浆期影响较大,其氧化酶活性的降低可能与活性氧的大量积累有关,需要进一步验证;APX活性呈升高趋势,在灌浆期表现更为明显。表明藜麦在连作时,活性氧的清除可能是由APX发挥作用,是藜麦应对连作障碍的一种适应性反应。
综上所述,连作使得植物叶绿素含量降低,严重影响藜麦光合作用和保护酶系统,从而使植株生产库源关系失调引起藜麦生长与产量的抑制,降低地上部分生物量。同时,藜麦通过促进根系生长等形态变化增强抗逆性,提高可溶性糖、可溶性蛋白和脯氨酸等渗透调节物质以及提高APX活性增强抗氧化酶活性来达到清除活性氧危害的目的,以适应连作对藜麦生长的影响。
