蛋清溶菌酶的提取及其酶学性质探究
2021-05-15周钦育黄燕燕黄泳尧林钟培刘冬梅
周钦育,黄燕燕,赵 珊,黄泳尧,林钟培,刘冬梅
(华南理工大学食品科学与工程学院 广州510640)
溶菌酶(Lysozyme,EC 3.2.1.17)又被称为胞壁质酶(Muramidase)、N-乙酰胞壁质聚糖水解酶(N-acetylmuramide glycanohydrlase)[1],可以选择性地水解细菌细胞壁上肽聚糖的β-1,4 糖苷键,使得细胞在溶解死亡的同时,不破坏其它组织[2],是一种天然、安全性能良好的杀菌剂和防腐剂,具有抗菌、消炎、抗病毒等作用[3],可广泛应用于食品生物防腐、医药、日用化工等行业[4-6]。目前研究表明,鸡蛋蛋清是溶菌酶生产的主要原料,其溶菌酶的含量可达到0.2%~0.4%[7],然而,蛋清中含有多种蛋白质,需对蛋清中的溶菌酶进行分离提纯。
目前,常用的溶菌酶提纯方法包括结晶法、亲和膜色谱法、离子交换法、超滤法等[8-10]。Curcio 等[11]采用静态膜结晶法以NaCl 为沉淀剂,MgCl2溶液为洗脱液,醋酸钠溶液为缓冲液调节蛋清液pH值,静置1 d 后溶菌酶以晶体形式析出,其操作简单,然而生产周期长,原料利用率低,且制得的溶菌酶纯度较低。Ho[12]用活性红120 对磁性壳聚糖微球表面进行改性,并采用磷酸盐缓冲液作为洗脱液,制得的溶菌酶解吸率为92.6%,回收率为89.1%,其制得的溶菌酶纯度高,然而操作难度较大,成本高,难以应用于工业化生产。离子交换法可利用离子交换剂与蛋白质之间的结合力不同起到分离效果[13]。余海芬等[14]采用阳离子交换树脂法,以硫酸铵为洗脱液提取蛋清溶菌酶,制得溶菌酶比酶活达9 500 U/mg,其操作简单,生产周期短,效率高,适合工业化生产。超滤法以超滤膜两端压力差为动力,通过控制膜孔径大小进行蛋白质的分离[15]。Mayani 等[16]用超滤法所制得的蛋清溶菌酶纯品纯度达96%,回收率为75%,其操作简单、快速,相较其它方法条件温和,是生物工业领域中较有潜能的蛋白质分离技术。综上,现有的溶菌酶提取方法均存在一定的缺陷,因此,本研究协同使用离子交换法、超滤法[17],研究一种新型、高效的提纯溶菌酶的方法,即选用724 阳离子交换树脂对溶菌酶进行特异性吸附,洗脱后经二步超滤获得精制溶菌酶,经单因素试验、Box-Behnken试验优化提纯工艺参数,并对提纯后的溶菌酶酶学性质进行初步表征。
1 材料与方法
1.1 材料、试剂与仪器
新鲜鸡蛋,市售;溶菌酶标准品,南京建成生物有限公司;溶壁微球菌(Micrococcus lysodeikticus Fleming,保藏编号:GIM1.132),广东省微生物保藏中心;724 大孔弱酸性阳离子交换树脂,郑州勤实科技有限公司;蛋白质标准品,南京建成生物有限公司;其它试剂均为分析纯级试剂。
pH 计,上海梅特勒-托利多仪器有限公司;高速冷冻离心机,安徽嘉文仪器装备有限公司;可见-紫外分光光度计,上海棱光技术有限公司;YXQ-LS-18SI 立式压力蒸汽灭菌器、SW-GJ-1R超净工作台,上海博讯实业有限公司医疗设备厂;GXZ-300D 生化培养箱,宁波东南仪器有限公司;DHG-9194A 电热恒温干燥箱,上海精宏实验设备有限公司。
1.2 试验方法
1.2.1 提取溶菌酶的工艺流程 蛋清搅拌、过滤→树脂预处理 (724 大孔弱酸性阳离子交换树脂提取蛋清液中的溶菌酶[18],盐酸、氢氧化钠溶液的浓度为1 mol/L,浸泡时间均为10 h)→吸附→洗脱→超滤技术辅助提纯、脱盐→冷冻干燥得溶菌酶纯品。
1.2.2 工艺优化
1.2.2.1 单因素试验 以树脂用量、蛋清滤液pH值、洗脱液浓度、洗脱时间为考察因素,测定洗脱液中溶菌酶质量浓度(mg/mL)及比活力(U/mg),并以溶菌酶的比活力(U/mg)为指标考察阳离子交换法的单因素试验结果。
1.2.2.2 Box-Behnken 试验 在单因素试验的基础上,选择树脂用量(A)、洗脱液NaCl 浓度(B)、蛋清滤液pH 值(C)、洗脱时间(D)4 个因素,每个因素选取低、中、高3 个水平(表1),采用4 因素3水平的响应曲面方法设计试验,并以溶菌酶比活力为指标,确定最佳提取工艺。

表1 Box-Behnken 试验因素水平表Table 1 Box-Behnken experimental factor level table
1.2.2.3 超滤试验 将阳离子交换法所得到比活力最高的洗脱液,置于不同转速、时间下进行离心超滤(截留分子质量为50 ku),弃上层液,所得下层液于6 500×g,20 min 离心进行二步超滤(3 ku),留上层浓缩液,并以酶含量、比活力为考察指标,探究最优超滤条件。
1.2.3 溶菌酶含量及比活力测定方法
1.2.3.1 溶菌酶含量的测定 参考《鸡蛋蛋清中溶菌酶的测定 分光光度法》(GB/T 25879-2010)[19],略有改动。以0.9%NaCl 溶液为参比液,在波长281 nm 处依次测定各溶菌酶标准液吸光度,绘制标准曲线。取试样1 mL,用0.9%NaCl 溶液稀释定容至25 mL,混匀,在波长281 nm 处测定试样溶液的吸光度,平行测定3 次,由标准曲线回归方程计算试样的溶菌酶浓度。
1.2.3.2 溶菌酶比活力的测定 参照《溶菌酶活性检测方法》(GB/T 30990-2014)[20],略有改动。于待测管中加入0.4 mL 待测酶液,再加入2 mL 溶壁微球菌菌液后开始计时,在波长450 nm 处分别反应15 s 和75 s 后,记录吸光度A15和A75。按每分钟较OD450值下降0.001 为1 个活力单位(U)定义,计算酶活力,见式(1)。

式中,EA——溶菌酶比活力(U/mg);Ew——所测酶液中溶菌酶含量(mg)。
1.2.4 溶菌酶相对酶活的测定 测定溶菌酶在不同条件下的酶活,计酶活最高值为100%,相对酶活为在不同条件下酶活与最高酶活的百分比。
1.2.5 溶菌酶产品纯度鉴定 参照Laemmli 等[21]的聚丙烯酰胺凝胶电泳法(SDS-PAGE)检测1.2.1节中吸附溶菌酶的洗脱液和超滤酶液的纯度。电泳结束后,使用凝胶成像仪采集图像,Image Lab 5.2.1 软件分析图像。
1.2.6 蛋清溶菌酶部分酶学性质的探究 以1.2.1 节中经过优化后制得的溶菌酶为样品酶,探究pH 值、温度、金属离子、表面活性剂对溶菌酶酶活的影响,以及该酶的温度和pH 稳定性。
1.2.6.1 pH 值对溶菌酶酶活的影响 使用不同pH 值(3.0,4.0,5.0,6.0,7.0,8.0,9.0)的生理盐水配制成质量浓度为20 g/mL 的酶液,25 ℃水浴30 min 后,按1.2.4 节所述方法测定相对酶活(%)。
1.2.6.2 温度对溶菌酶酶活的影响 使用pH 值为7.0 的生理盐水配制成质量浓度为20 g/mL 的酶液,水浴加热至不同温度(20,30,40,50,60,70,80 ℃),保温30 min 后,测定相对酶活(%)。
1.2.6.3 溶菌酶的pH 稳定性 使用不同pH 值(3.0,4.0,5.0,6.0,7.0,8.0,9.0)的生理盐水配制成质量浓度为20 μg/mL 的酶液,并分别反应30,60,90 min 后,测定相对酶活(%)。
1.2.6.4 溶菌酶的温度稳定性 使用pH 值为7.0的生理盐水,配制成质量浓度为20 μg/mL 的酶液,水浴加热至不同温度(30,40,50,60,70,80℃),保温30,60,90 min 后,测定相对酶活(%)。
1.2.6.5 金属离子对溶菌酶酶活的影响 用蒸馏水配制成质量浓度为20 μg/mL 的酶液,加入等体积的不同金属离子(Na+,K+,Ca2+,Mn2+,Zn2+,Mg2+)溶液,使溶液中最终金属离子含量为0.01 mol/L,同时设空白对照,25 ℃水浴30 min 后,测定相对酶活(%)。
1.2.6.6 表面活性剂对溶菌酶酶活的影响 使用pH 值为7.0 的生理盐水配制成质量浓度为20 μg/mL 的酶液,等体积加入体积分数10%的甘油、Tween20、Tween40、Tween80,设空白对照,25 ℃水浴30 min 后,测定相对酶活(%)。
1.2.7 数据处理 采用Design-Expert 8.0.6 软件响应面设计、数据分析、回归模型建立,采用Origin Pro 8.0 做图;试验数据采用SPSS 19.0 软件进行数据分析。
2 结果与分析
2.1 阳离子交换法单因素优化
2.1.1 树脂用量优化 由图1可知,当蛋清树脂比为10∶2 时,溶菌酶比活力达到最大值14 997.78 U/mg,之后随着树脂含量的增加,溶菌酶比活力缓慢下降。而酶含量随蛋清树脂比的增加而增加,在蛋清树脂比到达10∶2.5 之后,增加缓慢。由此可知,当蛋清树脂比为10∶2.5 时,所得溶菌酶的比活力较高,树脂用量合适,适宜提取分离溶菌酶。
2.1.2 蛋清滤液pH 值优化 由图2可知,当蛋清滤液pH 值为9 时,溶菌酶比活力最高(16 048.71 U/mg),当pH 值过高或过低时,酶的比活力都会有所降低,可能由于pH 值改变了蛋清滤液中酶的带电状态,过酸、过碱都会对酶结构造成不可逆的破坏,使酶的比活力下降[22]。与酶含量达到最高点相比(pH 8),pH 9 时酶含量下降,而比活力却升高,即阳离子交换法提纯蛋清溶菌酶的选择pH值为9 做后续试验。

图1 不同蛋清树脂比对溶菌酶比活力的影响Fig.1 The effect of different proportions of egg white resin on lysozyme activity
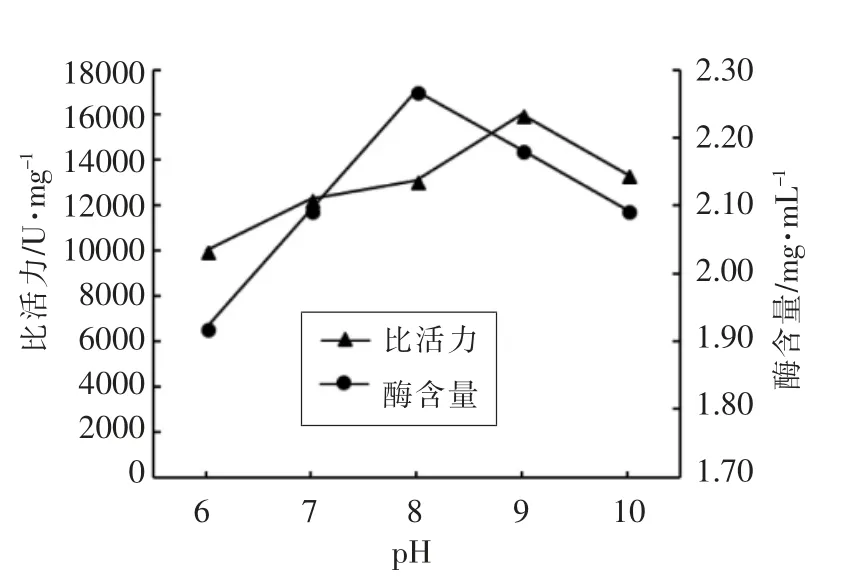
图2 不同蛋清滤液pH 值对溶菌酶比活力的影响Fig.2 The effect of different pH values of egg white filtrate on lysozyme activity
2.1.3 NaCl 溶液(洗脱液)浓度优化 由图3可知,随NaCl 浓度的升高,溶菌酶的比活力先上升后下降,当NaCl 浓度为1 moL/L 时,所得溶菌酶的比活力最高,此时的洗脱液浓度适宜提取分离溶菌酶。当NaCl 浓度高于1 moL/L 时,酶的比活力反而下降,酶含量变化却不大,可能由于溶菌酶在高浓度盐溶液中发生盐析作用导致[23]。
2.1.4 洗脱时间优化 由图4可知,当洗脱时间为60 min 时,所得溶菌酶的比活力最高,随着洗脱时间继续延长,酶含量增加缓慢,酶比活力反而下降,综合考虑经济成本,选定洗脱时间为60 min。
2.2 阳离子交换法条件优化
综上,由单因素试验结果可知,阳离子交换法最优工艺条件为:蛋清滤液树脂比为10∶2.5,pH 9.0,NaCl (洗脱液) 浓度1 mol/L,洗脱时间60 min。由此,进一步做Box-Behnken 试验优化阳离子交换法条件,试验设计及结果如表2所示。
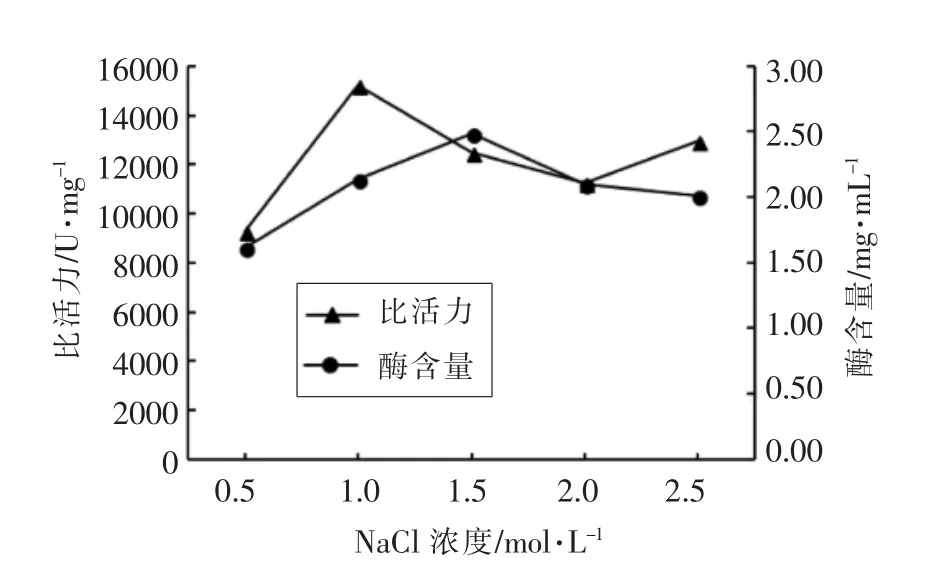
图3 不同NaCl 浓度对溶菌酶比活力的影响Fig.3 The effect of different NaCl concentrations on lysozyme activity

图4 不同洗脱时间对溶菌酶比活力的影响Fig.4 The effect of different elution time on lysozyme activity

表2 Box-Behnken 试验结果Table 2 Box-behnken experiment results
采用Design Expert 8.0.6 软件进行分析,如表3所示。由表3可知,拟合模型的P=0.0014<0.05,说明模型与实际情况拟合良好。根据以上分析得知溶菌酶比活力R1对自变量每100 mL 蛋清滤液中树脂用量(A)、NaCl 浓度(B)、蛋清滤液pH值(C)、洗脱时间(D)的多元回归方程为:
R1=20 866.66-1 432.26A+194.18B+486.75C+539.58D-961.62AB-1 252.19AC-2 929.88AD-21.46BC-2 724.86BD+90.11CD-6 079.24A2-5 995.65B2-3 410.58C2-3 903.162。
由方程可知,溶菌酶比活力和4 个自变量之间具有显著线性关系。回归方程的二次项系数比较大,交互项系数中AD、BD 的交互系数很大,说明树脂用量和洗脱时间、NaCl 浓度和洗脱时间之间的交互效应很大,AB、AC 的交互系数较大,说明树脂用量和NaCl 浓度之间、树脂用量和pH 值之间交互效应较大,而BC、CD 的交互系数比较小,说明NaCl 浓度和pH 值之间、pH 值和洗脱时间之间的交互效应小。
为了检验方程的有效性,对测定的溶菌酶的比活力的数学模型进行方差分析,并对各因子的偏回归系数进行检测。一次项中A 的回归系数较显著,P=0.0806,说明蛋清树脂比对提取的溶菌酶比活力有较显著作用。二次项中A、B、C、D 的偏回归系数均达到极显著水平。交互项AD、BD 回归系数较其它因素显著,说明树脂用量和洗脱时间、NaCl 浓度和洗脱时间之间的交互项对溶菌酶比活力影响较为显著。

表3 Box-Behnken 试验分析Table 3 Box-behnken experiment analysis
为了得到最高的溶菌酶比活力,吸附和洗脱的各条件需要合适的交叉选择。响应面图可直观反映各因素及交互作用对酶活力的影响[24-26],故取3 项显著性较高的交互项制作响应面图,根据图5~7 的Box-Behnken 优化试验拟合响应曲面图和方差分析得知,对溶菌酶比活力影响大小顺序为AD>BD>AC。
对二次回归方程求一阶偏导,当响应值R1(溶菌酶比活力) 为最大值时,各因子水平为每100 mL 蛋清滤液中,树脂用量(A)为24.20 mL、NaCl浓度(B)为1.00 mol/L、蛋清滤液pH 值(C)为9.10、洗脱时间(D)为62.61 min。此时理论预测溶菌酶比活力为21 041.1 U/mg。
对所获得的阳离子交换法各最优条件做平行验证试验,重复5 次,如表4所示,得到的溶菌酶比活力为20 509.58 U/mg,与理论值接近。
2.3 超滤提纯条件优化设计
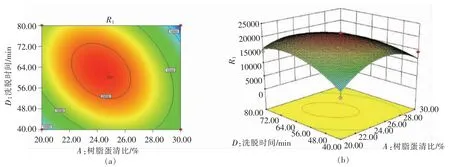
图5 树脂用量和洗脱时间的响应面图和等高线图Fig.5 Response surface and contour map of resin dosage and elution time

图6 洗脱液浓度和洗脱时间的响应面图和等高线图Fig.6 Response surface and contour map of elution concentration and elution time

图7 树脂用量和pH 值的响应面图和等高线图Fig.7 Response surface and contour map of resin dosage and pH value

表4 最优条件下溶菌酶比活力测定结果Table 4 The results of lysozyme activity in the optimal condition
将上述优化条件制得酶液做进一步超滤提纯优化,将酶液置于截留量为50 ku 的超滤离心管中,于4 000~6 000×g,离心5~15 min,除去杂蛋白,弃去离心管上层液。再将下层液置于截留量为3 ku 的超滤离心管中,于6 500×g,离心20 min,保留上层截留液,测定其酶含量及比活力,结果如表5所示。可知,随着转速的升高,酶含量逐渐升高,而溶菌酶比活力呈先上升后下降的趋势,推测由于离心转速过低使得溶菌酶被部分截留在上层,而离心转速过高,虽能将溶菌酶全部透过下层,但部分杂蛋白不能有效去除,同样不被截留,或是溶菌酶在高速离心过程中有所损伤,致酶活力下降。且随着离心时间延长,比活力有所增加,然而离心时间不适宜过长,过长的离心时间会使效率降低,不利于大规模生产。故当溶菌酶比活力为最大值时,选择50 ku 超滤离心管,在5 000×g条件下离心10 min。
2.4 溶菌酶纯度检验
将最优阳离子交换法所得的洗脱液与最优的超滤液分别取样进行SDS-PAGE 凝胶电泳试验,电泳结果如图8和图9所示。
由图8、图9对比可知,洗脱液和超滤液均可在14.4 ku 看见明显条带,与蛋清溶菌酶的相对分子质量相符[27-28]。此外,只经过阳离子交换法的洗脱液的杂蛋白及杂质盐较多,影响纯度,而洗脱液经过二步超滤后,杂蛋白、杂质盐较少,提取的溶菌酶纯度较高。
选用经过阳离子交换法协同二步超滤法提纯的蛋清溶菌酶液,测定溶菌酶的纯度,结果如图10所示,并用Image Lab 5.2.1 软件对图像进行分析,所得数据如表6所示。

表5 洗脱液离心试验结果Table 5 The results of eluent centrifugal experiment

图8 洗脱液的SDS-PAGE 凝胶电泳图Fig.8 SDS-PAGE gel electrophoresis diagram of eluent

图9 超滤液的SDS-PAGE 凝胶电泳图Fig.9 SDS-PAGE gel electrophoresis diagram of ultrafiltrate

图10 超滤液的凝胶成像图Fig.10 Gel imaging of ultrafiltrate
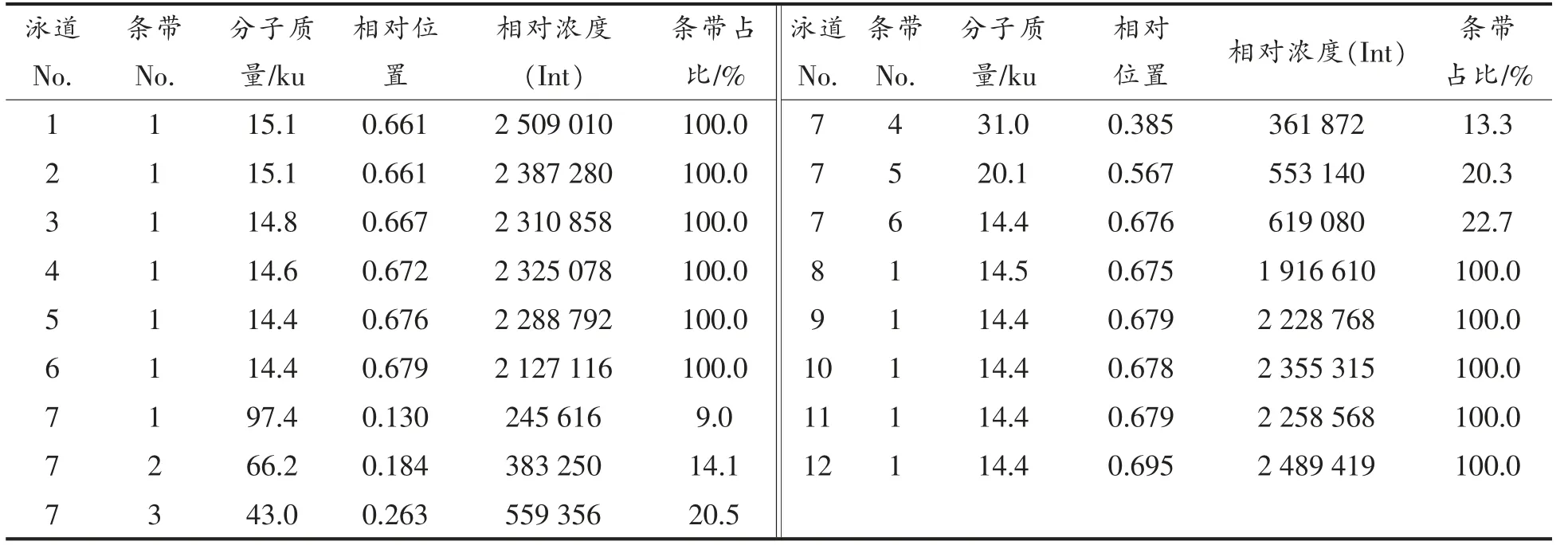
表6 凝胶成像数据分析结果Table 6 Gel imaging data analysis results
由表6可知,超滤液中蛋白质分子质量在14.4~15.1 ku,符合蛋清溶菌酶分子质量的分布范围[26-27]。除泳道4 外,其余泳道平均值为2 290 619,蛋白质标准品的第6 条带(溶菌酶条带)含量为0.125 μg/μL,上样量为5 μL,相对浓度值为619 080,试验测得超滤液中蛋白质含量为2.40 μg/μL,上样量10 μL(上样缓冲液∶样品(体积比)=4∶1),相对浓度值为2 290 619,故估算得溶菌酶纯度为96.36%,测得该溶菌酶的比活力为23 718.61 U/mg。
2.5 溶菌酶的酶学性质探究
2.5.1 pH 值对溶菌酶酶活的影响 由图11可知,随pH 值的不断升高,溶菌酶的相对酶活呈先上升后下降的趋势,溶菌酶在pH 5~8 均可保持85%以上的相对酶活,在pH 值为3~4 时仍有70%以上的相对酶活,在pH 值为7.0 时,酶活力达到最大值,可推测,溶菌酶的最适pH 值约为7.0。pH值影响溶菌酶酶活的原因可能是由于pH 值的改变对底物溶壁微球菌的状态产生影响[29],也可能是pH 值使得酶的带电状态改变,从而影响酶的活性[30]。
2.5.2 温度对溶菌酶酶活的影响 由图12可知,在20~60 ℃时,溶菌酶相对酶活随温度升高缓慢上升,且相对酶活均在78%以上,温度作用范围广;在60 ℃时,酶活达到最高值,若继续升温,则酶活下降较快。其可能是因为低温时随温度上升分子运动加快,提高了反应速度,而当温度到达60 ℃后,随反应温度的升高,蛋清溶菌酶逐渐失活,使得酶活性下降[31]。

图11 pH 值对溶菌酶活性的影响Fig.11 Effect of pH value on lysozyme activity

图12 温度对溶菌酶活性的影响Fig.12 Effect of temperature on lysozyme activity
2.5.3 溶菌酶的pH 稳定性 由图13可知,溶菌酶在偏酸及中性的环境下比较稳定,在pH 4.0~7.0 的范围内,相对酶活保持在88%以上。而在碱性环境下,随着时间延长,相对酶活逐渐下降,且随pH 值升高,变化幅度越来越大,在pH 8.0 的生理盐水中处理90 min,酶活力降为初始的80%,而在pH 9.0 的生理盐水中处理90 min,酶活力降为初始的65%。故溶菌酶在偏酸性及中性条件下较为稳定,而过酸、过碱易使其失活,这与傅婷等[22]的研究结果类似,可能是由于溶菌酶在酸性环境中其主链构象随酸度变化影响不大,结构比较稳定[32]。
2.5.4 溶菌酶的温度稳定性 由图14可知,在30~60 ℃时,温度对酶活影响不大,溶菌酶保持较高稳定性;在70 ℃保温一段时间,酶活缓慢下降,90 min 后,比活力降低为初始值的78%;而在80℃保温一段时间,酶活下降速率较高,90 min 后,比活力降为初始值的52%。可能是随温度升高,溶菌酶变性失活程度升高,失活速度加快。
2.5.5 金属离子对溶菌酶酶活的影响 由图15可知,Na+、Ca2+对溶菌酶有较强的激活作用;K+对溶菌酶激活作用较弱;而Zn2+对溶菌酶活性有较强的抑制作用;其它金属离子(Mg2+、Mn2+)对溶菌酶活性无明显影响。故除少数离子对溶菌酶活性有抑制作用外,大部分金属离子对酶活不会产生影响或起到激活作用,即大部分金属离子与溶菌酶具有良好的配伍作用[33]。
2.5.6 表面活性剂对溶菌酶酶活的影响 由图16可知,几种表面活性剂对蛋清溶菌酶活性都有一定的抑制作用,其中Tween20、Tween40、Tween80 对酶活力影响较小,相对酶活力保持在84%以上,而经过体积分数10%的甘油处理的溶菌酶相对酶活力降至78%。这可能与表面活性剂对溶菌酶结构产生影响有关;表面活性剂的高黏度特性会降低溶菌酶的活性[34],因而在溶菌酶制备过程中应减少或不使用表面活性剂。

图13 溶菌酶的pH 稳定性Fig.13 The pH stability of lysozyme

图14 溶菌酶的温度稳定性Fig.14 Temperature stability of lysozyme
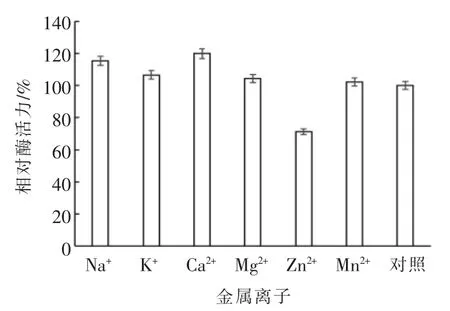
图15 0.01 mol/L 金属离子对溶菌酶活性的影响Fig.15 Effect of metal ions (c=0.01 mol/L)on lysozyme activity
3 结论

图16 0.1 mg/mL 表面活性剂对溶菌酶活性的影响Fig.16 Effect of surfactant (c=0.1 mg/mL)on lysozyme activity
本文对阳离子交换法协同超滤技术提取蛋清中溶菌酶的工艺进行优化,并对溶菌酶的纯度和部分酶学性质进行探究,主要结论如下:
1)基于单因素和Box-Behnken 试验得到最优提取工艺条件为:树脂用量为蛋清滤液体积为24.2%,洗脱液为1.00 mol/L NaCl,蛋清滤液pH值为9.10,洗脱时间为62.61 min,此时理论预测酶液的比活力为21 041.1 U/mg。对所获得的工艺条件进行验证得到实际酶液的比活力为20 509.58 U/mg。将优化后的酶液进行超滤优化,并进行SDS-PAGE 纯度鉴定,所得二步超滤条件为:使用50 ku 超滤,在5 000×g 条件下离心10 min,再用3 ku 超滤,6 000×g 离心20 min,最终测得溶菌酶的比活力为23 718.61 U/mg,纯度为96.36%。
2)通过对溶菌酶的酶学性质的研究可知,溶菌酶最适pH 值为7.0,pH 值在4.0~7.0 范围内稳定性较好;最适反应温度为60 ℃,低温下热稳定性良好,在较高温度下酶活下降较快;Na+、Ca2+对酶有较强激活作用,K+有一定激活作用,Mg2+、Mn2+对酶活影响不大,Zn2+对酶有明显抑制作用;表面活性剂甘油、Tween20、Tween40、Tween80 均对溶菌酶有抑制作用,甘油的抑制作用较强。
本文通过单因素及响应面法优化阳离子交换法-超滤法协同提取蛋清中溶菌酶最佳的工艺条件,并对所提取溶菌酶的酶学性质进行探究,为下一步工业化及规模化生产奠定基础。
