破囊壶菌生产角鲨烯的研究现状
2021-05-14李梦凡谢云轩谢宁栋张爱卿汪光义
李梦凡 谢云轩 谢宁栋 张爱卿 汪光义
(天津大学环境科学与工程学院,天津 300072)
角鲨烯(squalene,C30H50)是一种具有重要药用保健价值的线性多不饱和三萜类物质[1]。作为一种天然的抗氧化剂,它可以保护细胞免受自由基的侵害,增强机体的免疫力,降低各种癌症的患病风险,特别是能够有效抑制化学诱导的肺、结肠和皮肤肿瘤的发生[2-3]。角鲨烯还是保湿剂、润肤乳等护肤品中的重要成分,对于促进皮肤健康具有显著功效[4]。此外,角鲨烯有助于降低人体的胆固醇水平,对于预防心血管疾病具有潜在作用[5]。临床研究表明,日粮中角鲨烯总量的 60%-85% 被有效吸收并分布于各种组织中,较高的角鲨烯摄入量(约500 mg/d)对维持人体的营养健康至关重要[6]。
目前,商业角鲨烯制品的主要生产来源是深海鲨鱼肝油和某些植物籽油[7]。但是,随着海洋野生动物保护法的实施,以及季节、地理等因素的限制,未来角鲨烯的持续供应和可获得性变得不确定[3]。此外,由于鲨鱼肝脏中存在二噁英、多氯联苯和重金属等环境污染物,以及腥味和其他异味,鲨鱼肝油的使用受到很大的限制[8]。因此,科学家和研究人员开始努力寻找商业化生产高质量角鲨烯的替代来源[9]。近年来,微生物作为潜在的角鲨烯替代来源,逐渐进入人们的视野[10]。据报道,酵母菌具有合成角鲨烯的能力,但其角鲨烯占生物量干重(dry cell weight,DCW)的含量相对较低(0.041 mg/g DCW),因此酵母菌不是生产角鲨烯的优选菌株[11-12]。绿色微藻Botryococcus braunii具有合成角鲨烯的能力,但其生长速率很低,故不适合工业化生产[13]。破囊壶菌可以在异养条件下利用有机碳快速生长,并通过高密度发酵高效生产角鲨烯,与依赖光照、生长缓慢、无法高密度培养的自养藻类相比,具有显著优势[14]。因此,破囊壶菌有望成为角鲨烯商业化生产最具潜力的微生物替代来源。本文综述了国内外关于破囊壶菌生产角鲨烯的研究进展,同时提出破囊壶菌发酵生产角鲨烯过程中存在的问题,并指出分离获得优质的破囊壶菌菌株、对其代谢途径和关键酶的改造是下一步研究的重点。
1 破囊壶菌及其合成角鲨烯概述
破囊壶菌于1936年首次被分离,属于类真菌的海洋单细胞异养原生生物,目前被分类至管毛生物界、不等鞭毛类、网黏菌纲、破囊壶菌目[15],主要包含Aurantiochytrium、Thraustochytrium、Botryochytrium、Parietichytrium、Aplanochytrium、Labyrinthuloides、Oblongichytrium、Sicyoidochytrium、Japonochytrium、Ulkenia,和 Schizochytrium 等 11个属[16]。破囊壶菌虽然在分类学上与真核不等鞭毛纲关系密切,但在系统发育学上却与杂核藻类(如硅藻和褐藻)更为接近[17],并且在商业应用中也常被称作“异养微藻”[18-19]。破囊壶菌在全球海洋具有广泛的地理分布,从河口、红树林、近海到大洋;从热带到极地海域,从表层海域到数千米的深海,破囊壶菌几乎存在于各类海洋生态系统[20]。在深海,它们与“海洋雪”有关,说明潜在的富含营养的底物能够使其在异养条件下生活[21];同时,在含有腐烂生物物质(如表层沉积物层、红树林或河水)的栖息地中,破囊壶菌的分布更为丰富[22]。在大多数情况下,破囊壶菌会在腐烂的生物材料上生长[23],因此在有机物分解和碳循环中起着重要的生态作用。
除其生态学意义外,破囊壶菌在生物技术上也引起了人们的广泛关注,因为它们不仅可以像光合微藻一样积累高水平的三酰基甘油(triacylglycerol,TAG),同时还可以产生大量以二十二碳六烯酸(DHA,C22:6)为主的ω-3多不饱和脂肪酸(polyunsaturated fatty acid,PUFAs)[15]。另外,一些破囊壶菌特别是Aurantiochytrium属的菌株,产生的角鲨烯含量可超过细胞干重的30%[3,24-25]。目前,角鲨烯销量仍处于增长期,预计到2024年销售额将达到2.04亿美元(www.marketsandmarkets.com)。当前对破囊壶菌产角鲨烯的研究主要集中在菌株的筛选及培养条件的优化方面(高产菌株见表1)[26-29]。目前已经筛选得到的高产角鲨烯的破囊壶菌主要来源于不同地区的红树林中,这为以后在红树林地区筛选菌株提供了借鉴。
2 破囊壶菌角鲨烯合成路径
到目前为止,角鲨烯的生物合成途径已初步探明[37]。已有文献记载,角鲨烯是经胞质甲羟戊酸(mevalonate,MVA)途径或质体甲基赤藓糖醇磷酸(2-C-methyl-D-erythritol 4-phosphate,MEP)途径合成前体物质二异戊烯基二磷酸酯(isopentenyl diphosphate,IPP)及其异构体二甲基烯丙基二磷酸 酯(dimethylallyl diphosphate,DMAPP) 后, 再通过一系列酶的催化作用而形成的[38]。MVA途径于20世纪60年代首次被发现,在植物、动物和真菌中普遍存在,是许多真核生物合成角鲨烯前体IPP和DMAPP的唯一来源[39-40]。MVA途径在细胞质的水溶性成分中起作用,通常为生产倍半萜和三萜类化合物(如角鲨烯)及其相关化合物(如氧化角鲨烯和双氧化角鲨烯)提供前体[41]。MEP途径则是某些植物和微生物中的替代途径,它发生在质体内,以丙酮酸和3-磷酸甘油醛为原料,以MEP和1-脱氧-D-木酮糖-5-磷酸(1-deoxy-D-xylulose-5-phosphate,DXP)为中间体,进而合成角鲨烯前体IPP 和 DMAPP[42-43]。
在破囊壶菌中,角鲨烯的生物合成途径仍在不断探索中。对少量菌株的初步研究表明,破囊壶菌以乙酰辅酶A(acetyl-CoA)作为起始反应物,反应经过MVA途径,由甲羟戊酸(mevalonate)合成IPP和其异构体3,3-二甲基烯丙基焦磷酸(DMAPP),进而由法尼基焦磷酸合酶生成法尼基焦磷酸(arnesyl diphosphate,FPP),最终合成角鲨烯[44-45];角鲨烯在有氧条件下经过角鲨烯环氧化酶的氧化作用形成(S)-角鲨烯-2,3-环氧化物,然后经过其他酶类的反应生成固醇类[46](图 1)。
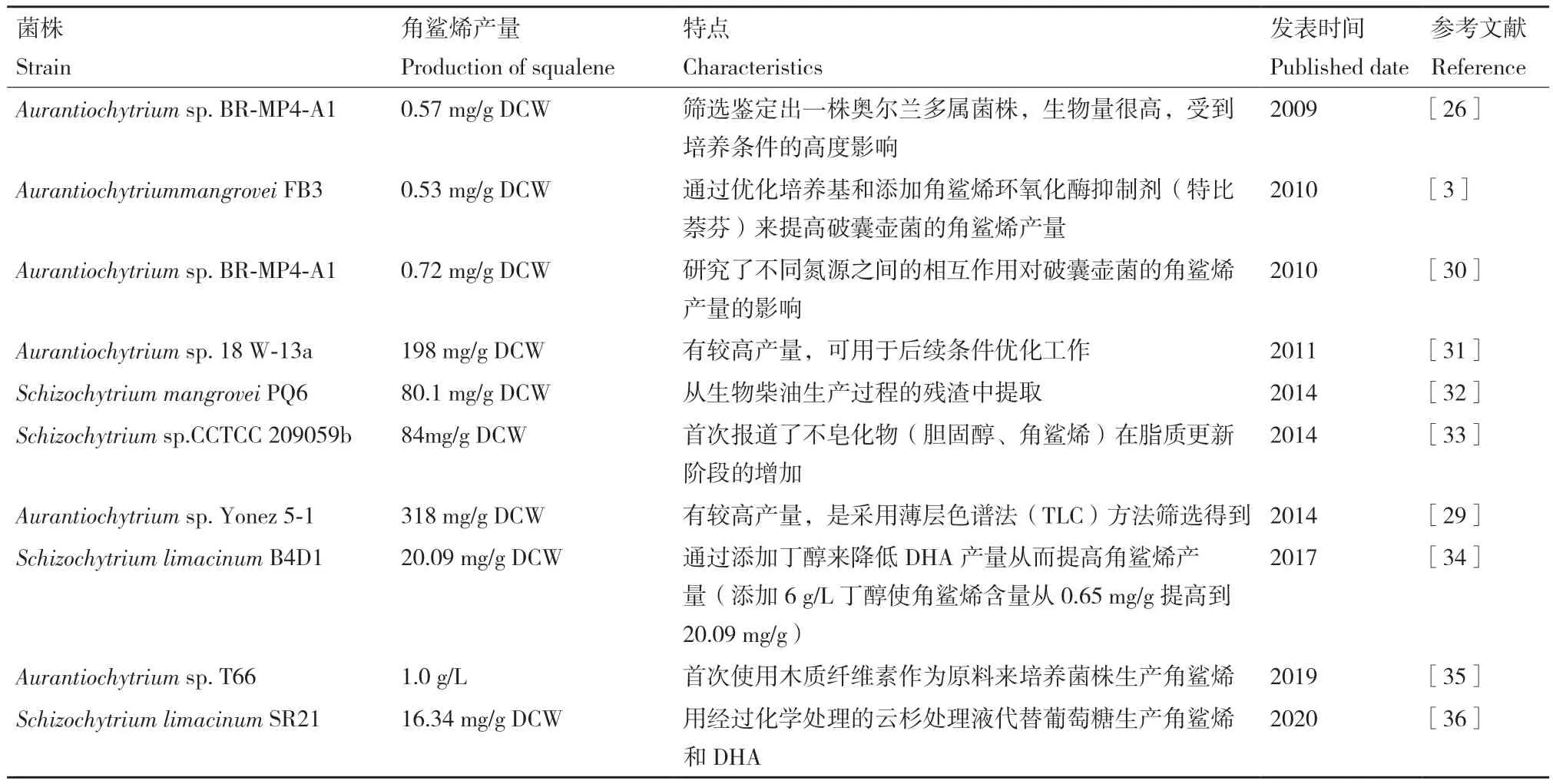
表1 现阶段研究较多生产角鲨烯的破囊壶菌菌株汇总Table 1 Summary of the most squalene-producing chytrid strains studied at the present stage
目前,对于破囊壶菌中角鲨烯合成机理的研究较少。从乙酰辅酶A下游到焦磷酸FPP的甲羟戊酸途径中涉及的所有基因都已在破囊壶菌进行了注释定位[38]。通过对 Aurantiochytrium sp.KRS101 中角鲨烯合成酶基因的研究,研究者发现了该菌株在NADPH和Mg2+存在条件下催化两分子的FPP转化为角鲨烯的缩合反应[25],这是首次对破囊壶菌中角鲨烯合成酶特征进行描述的研究报道。同时,通过对破囊壶菌Aurantiochytrium sp.TWZ-97转录组的分析,研究者成功确定了MVA和角鲨烯合成通路(图1)所涉及的羟甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGR)、角鲨烯合成酶(squalene synthase,SQS)等7个关键酶的基因,这是迄今为止对破囊壶菌产角鲨烯生物合成通路的一个较完整的研究[47]。但是,角鲨烯在破囊壶菌中的合成机理及其调控机制仍未完全阐明,亟待研究其代谢通路中关键基因功能以及基因结构,全面揭示角鲨烯合成的分子机理。
目前已有不少通过修饰MVA和角鲨烯合成通路中的关键基因来提高微生物角鲨烯产量的报道[50]。例如,利用分子生物学手段过表达酿酒酵母中的HMG-CoA还原酶,使工程菌株的角鲨烯生产能力相比野生菌株增加了20倍[25];通过向酿酒酵母转入质粒提高其FPP编码基因的表达,使细胞中的角鲨烯和麦角固醇明显积累,其中角鲨烯产量高达9 mg/g DCW,而野生菌株只生产了微量角鲨烯[51];将MVA通路上5种主要酶(HMGs、HMGR、MK、IDI和DMAPP)的编码基因整合到单一操纵子并转化到大肠杆菌中进行表达,结果发现角鲨烯产量高达230 mg/L[42]。将含有高表达与正常表达SQS的质粒分别转入大肠杆菌中进行表达发现,高表达SQS获得的角鲨烯产量为4.2 mg/L,而正常表达SQS获得的角鲨烯产量仅为3.5 mg/L[42]。通过敲除酿酒酵母SHY3的角鲨烯环氧化酶,使得菌株的角鲨烯积累量提高了5 mg/g DCW[52]。目前,相关研究主要集中于酵母和大肠杆菌,而将代谢工程手段用于提高破囊壶菌角鲨烯产量的研究还很少。对破囊壶菌角鲨烯生物合成通路及代谢机理的研究,可以为今后利用分子生物方法提高角鲨烯产量提供有价值的遗传信息。
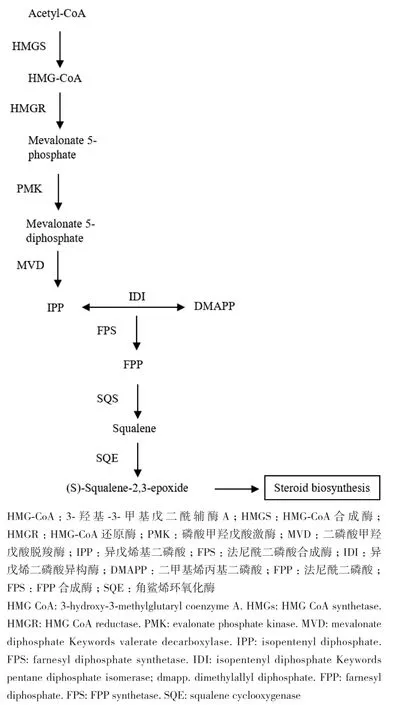
图1 破囊壶菌合成角鲨烯通路[48-49]Fig. 1 The pathway of squalene synthesis by Thraustochytrids[48-49]
3 影响破囊壶菌生产角鲨烯的因素
微生物生产高附加值代谢产物不仅受到自身遗传因素的影响,而且与外部营养和环境条件息息相关[24]。同样,破囊壶菌的角鲨烯生物合成也受许多环境因子的影响,包括碳氮源、温度、溶解氧、pH、盐度等[53]。因此发酵条件的优化是利用破囊壶菌生产角鲨烯必不可少的一个环节[54]。
3.1 碳氮源
破囊壶菌属于异养型原生生物,在其发酵过程中必须添加适量的碳源和氮源,才能有足够的物质和能量维持自身的繁殖和代谢。碳氮源的种类和浓度,对破囊壶菌的生长繁殖速度、脂质累积速度和角鲨烯合成速度均有很重要的影响[55]。
破囊壶菌能够利用葡萄糖、甘油、果糖和蔗糖等多种碳源进行生长和代谢[56],碳源的种类影响破囊壶菌的生物量和角鲨烯的生产,但是目前的研究主要集中在葡萄糖浓度优化,对碳源种类对角鲨烯产量的影响的研究相对较少[29-30]。本课题组通过评估5种不同的碳源(浓度为20 mg/L)对Aurantiochytrium sp.TWZ-97角鲨烯产量的影响,即葡萄糖、果糖、甘油、蔗糖和淀粉,以测试它们对细胞生长和角鲨烯产生的影响,发现葡萄糖是生产角鲨烯的最佳碳源[47]。一些研究通过使用廉价易得的原料代替葡萄糖来培养破囊壶菌,如破囊壶菌Aurantiochytrium sp. T66以木质纤维素水解液为原料获得的角鲨烯产量达1 g/L[35],同时Schizochytrium limacinum SR21使用经化学预处理的云杉木质纤维素水解液代替葡萄糖来生产角鲨烯(角鲨烯产量16.34 mg/g DCW)[36],裂殖壶菌属的 Schizochytrium sp.KH105以葡萄糖和酒厂废水为粗碳氮源进行发酵(角鲨烯产量3.4 g/L)[24]等。破囊壶菌常用的氮源包括酵母粉、蛋白胨、胰蛋白胨、谷氨酸钠、玉米浆、尿素等有机氮源及硫酸铵、乙酸铵、硝酸铵等无机氮源[57]。不同氮源对不同破囊壶菌菌株的生长和角鲨烯积累的影响具有很大差异,在Aurantiochytrium sp. BR-MP4-A1生产角鲨烯的研究中,通过优化氮源,发现谷氨酸钠、酵母提取物和胰蛋白胨能促进细胞生长和角鲨烯的产生,通过优化3种氮源的最佳浓度,谷氨酸钠、酵母提取物和胰蛋白胨的最佳浓度分别为6.61 mg/L、6.13 mg/L和4.50 mg/L,角鲨烯含量和角鲨烯产量分别达到0.72 mg/g DCW和5.90 mg/L[26]。从目前总体的研究结果看,葡萄糖为破囊壶菌产角鲨烯的最优碳源,谷氨酸钠、酵母提取物和胰蛋白胨为最优氮源。
针对碳氮源的研究,除了选择适当的碳氮源种类外,碳氮源的浓度也是影响破囊壶菌细胞生长和代谢的重要因素[58]。在较低浓度范围内,随着碳源浓度的升高,破囊壶菌的生长速度加快;当碳源浓度增加到一定量时,其生长速度会减缓甚至生长受到抑制[59]。氮源浓度的升高能够促进菌体的生长,但不利于油脂以及角鲨烯的积累[60]。破囊壶菌Schizochytrium mangrovei PQ6在以酵母提取物为唯一氮源时,在浓度为0.5%-4%范围内,1%的酵母提取物浓度对角鲨烯的产生和细胞的生长最有利[32]。当以葡萄糖为碳源时,葡萄糖浓度变化对角鲨烯的产量也有很大的影响。表2列举了一些破囊壶菌在最佳碳源条件下的角鲨烯产量。将葡萄糖浓度优化至30 g/L时,破囊壶菌Aurantiochytrium mangrovei FB3的角鲨烯含量提高到2.21 mg/L[3]。破囊壶菌Aurantiochytrium sp. TWZ-97在10 g/L-40 g/L葡萄糖浓度之间培养,角鲨烯浓度没有显著变化[47]。与之相反的是,尽管破囊壶菌Aurantiochytrium sp.18W-13a的生物量随葡萄糖浓度(20 g/L-90 g/L)的增加而增加,但其角鲨烯产量(mg/g DCW)却降低了[61]。这些相异的结果表明,在不同浓度碳源的影响下,同一属的不同菌株可能显示出不同的生长特性。因此,了解菌株的生理对于培养策略的优化至关重要。
总之,不同破囊壶菌菌株对碳源和氮源的选择性不同,因此在实际操作中应当针对不同菌株使用不同的培养基成分及配比。葡萄糖是最常用的碳源,谷氨酸钠、酵母提取物和胰蛋白胨是最合适的氮源。同时,在生产中应适当考虑实际效益情况,尽量选择来源广、易获取,价格低的原料进行生产,尽量降低生产成本,以获得最大的经济效益。
3.2 盐度
海洋微生物因其生长环境而表现出对NaCl 特殊的敏感性,NaCl 不仅可以维持细胞内渗透压平衡,而且还参与酸碱平衡调节、氨基酸利用等一系列代谢活动[26]。因此,NaCl 浓度是影响海洋微生物发酵生产的重要环境因子[63]。破囊壶菌的生长代谢也受到 NaCl 浓度影响,在保持渗透压平衡的前提下适量减少培养基中 NaCl 浓度可以促进其细胞增殖,其生长速度和脂肪酸产量均有一定程度提高[64]。角鲨烯的产量受NaCl浓度的影响很大,在较高NaCl浓度条件下角鲨烯产量和生物量均有不同程度的降低。例如,Aurantiochytrium sp. 18W-13a在25%-50% 的海水浓度条件下,角鲨烯产量达到最大值0.9 g/L(171 mg/g DCW),比先前报道的产量高出几百倍,当75% 海水浓度条件下,角鲨烯产量和生物量显著降低[61,65]。同样,破囊壶菌 Aurantiochytrium sp.TWZ-97在(0-7.5)g/L NaCl浓度范围内,菌株的生长无明显变化(10.4±0.26)g/L,当NaCl浓度为2.5 g/L时角鲨烯产量最高,为125.2 mg/L,是空白的1.89倍;然而,当培养基中NaCl浓度高于7.5 g/L时,破囊壶菌的生物量和角鲨烯浓度下降[47]。以上研究表明NaCl 浓度对破囊壶菌的生长及其代谢产物的合成积累均有较大影响。但 NaCl影响角鲨烯合成的机理尚未明确,文献中也鲜有报道。
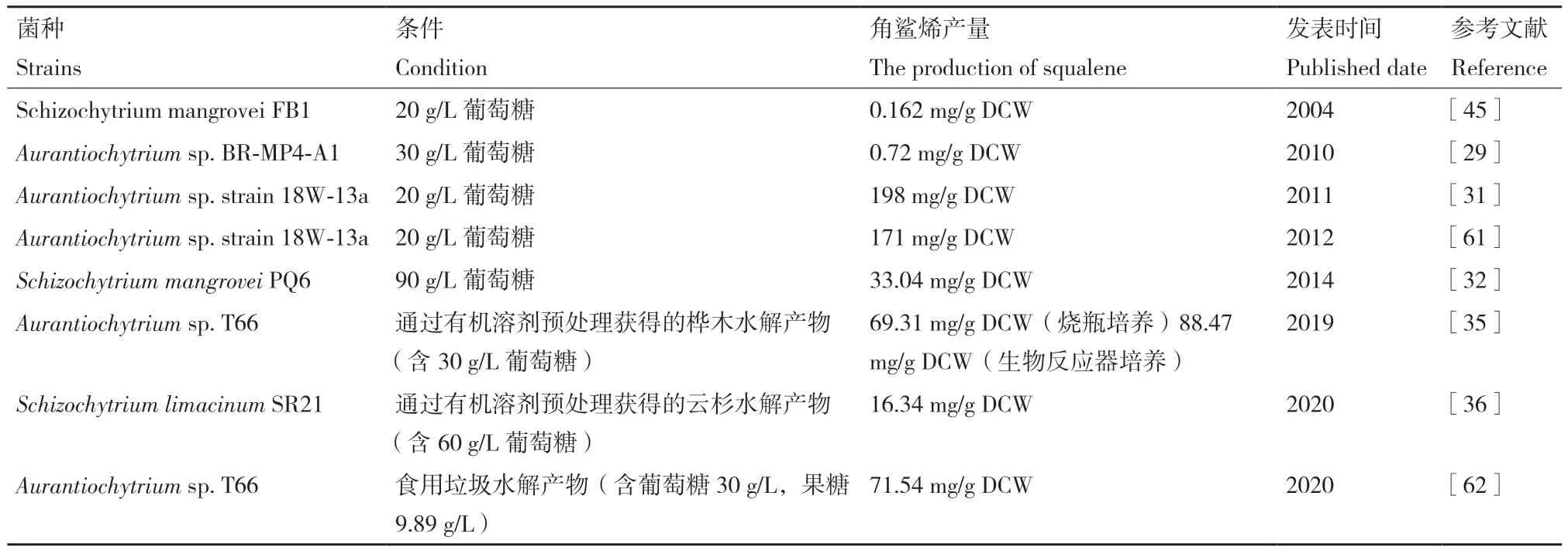
表2 海洋破囊壶菌在最佳碳源条件下的角鲨烯产量Table 2 Squalene production of marine Thraustochytrids under optimal carbon source conditions
3.3 培养时间
在有氧培养条件下,随着培养时间的延长,角鲨烯含量会减少,这可能与角鲨烯向固醇等下游代谢产物的转化有关[66]。角鲨烯是固醇生物合成的关键中间体,并且角鲨烯环氧化酶催化在固醇途径中利用角鲨烯的第一步是生成(S)-角鲨烯2,3-环氧化物,这是一个需要氧气的步骤[67]。足够的分子氧浓度对于此步骤的活性至关重要[68]。因此,细胞角鲨烯在有氧条件下会被进一步代谢以合成固醇,而不是在当前的富氧条件下积累。
为了防止角鲨烯的进一步氧化,培养时间的准确把握是优化破囊壶菌角鲨烯产量的重要条件。针对不同的菌株,角鲨烯产量达到最高值的培养天数常常不同。例如,破囊壶菌Aurantiochytrium sp. T66的角鲨烯产量从培养24 h的0.05 g/L增加到96 h的0.72 g/L,继续培养到第120 h角鲨烯产量下降到0.44 g/L[35]。破囊壶菌 Schizochytrium mangrovei FB1 培养3 d后角鲨烯含量达到最高值0.16 mg/g DCW,5 d后仅为 0.04 mg/g DCW[45]。Aurantiochytrium mangrovei FB 3在固定的葡萄糖浓度下,角鲨烯含量和产量在指数生长期(第1天)达到最高2.21 mg/L,但从第2天(初始稳定期)开始下降,从培养的第1天到第5天,角鲨烯含量和产量分别下降了至少10倍和4 倍[3]。破 囊 壶 菌 Aurantiochytrium sp. BR-MP4-A1的角鲨烯含量与培养时间高度相关,角鲨烯的最高含量在36 h(0.567 mg/g DCW)达到,但此后迅速下降[26]。与上述结果不同,Schizochytrium mangrovei PQ6的角鲨烯含量分别在培养的第4天和第5天达到最大值,分别为12.56 g/L和60.97 mg/g DCW。这种差异可能是由不同菌株的生长代谢特性所致[32]。
3.4 中试放大
微生物在生物反应器中的放大培养,是在实验室小规模培养试验的基础上,模拟工业化条件所进行的工艺研究,其目的是验证相关工艺流程规模化运行的可行性,以及菌株是否具有放大培养和工业化生产的潜力,从而为正式商业化生产的工艺设计提供数据[69]。
破囊壶菌Schizochytrium mangrovei PQ6分别在30 L和150 L生物反应器中培养生产角鲨烯,获得的含量均为33 mg/g DCW,产量分别达到0.99 g/L和1.01 g/L[32]。本课题组的研究发现,Aurantiochytrium sp. TWZ-97在250 mL摇瓶中角鲨烯产量为140.4 mg/L,当在5 L发酵罐中进行放大实验时,角鲨烯产 量 为 188.6 mg/L[47]。Aurantiochytrium sp. T66 在250 mL烧瓶中培养时,最大角鲨烯产量为69.31 mg/g DCW(0.72 g/L),但在1 L生物反应器中培养时,其最大产量增加至88.47 mg/g DCW(1.0 g/L)[35]。
在目前的破囊壶菌放大试验中,由于物理或化学参数在放大前后会有所改变,因此实验室和工业规模的生物反应器中培养条件和细胞的生理状态存在显著差异[70],会影响角鲨烯的产量和质量[71-72]。现有的放大技术难以实现破囊壶菌发酵低能耗、高效率、高产角鲨烯的目标[73],因此对其进行放大发酵研究仍然是工业化生产的一大难点。
4 激素对角鲨烯产量的调控
为了进一步提高微生物发酵生产角鲨烯的效率,除优化其培养的环境条件外,角鲨烯生物合成途径中关键酶活性的代谢调控也是研究热点之一[74]。
茉莉酸甲酯(MeJA)是一种有效的脂类调节剂,可以调节植物的各种生理过程,如生长、衰老、生殖以及对机械损伤和发病的反应[75-76]。在有关茉莉酸甲酯对角鲨烯生物合成影响的众多研究中,主要通过提高角鲨烯合成酶的活性来促进角鲨烯产量[77],目前对角鲨烯生物合成通路中其它调控位点的影响还不明确[78]。0.1 mmol/L浓度的茉莉酸甲酯加入到Schizochytrium mangrovei培养基中,导致角鲨烯在48 h迅速积累,达到未处理组的1.6倍[74]。在Chlamydomonas reinhardtii培养过程中加入1 mmol/L茉莉酸甲酯发现,茉莉酸甲酯抑制了细胞的生长,并且加入茉莉酸甲酯后与对照组相比,角鲨烯产量增加了4倍,同时发现MEP通路中5种酶的编码基因的表达水平均上调[79]。茉莉酸甲酯对角鲨烯产量的提高有一定的作用,并且提高了角鲨烯合成酶的活性,但是其对通路上其他酶活性的影响还需要进一步研究。
特比奈芬是一种著名的角鲨烯环氧化酶抑制剂,抑制该酶的活性可防止角鲨烯进一步降解,并可能增加角鲨烯在细胞中的积累[80]。在培养Chlamydomonas reinhardtii过程中加入50 mg/L特比奈芬,角鲨烯产量达到18.7 nmol/mg DCW,当特比奈芬浓度提高到150 mg/L时,细胞被杀死,并且未检测到角鲨烯和固醇,说明角鲨烯环氧酶活性是固醇生物合成和细胞存活所必需的[81]。在3种硅藻Phaeodactylum tricornutum,Thalassiosira pseudonana和Chaetoceros muelleri中加入10 μmol/L特比奈芬,未观察到角鲨烯积累,但是观察到其它固醇成分的微小变化,说明硅藻对特比奈芬不敏感,并且特比奈芬可以作用于除角鲨烯环氧化酶以外的其它酶类[78]。10 mg/L和100 mg/L特比奈芬浓度使破囊壶菌Aurantiochytrium mangrovei FB3的角鲨烯产生明显的积累,与对照组相比,角鲨烯含量分别增加36%和 40%[45]。破囊壶菌 Schizochytrium mangrovei PQ6在加入特比奈芬培养的条件下发生轻微的细胞生长抑制,同时角鲨烯产量显著增加至100 mg/L,与对照组相比增加了56.44%[32]。因此,特比奈芬对破囊壶菌角鲨烯产量的促进作用因菌株而异,并且相关的生物学机制仍有待进一步深入探究。
综上所述,添加合适的激素类物质可以不同程度促进破囊壶菌的角鲨烯产量,但是国内外学者在这方面的研究仍然有限。我们不仅要继续发掘能促进角鲨烯生产的激素类物质,还需要对这些物质影响角鲨烯生产的机理进行研究,以更好更快的实现破囊壶菌角鲨烯制品的工业化生产。
5 结语
随着生活水平的不断提高,人们对角鲨烯的认识不断深入,传统鲨鱼肝油和植物籽油的来源已越来越难满足人们对角鲨烯产品日益增长的需求。因此,作为潜在的替代来源,海洋微生物发酵生产角鲨烯具有深入研究发展的需要。为了提高破囊壶菌的角鲨烯产量,目前的研究主要集中在菌株的分离筛选、培养基及培养条件的优化、发酵工艺流程改进等方面。为了进一步提升破囊壶菌生产角鲨烯的能力,未来的研究可以从角鲨烯合成通路入手,通过对角鲨烯合成通路中的基因及相关酶的研究,调控其关键酶基因的表达,最终运用分子生物手段提高角鲨烯的产量。虽然当前对破囊壶菌代谢途径的研究及基因改造已取得初步进展,但是利用破囊壶菌大规模生产角鲨烯仍面临诸多困难,包括由于目前高产角鲨烯的原始菌株少,细胞生长和角鲨烯产量不稳定,角鲨烯在破囊壶菌中的合成机理及其调控机制仍未完全阐明,能够提高角鲨烯产量的激素类物质种类少等。因此,未来仍应继续筛选高产角鲨烯的破囊壶菌并优化其培养发酵条件,深入研究角鲨烯生物合成通路中关键基因的结构和功能并全面揭示角鲨烯合成的分子机理,同时应进一步探索激素类物质对破囊壶菌角鲨烯积累过程的影响,为实现破囊壶菌生产角鲨烯的工业化应用奠定理论基础,从而推动角鲨烯在医药、食品、保健品、化妆品等诸多领域的应用。
