蒲公英多酚提取工艺优化及抗氧化活性研究
2021-05-11崔艳平聂玮迟晓君岳凤丽陈剑飞范艺源李雪丽姚梦园
崔艳平 聂玮 迟晓君 岳凤丽 陈剑飞 范艺源 李雪丽 姚梦园

摘要:为研究蒲公英多酚的利用价值以及后续的开发,采用超声波微波提取蒲公英超微粉中多酚,在单因素的基础上,通过Box-Behnken和响应面法对提取多酚的工艺条件(包括乙醇体积分数、料液比、微波时间、超声时间、超声功率、微波功率、提取温度)进行优化,确定最佳提取工艺为乙醇体积分数50%、料液比1∶45、微波时间3min、超声时间60min、超声功率240W、微波功率350W、提取温度50℃,在上述条件下,多酚提取率是2.96%。结果表明,蒲公英多酚具有清除DPPH自由基、ABTS自由基的能力,并对铁的还原也有一定的作用。
关键词:蒲公英超微粉;超声波微波提取;多酚;工艺优化;抗氧化活性
中图分类号R284.2文献标识码A
文章编号0517-6611(2021)08-0175-06
doi:10.3969/j.issn.0517-6611.2021.08.046
开放科学(资源服务)标识码(OSID):
StudyonOptimizationofExtractionTechnologyandAntioxidantActivityofDandelionPolyphenols
CUIYan-ping1,NIEWei2,CHIXiao-jun1etal(1.SchoolofFoodScienceandEngineering,ShandongAgriculturalEngineeringCollege,Jinan,Shandong250100;2.ShandongModernCollege,Jinan,Shandong250100)
AbstractInordertostudytheutilizationvalueofdandelionpolyphenolsandsubsequentdevelopment,ultrasonicmicrowavewasusedtoextractpolyphenolsfromdandelionultrafinepowder.Onthebasisofsinglefactor,theprocessconditionsforextractingpolyphenols(includingethanolvolumefraction,solid-to-liquidratio,microwavetime,ultrasonictime,ultrasonicpower,microwavepower,extractiontemperature)wereoptimizedbyBox-Behnkenandresponsesurfacemethod.Theoptimalextractionprocesswasdeterminedtobe50%ethanolvolumefraction,1∶45solid-to-liquidratio,microwavetime3min,ultrasonictime60min,ultrasonicpower240W,microwavepower350W,extractiontemperature50℃.Undertheaboveconditions,theextractionrateofpolyphenolswas2.96%.TheresultsshowedthatdandelionpolyphenolshadtheabilitytoscavengeDPPHfreeradicalsandABTSfreeradicals,andalsohadacertaineffectonironreduction.
KeywordsDandelionsuperfinepowder;Ultrasonicmicrowaveextraction;Polyphenols;Processoptimization;Antioxidantactivity
蒲公英是中醫传统的清热解毒药物,全草药用价值很高,含有生物碱类、有机酸类和黄酮类等活性成分[1-2]。蒲公英性味甘,微苦、寒,归肝、胃经,具有利尿、缓泻、退黄疸、利胆等功效[3]。目前对蒲公英多酚的研究相对较少,该试验采取超声波微波对蒲公英多酚提取条件进行优化,并对其抗氧化活性进行研究,为蒲公英的进一步开发利用提供技术依据。
1材料与方法
1.1试材蒲公英,打成粉后过300目筛。无水乙醇,分析纯;95%乙醇,分析纯;无水碳酸钠,分析纯;福林酚试剂;没食子酸;DPPH(1,1-二苯基-2-苦肼基);VC(抗坏血酸);ABTS;过硫酸钾(K2S2O8),分析纯;磷酸二氢钠,分析纯;磷酸氢二钠,分析纯;铁氰化钾,分析纯;三氯乙酸,分析纯;三氯化铁,分析纯。
1.2仪器与设备
CW130粉碎机,上海天祥·健台制药机械有限公司;KH-6HMTN微波农产品干燥杀菌设备,山东科弘微波能有限公司;XO-SM200超声波微波组合系统,南京先欧仪器制造有限公司;TGL-16M台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;V5000型可见分光光度计,上海元析仪器有限公司;LE104E/02电子天平,梅特勒-托利多仪器(上海)有限公司。
1.3试验方法
1.3.1蒲公英超微粉的制备。
将粉碎后的蒲公英过80目标准筛。称取过筛后的粉500g,在超微粉碎机风速为1.0~2.0m/s、超微粉碎机转速3000r/min、粉碎时长20min、蒲公英粗粉含水量10%的条件下,将蒲公英粗粉进行粉碎,此时蒲公英大于300目的超微粉出粉率较高。
1.3.2蒲公英多酚的提取。
准确称取2.0g蒲公英粉,加入乙醇溶液,放入超声波微波组合系统中,在不同条件下提取蒲公英多酚。超声波提取后放入离心机中,以3500r/min的速度离心10min,得到的上清液即为蒲公英多酚提取液。
1.3.3多酚含量测定。
测定方法选取福林酚法。对蒲公英多酚提取液进行稀释,取1.00mL提取稀释液,对福林酚试剂进行10倍稀释后,取1.5mL稀释液,再加入7.5%的碳酸钠溶液2.5mL,室温条件下暗室反应1h,在波长为765nm处测定其吸光度[4-5]。
1.3.4标准曲线的绘制。在100mL容量瓶中放置准确称取的0.0100g没食子酸标准品,然后用蒸馏水稀释并定容至刻度,摇晃均匀,得到质量浓度为100μg/mL的没食子酸标准溶液。洗净7个10mL比色管,做上标记,按标记移取标准溶液0、0.1、0.2、0.4、0.6、0.8、1.0mL,加入福林酚试剂1.5mL、7.5%碳酸钠溶液2.5mL,蒸馏水定容,摇匀。将比色管置于黑暗环境中反应1h,于765nm处测其吸光度,平行3次,取平均值绘制标准曲线,得到线性回归方程为Y=0.0105X+0.0125(R2=0.999),具有良好的线性关系[6-7]。
1.3.5蒲公英多酚提取工艺优化(单因素试验)。
根据文献[8]得出,影响蒲公英多酚提取的因素有乙醇体积分数、料液比、微波时间、超声时间、超声功率、微波功率、提取温度。
1.3.6抗氧化活性研究。
在提取多酚最佳工艺的基础上,分别研究蒲公英多酚对DPPH自由基、ABTS自由基的清除能力以及还原铁离子的能力。
1.3.6.1DPPH自由基清除能力的测定。
称取8.0mgDPPH溶解于无水乙醇中,定容到200mL棕色容量瓶中,得DPPH溶液浓度为0.004mmol/L,避光保存,备用。
分别取0.01、0.03、0.05、0.07、0.09mg/mL的样品溶液1mL,置于10mL比色管,加入3mLDPPH使用液,摇匀,在黑暗条件下室温保存30min,在517nm波长处测吸光度。空白对照采用无水乙醇,平行3次,可求清除率的平均值。并以VC做阳性对照[9]。
DPPH自由基清除率=(1-Ai-AjA0)×100%(1)
式中,A0为1mL无水乙醇和3mLDPPH使用液的吸光度;Ai为1mL样品溶液和3mLDPPH使用液的吸光度;Aj为1mL样品溶液和3mL无水乙醇的吸光度。
1.3.6.2ABTS自由基清除能力的测定。
取7.4mmol/LABTS溶液0.2mL与2.6mmol/LK2S2O8溶液0.2mL混合,暗室反应12h,用无水乙醇稀释50倍,在测得734nm处的吸光度为0.70±0.02的条件下,制得ABTS+使用液。取3.2mL使用液与95%乙醇0.8mL振摇10s以充分混合,静置6min,测得734nm处的吸光度记为A0,取3.2mL使用液与样品溶液0.8mL振摇10s以充分混合,静置6min,测得734nm处的吸光度记为A[10]。
ABTS自由基清除率=A0-AA0×100%(2)
1.3.6.3铁离子还原力的测定。
将多酚母液稀释成0.02、0.04、0.06、0.08、0.10mg/mL不同浓度梯度的溶液。分别取1mL多酚样液,加至10mL比色管中,加入1mLpH=6.6的磷酸鹽缓冲液和1mL质量分数为1%的铁氰化钾溶液,在50℃条件下水浴保温时间为20min,然后冷却至室温,加入1mL质量分数为10%的三氯乙酸溶液[11],备用。另取若干10mL比色管,分别加入lmL上述多酚处理样溶液、蒸馏水2mL和1mL质量分数为0.1%的三氯化铁溶液,混匀,静置10min,在700nm处测定吸光度,以吸光度大小表示还原力强弱,用VC做标准对照[12]。
2结果与分析
2.1蒲公英多酚提取单因素试验
2.1.1乙醇体积分数。
为探索乙醇体积分数对多酚提取率的影响,固定料液比1∶40、微波时长2min、超声时长30min、超声功率270W、微波功率350W、提取温度40℃,在乙醇体积分数分别为40%、50%、60%、70%、80%时提取蒲公英多酚,计算多酚提取率,结果如图1所示。随着乙醇体积分数的升高,提取率先上升后下降,多酚提取率达到最高时,乙醇体积分数为50%,提取率为1.65%。原因在于乙醇体积分数的增加使蒲公英多酚溶解增加,利于提取,提取率增大;随着乙醇体积分数继续增大,可能会使有机溶剂与蒲公英多酚极性差异变大,多酚提取率降低[13]。因此,选取乙醇体积分数50%为蒲公英多酚最佳提取条件。
2.1.2料液比。
为探索料液比对多酚提取率的影响,固定乙醇体积分数50%、微波时长2min、超声时长30min、超声功率270W、微波功率350W、提取温度40℃,在料液比分别为1∶30、1∶35、1∶40、1∶45、1∶50(g∶mL)时提取蒲公英多酚,计算多酚提取率,结果如图2所示。随着料液比的不断升高,蒲公英多酚提取率先上升后下降,料液比为1∶45时,多酚提取率最高,为2.76%。分析原因可能是随着提取液体积的增多,蒲公英多酚扩散的压力差增大,更有利于溶解在提取液中,多酚提取率增大;继续增大溶剂比例,压力差变化不明显,并且总体积增大导致多酚浓度降低不利于提取,因此采用1∶45的料液比作为蒲公英多酚最佳提取条件[14]。
2.1.3微波时间。为探索微波时间对多酚提取率的影响,固定乙醇体积分数50%、料液比1∶40、超声时长30min、超声功率270W、微波功率350W、提取温度40℃,在微波时间分别为1、2、3、4、5min时提取蒲公英多酚,计算多酚提取率,结果如图3所示。随着微波时间的延长,蒲公英多酚提取率先上升后下降,提取率达到最高的微波时长为2min,多酚提取率为2.84%。分析原因可能是随着时间的增长,有利于多酚物质的溶出,提取率升高,在2min时达到最佳提取率,超过2min后,体系温度升高,多酚氧化分解,从而提取率下降[15]。因此,选取2min微波时间作为蒲公英多酚最佳提取条件。
2.1.4超声时间。
为探索超声时间对多酚提取率的影响,固定乙醇体积分数50%、料液比1∶40、微波时长2min、超声功率270W、微波功率350W、提取温度40℃,在超声时间分别为30、40、50、60、70min时提取蒲公英多酚,计算多酚提取率,结果如图4所示。随着超声时间的延长,提取率整体趋势先上升后下降,多酚提取率最高为超声时间60min时,提取率为2.63%。原因可能是随着时间延长,提取越完全,提取率升高,在超声时间60min时提取率达到最大值,超过60min后,时间越长,热敏物质如乙醇挥发量增大,从而使得多酚提取率降低[16]。因此,60min的超声时间是蒲公英多酚最佳提取条件。
2.1.5超声功率。
为探索超声功率对多酚提取率的影响,固定料液比1∶40、微波时长2min、超声时长30min、乙醇体积分数为50%、微波功率350W、提取温度40℃,在超声功率分别为180、210、240、270、300W时提取多酚,计算多酚提取率,结果如图5所示。随著超声功率逐渐升高,提取率呈现出先上升后下降的趋势,并在270W最高,提取率为2.89%。分析原因可能是超声功率的增大使超声波振动强度增大,能够更彻底地将多酚溶于提取液中,在超声功率270W时,提取率达到最大;提取率下降在于当功率增大时,被损坏的多酚化合物增多。因此,270W的超声功率是蒲公英多酚最佳提取条件。
2.1.6微波功率。
为探索微波功率对多酚提取率的影响,固定料液比1∶40、微波时长2min、超声时长30min、乙醇体积分数50%、超声功率300W、提取温度40℃,在微波功率分别为200、250、300、350、400W时提取多酚,计算多酚提取率,结果如图6所示。随着微波功率的逐步升高,提取率呈现出先上升后下降的趋势,多酚提取率最高在微波功率为350W时,提取率为2.66%。微波辅助提取法是利用磁控管所产生的高频率振动使蒲公英细胞内的分子相互碰撞、挤压,从而使多酚类化合物快速浸出的方法[17]。分析原因可能是随着微波功率的增大,会出现分子碰撞破坏细胞导致其他杂质溶于提取剂,多酚与杂质发生反应,致使多酚含量降低,提取率下降。因此,选取350W为蒲公英多酚最佳提取条件。
2.1.7提取温度。
为探索提取温度对多酚提取率的影响,固定料液比1∶40、微波时长2min、超声时长30min、乙醇体积分数50%、超声功率300W、微波功率350W,在提取温度分别为30、40、50、60、70℃时提取多酚,计算多酚提取率,结果如图7所示。由图7可知,提取温度升高,多酚提取率先上升后下降;多酚提取率达到最高时提取温度为50℃,提取率2.90%。分析原因可能是温度的升高使分子运动加快,相同条件下多酚溶解更多,30~50℃多酚提取率逐渐增大,而随着提取温度的增加,多糖等有机物杂质增多,提取率下降。因此采用微波提取温度40℃作为蒲公英多酚最佳提取工艺[18]。
2.2响应面试验
2.2.1响应面设计及结果。
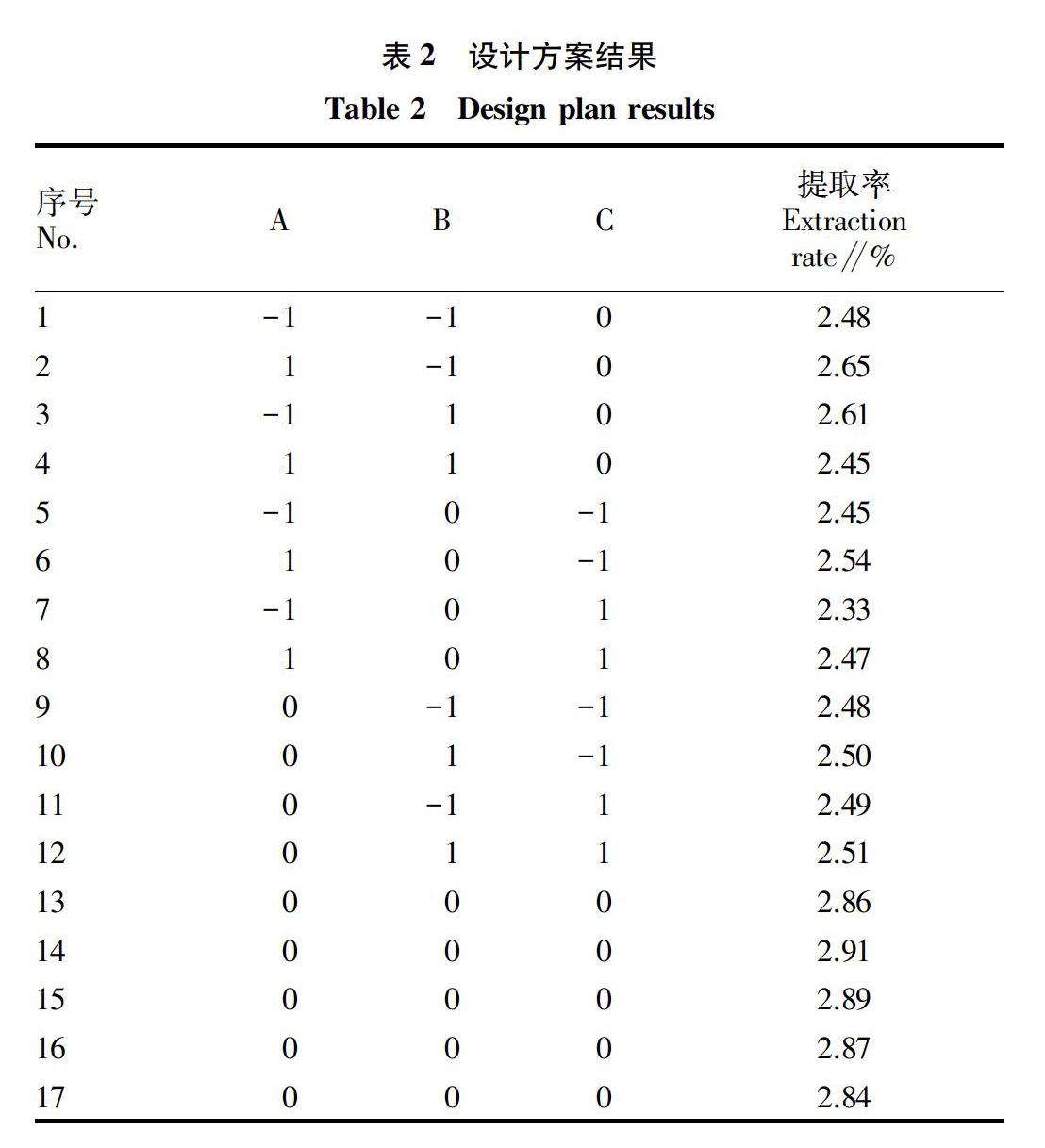
结合单因素试验,根据Box-Behnken的原理[19],利用响应面探究微波时间、提取温度、超声功率对蒲公英多酚提取的影响,固定乙醇体积分数50%、料液比1∶45、超声时间60min、微波功率350W。该试验共含中心点5个和试验点17个。响应面优化条件见表1,设计方案结果见表2。
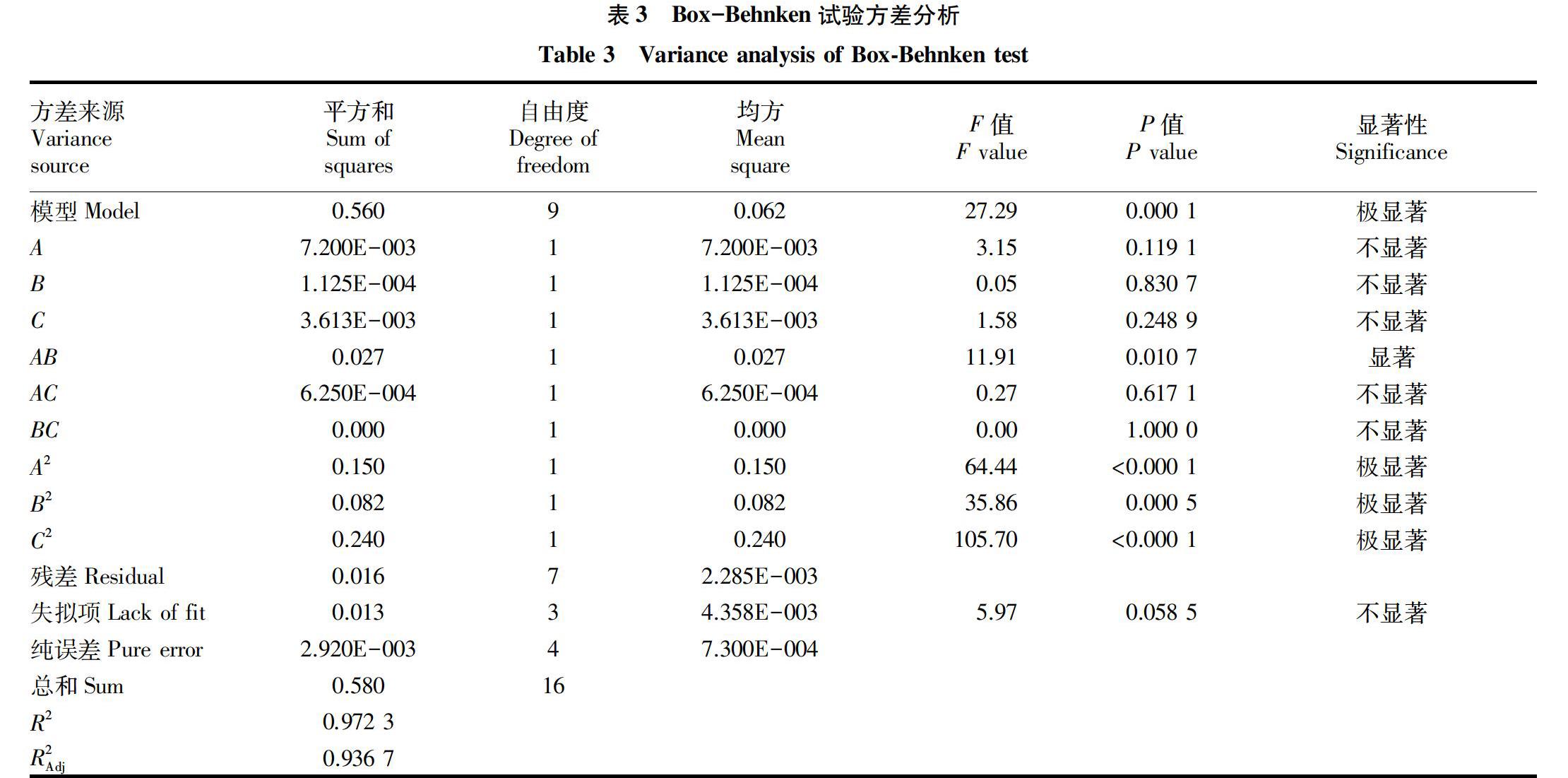
2.2.2二次回归模型拟合及模型分析。利用响应面对试验数据进行回归拟合,得到多酚得率的多项回归模拟方程为Y=2.870+0.030A-0.004B-0.021C-0.083AB+0.013AC+0.000BC-0.190A2-0.140B2-0.240C2。由表3可知,此试验结果F值(27.29)较高和P值(0.0001)较低,表明该模型具有极显著差异。失拟项的F值为5.97,P值为0.0585,说明失拟不显著,即该模型的拟合性良好。该模型的R2Adj为0.9367>0.80,说明此模型至少可以解释93.67%的响应值变化。R2=0.9723,说明实际值与方程预测值的相关性良好。信噪比AdeqPrecision=13.372>4,表明该模型的拟合度和可信度极高。由各单项的F值可以看出,分析条件对多酚提取影响程度从大到小依次为A(微波时间)、C(超声功率)、B(提取温度)。从二次项F值可以看出A2、B2和C2对响应值的差异极显著,F值普遍较高,而且在回归方程中,这3项的系数均为负值,说明超过此因素的最大值时,随着微波时间、提取温度、超声功率的增大,其提取率会下降,此结论与单因素试验结果相符。在此模型中,A2、B2和C2对蒲公英多酚的提取影响极显著。由图8可见,AB对蒲公英多酚提取的影响显著,其他均为不显著,由此可以看出各试验条件对于多酚提取的影响不是单纯的线性关系。从交互项来看,AC、BC的F值均较小,说明其对多酚提取率的影响不显著,所以超声功率对多酚得率的影响是相对独立的。
2.3蒲公英多酚抗氧化活性研究
2.3.1DPPH自由基清除能力的测定。由图9可见,蒲公英多酚提取物有清除DPPH自由基的能力,在多酚溶液浓度升高时,对DPPH的清除能力增大。多酚浓度为0.01~0.03mg/mL时对DPPH自由基的清除较快;在0.03~0.09mg/mL时对DPPH自由基的清除较缓慢。
2.3.2ABTS自由基清除能力的测定。
由图10可知,蒲公英多酚提取物对ABTS自由基有一定的清除能力,并且随着多酚溶液浓度的升高,ABTS的清除率增大。总体来说,多酚提取物浓度的增大,清除ABTS自由基速度较DPPH自由基增加迅速。
2.3.3铁离子还原力的测定。蒲公英多酚提取物还原铁离子强度与吸光度呈正相关,从图11可以看出随着多酚提取物浓度的增加,吸光度逐渐增加,还原铁离子强度也逐渐增强,并且趋近于线性增长。
3结论
根据单因素试验及响应面试验结果,得出超声波微波提取蒲公英多酚的最佳工艺条件为乙醇体积分数50%、料液比1∶45、微波功率350W、超声时间60min、微波时间3.18min、提取温度49.22℃、超声功率237.47W,根据上述因素蒲公英多酚提取率为2.88%,实际值为2.96%。说明此试验方法可以用来进行蒲公英多酚的提取。考虑到实际操作,微波时间、提取温度、超声功率可依次调节为3min、50℃、240W。
参考文献
[1]
杨怡萌,陈星宇,吴娅,等.蒲公英黄酮抗氧化活性的构效关系分析[J].化学通报,2020,83(11):1031-1037.
[2]GRAUSOL,EMRICKS,DEFALCOB,etal.Commondandelion:Areviewofitsbotanical,phytochemicalandpharmacologicalprofiles[J].Phytochemistryreviews,2019,18(4):1115-1132.
[3]崔海燕.药食两用蒲公英[J].益寿宝典,2017(14):22.
[4]王鹏,郭丽,徐连杰,等.超声波辅助提取蒲公英茶中多酚工艺优化及抗氧化特性研究[J].食品科技,2015,40(6):251-257.
[5]WANGM,LIUJR,GAOJM,etal.AntioxidantactivityofTartarybuckwheatbranextractanditseffectonthelipidprofileofhyperlipidemicrats[J].Journalofagriculturalandfoodchemistry,2009,57(11):5106-5112.
[6]王偉,訾王贝,樊海燕,等.微波辅助提取罗布麻茶茶多酚的工艺研究[J].中国食品添加剂,2012(6):151-154.
[7]段红波,梁引库.蒲公英多酚的提取及其活性研究[J].中国食品添加剂,2017(3):80-86.
[8]贤景春,赖金辉,刘玉明.小飞蓬多酚提取及其抗氧化性研究[J].南方农业学报,2012,43(11):1749-1753.
[9]龚霞,巫永华,刘恩岐,等.山楂叶提取物不同极性组分的体外抗氧化作用[J].食品工业,2016,37(8):216-219.
[10]肖敏,舒佳为,覃瑞,等.皱皮木瓜总酚酸分离纯化工艺及生物活性研究[J].中国现代中药,2018,20(3):316-322.
[11]盛伟,方晓阳,吴萍.白灵菇、杏鲍菇、阿魏菇多糖体外抗氧化活性研究[J].食品工业科技,2008,29(5):103-105,109.
[12]张灿,张康逸,孙艳敏,等.青麦仁饼干多酚及抗氧化活性在模拟胃肠消化后的变化研究[J].食品科技,2020,45(10):82-87.
[13]臧延青,何飞,李执坤,等.野生蒲公英花多酚的提取和体外抗氧化活性研究[J].黑龙江八一农垦大学学报,2017,29(4):62-66,81.
[14]曹楠楠,陈香荣,吴艳.苦豆子多糖的超声波提取工艺优化及理化性质研究[J].现代食品科技,2014,30(2):209-215.
[15]许金蓉,陶炫宏,卢笛,等.响应面优化微波辅助提取火龙果果皮中多酚工艺研究[J].轻工科技,2017,33(6):23-25.
[16]袁晶,张海燕,曾朝珍,等.超声波辅助复合酶法提取苹果多酚工艺优化[J].保鲜与加工,2019,19(6):159-163.
[17]曹会凯.山楂中黄酮类化合物的提取及成分分析[D].秦皇岛:河北科技师范学院,2013.
[18]PINELOM,RUBILARM,JEREZM,etal.Effectofsolvent,temperature,andsolvent-to-solidratioonthetotalphenoliccontentandantiradicalactivityofextractsfromdifferentcomponentsofgrapepomace[J].Journalofagriculturalandfoodchemistry,2005,53(6):2111-2117.
[19]陈宇航,岳凤丽,张洁,等.超声微波协同提取豆渣中水溶性多糖的工艺优化[J].食品工业,2017,38(6):148-152.
