暗纹东方鲀MyoD基因的克隆及生物信息学分析
2021-05-11祁艳凤尚凤芹余云登周金旭王宁王秀利
祁艳凤 尚凤芹 余云登 周金旭 王宁 王秀利
摘要 提取暗纹东方鲀肌肉的总RNA,采用RT-PCR的方法来克隆暗纹东方鲀MyoD基因的cDNA序列,并通过生物信息学分析,对该基因所编码蛋白的理化性质、亲疏水性、亚细胞定位以及蛋白质结构等进行初步的分析和预测。结果显示,该基因编码区全长为846 bp,共编码了281个氨基酸,编码蛋白为亲水性非跨膜类蛋白,无信号肽结构,其亚细胞定位于细胞核中。系统进化树分析结果表明其与红鳍东方鲀同源性最高,亲缘关系最近。
关键词 暗纹东方鲀;MyoD基因;基因克隆;生物信息学
中图分类号 S 917.4文献标识码 A
文章编号 0517-6611(2021)08-0089-05
doi:10.3969/j.issn.0517-6611.2021.08.024
开放科学(资源服务)标识码(OSID):
Cloning and Bioinformatics Analysis of MyoD Gene of Takifugu obscurus
QI Yan-feng,SHANG Feng-qin,YU Yun-deng et al (College of Fisheries and Life Science,Dalian Ocean University,Dalian,Liaoning 116023)
Abstract The total RNA of Takifugu obscurus muscle was extracted,and the cDNA sequence of MyoD gene of Takifugu obscurus was cloned by RT-PCR method.And through bioinformatics analysis,preliminary analysis and prediction of the physicochemical properties,hydrophilicity and hydrophobicity,subcellular localization and protein structure of the protein encoded by the gene were carried out.The results showed that the full length of the coding region of the gene was 846 bp,which encoded a total of 281 amino acids.The encoded protein was a hydrophilic non-transmembrane protein with no signal peptide structure,and its subcellular location was in the nucleus.The results of phylogenetic tree analysis showed that it had the highest homology with the redfin puffer and the closest genetic relationship.
Key words Takifugu obscurus;MyoD gene;Gene cloning;Bioinformatics
生肌调节因子MRFs家族包括MyoD、MyoG、Myf5和Myf6 这4种调节因子,该家族在成肌细胞的发育和分化方面都起着绝对作用[1-6]。MyoD基因作为生肌调节因子家族中的重要一员,主要负责调控脊椎动物胚胎期的肌肉发育,促进骨骼肌的形成与分化,并可以通过多种途径来达到激活肌肉转录的目的,从而促进成肌细胞的分化;如果MyoD基因缺失,可导致成肌细胞无法进行增殖和分化,從而影响个体正常的生长和发育[7-13]。暗纹东方鲀的可食用部位主要是肌肉,而MyoD基因对肌肉生长的调控作用是至关重要的,所以对暗纹东方鲀MyoD基因的研究对改良其肉质有重要意义。
暗纹东方鲀(Takifugu obscurus)别称横纹多纪鲀,属于鲀形目、鲀科、东方鲀属。暗纹东方鲀属于暖温性底层洄游性鱼类,生活于近海地带,在我国主要分布于黄海、东海、长江中下游区域。春季亲鱼溯河生殖洄游进入淡水江河直流进行繁殖,幼鱼在淡水中成长[14]。暗纹东方鲀肉质雪白且少刺,味道尤为鲜嫩可口,不仅含有大量的蛋白质和脂肪,而且还有多种人体所含的必需氨基酸以及其他营养物质,自古就享有“鱼中之王”和“菜肴之冠”的美名。在一些亚洲国家如中国、日本和朝鲜都有着久远的食用暗纹东方鲀的饮食习惯,特别是在日本市场尤为畅销,是我国十分重要的经济鱼类。暗纹东方鲀能成功地在纯淡水中养殖,有着很高的经济价值,所以暗纹东方鲀养殖业的发展是十分迅速的,目前养殖规模也比较大,其养殖区域正从沿海向内地迅速扩展。近几年,沿岸的河豚资源量因过度开发而表现出每年急剧减少的趋势,为满足市场的需求,就要扩大养殖河鲀的生产量[15-16]。目前在暗纹东方鲀的养殖技术方面研究比较广泛,但对其基因水平的了解知之甚少,还没有暗纹东方鲀MyoD基因组全序列的报道。该试验使用反转录和RT-PCR方法,对暗纹东方鲀MyoD基因进行克隆及生物信息学分析,研究其基因序列的结构、进化关系及理化性质,以期为进一步探究鱼类MyoD基因的结构与功能奠定理论基础。
1 材料与方法
1.1 材料
试验材料来自江苏南通中洋集团,随机选择健康的3尾3月龄暗纹东方鲀幼鱼作为基因克隆的试验样本;提取RNA的Trizol试剂、反转录试剂盒和Taq酶均购自TaKaRa生物工程有限公司。
1.2 方法
1.2.1 暗纹东方鲀总RNA提取与cDNA链合成。
剪取适量的暗纹东方鲀肌肉,加入液氮后进行充分研磨,使用Trizol法来提取暗纹东方鲀的总RNA。提取后通过凝胶电泳检测来验证RNA纯度是否可以用于后续试验。使用TaKaRa反转录试剂盒将RNA 反转录为cDNA,反应体系为20 μL,反应条件为37 ℃ 15 min、85 ℃ 5 s,共1个循环,4 ℃保存。反应结束后将产物保存于-20 ℃冰箱以备后续试验使用。
1.2.2 基因引物设计与合成。
参考红鳍东方鲀的MyoD基因序列(NM_001032771)设计暗纹东方鲀MyoD基因 CDS区PCR引物。使用Primer Premier 5.0软件来设计克隆基因编码区全长所需的引物。引物序列由北京六合华大基因科技有限公司合成,所合成的引物序列如表l所示。
1.2.3 基因克隆。以反转录合成的cDNA为模板,采用RT-PCR方法进行目的片段的扩增,PCR反应体系(25 μL)为ddH2O 14 μL、10×Buffer 2.5 μL、dNTP 2 μL,上游引物MyoD-F和下游引物MyoD-R各1 μL,模板 4 μL,Taq酶0.5 μL。PCR反应程序:94 ℃预变性5 min进入循环;94 ℃变性30 s,59 ℃ 退火30 s,72 ℃延伸30 s,共计35个循环,4 ℃保存。将PCR产物在浓度为1%的琼脂糖凝胶中进行电泳,结果所得条带清晰符合测序要求,送往北京六合华大基因科技有限公司测序。
1.2.4 编码蛋白生物信息学分析。该研究主要使用了生物信息学分析网站(表2)来预测和分析了编码蛋白质理化性质、蛋白跨膜区域、信号肽、亲水性、疏水性、亚细胞定位、磷酸化位点、蛋白质二三级结构及系统进化树,以期能够为后续分析该基因的功能提供基础数据。其中进化树构建中各物种氨基酸序列来自NCBI数据库,分别为红鳍东方鲀(NP_001027941.1)、人(NP_002469.2)、斑馬鱼(NP_571337.2)、罗非鱼(XP_031601968.1)、金头鲷(NM_030427111.1)、大口黑鲈(XP_643446.1)、非洲爪蟾(NP_001079366.1)、草鱼(AFL56774.1)、大鼠(NP_788268.2)、猪(NP_001002824.1)、鸡(NP_989545.2)、黄牛(NP_001035568.2)、绵羊(NP_001009390.1)、抹香鲸(XP_028357079.1)。
2 结果与分析
2.1 暗纹东方鲀总RNA提取及检测
使用Trizol法提取暗纹东方鲀肌肉的总RNA,其凝胶电泳结果显示,提取的RNA效果比较好,没有蛋白的污染。图1所展示的就是凝胶电泳检测条带,5S、18S和28S这3条带明亮清晰,且宽度也比较适宜,再通过使用分光光度仪进行检测,结果显示D260nm/D280nm的值位于1.8~2.0,表明暗纹东方鲀肌肉的RNA提取效果良好,可以用于之后的试验研究。
2.2 基因克隆
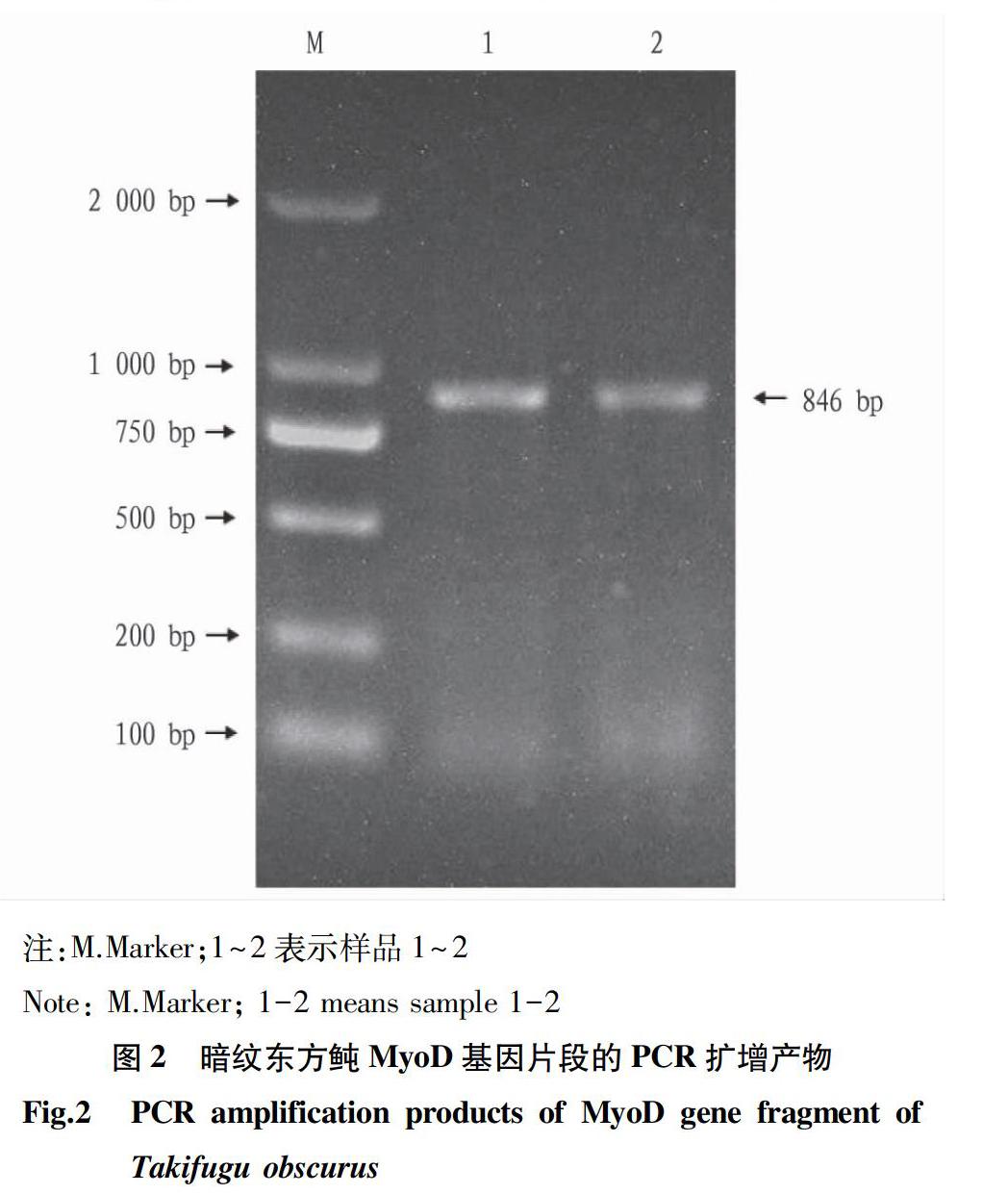
通过PCR程序扩增所得到的目的产物的凝胶电泳检测结果如图2所示。在750~1 000 bp出现了一条清晰的DNA特异条带,与预测扩增片段大小一致。由北京六合华大基因科技有限公司测序,结果所得目的基因片段长度为846 bp。将测序所得结果通过NCBI中的Blast程序与红鳍东方鲀基因组数据库该基因全长序列进行对比后,二者相似度高达99%,仅在412 bp处发生1个碱基的变化(A→G),对应所编码的氨基酸也由苏氨酸变成了丙氨酸。
2.3 生物信息学分析
通过反转录和RT-PCR对暗纹东方鲀MyoD基因的cDNA进行了克隆,得到了暗纹东方鲀MyoD基因CDS区序列。该编码区长度一共为846 bp,起始密码子和终止密码子分别为ATG、TAA。通过Primer Premier 5.0将核苷酸序列翻译成氨基酸序列,共翻译编码281个氨基酸,对其所编码蛋白继续进行生物信息学分析。
2.3.1 蛋白质理化性质分析。登陆ProtParam(https://web.expasy.org/cgi- bin/protparam/ protparam)分析MyoD基因氨基酸理化性质,结果表明,氨基酸总数为281,其中Ser、Leu和Arg含量较多,分别为16.0%、8.5%和7.8%,不含Pyl和Sec,带负电的残基总数(Asp + Glu)为35,带正电的残基总数(Arg + Lys)为32,分子式为C1321H2078N398O436S14,分子量为30 960.28 Da,脂肪指数为62.56,理论等电点为6.41,亲水性平均值(GRAVY)为-0.667,半衰期为30 h,不稳定指数为70.51,为不稳定蛋白。
2.3.2 蛋白跨膜区域预测。
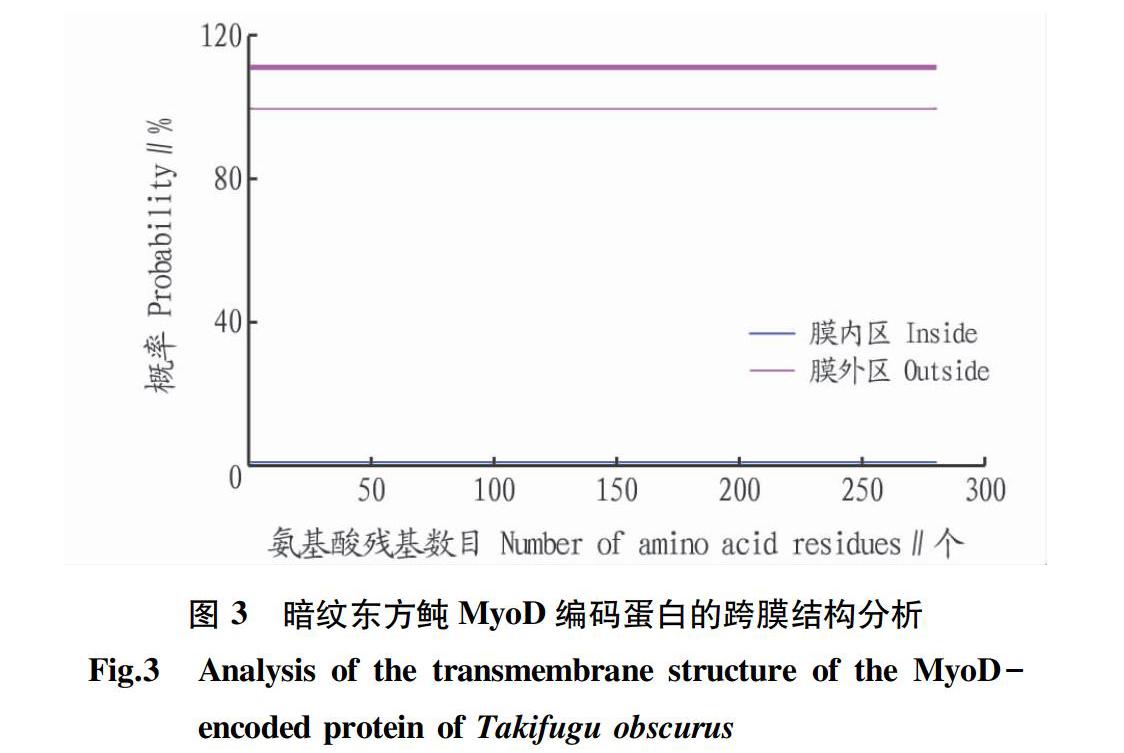
通过TMHMM Sever v.2.0(http://www.cbs.dtu.dk/ services/TMHMM/)输入暗纹东方鲀MyoD蛋白序列。暗纹东方鲀MyoD基因编码蛋白跨膜结构如图3所示,其中X轴代表氨基酸残基的数目,Y轴表示跨膜结构可能性的分值(概率);红色线(transmembrane)代表跨膜区;蓝色线(inside)代表在膜内部的概率,概率极低;粉色线(outside)代表在膜外的概率,几乎100%。由此可见,该蛋白不存在跨膜区,且该蛋白全部在膜外。
2.3.3 暗纹东方鲀MyoD基因编码蛋白的信号肽分析。
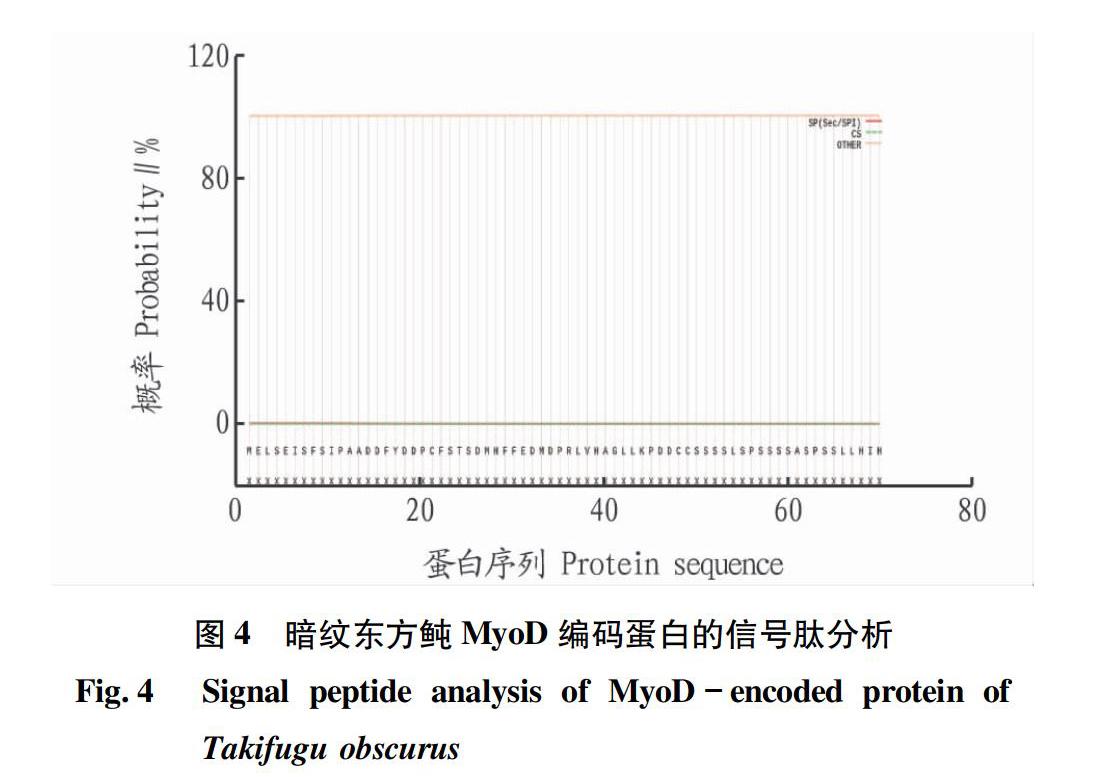
利用软件SignalP 5.0在线分析蛋白质的信号肽,发现无信号肽(图4),说明MyoD基因所编码的不是分泌蛋白。
2.3.4 暗纹东方鲀MyoD蛋白的亲水性/疏水性预测与分析。
利用位于Expasy的ProtScale在线分析软件进行蛋白质的亲疏水性分析,Amino acid scale选择默认的Hphob./Kyte & Doolittle,Window size设置为9,线性加权模型(图5)。图形的高峰值(正值)的区域体现的是疏水区域,而负值的“低谷”区域体现的是亲水区域。正值越大的氨基酸具备更大的疏水性,负值越小的氨基酸则具备更大的亲水性。通过对图5的分析可得,该蛋白的氨基酸在97位处有最大值(1.544),在75和76位处有最小值(-2.533),MyoD蛋白表现为亲水性。
2.3.5 蛋白亚细胞定位分析。
利用PSORT Ⅱ Prediction软件对暗纹东方鲀MyoD蛋白进行亚细胞定位分析,结果显示,该蛋白在细胞核中分布最多,为56.5%;在细胞骨架中分布最少,为8.7%;细胞质和线粒体分别为21.7%和13.0%。
2.3.6 暗纹东方鲀MyoD蛋白的磷酸化位点预测。
利用NetPhos 3.1软件来预测其磷酸化位点,在暗纹东方鲀MyoD基因编码的氨基酸中共发现有82个Ser磷酸化位点、15个Thr磷酸化位点、5个Tyr磷酸化位点(图6)。
2.3.7 基因编码蛋白质结构预测。
2.3.7.1 蛋白质二级结构预测。
蛋白质的理化性质和各功能取决于其空间结构,利用PSIPRED在线分析软件对MyoD蛋白二级结构进行预测(图7),从图7可以看出二级结构预测的置信度(Conf)、二级结构图标(Cart)、二级结构字符表示(Pred)和氨基酸序列及编号(AA)。暗纹东方鲀MyoD基因编码蛋白序列中只含有α螺旋(Helix)、无规则卷曲(Coil)和β折叠(Strand),不含有β转角以及其他已知的结构域。2.3.7.2 蛋白质三级结构预测。
登陆SWISS-MODEL网站(https://www.swissmodel.ex-pasy.org/)预测该基因编码蛋白质三级结构,预测结果如图8所示。
2.3.8 系统进化树。
使用MEGAX分子遗传进化分析软件,对暗纹东方鲀(Takifugu obscurus)和人(Homo sapiens)、斑马鱼(Danio rerio)、罗非鱼(Oreochromis aureus)、金头鲷(Sparus aurata)、大口黑鲈(Micropterus salmoides)、红鳍东方鲀(Takifugu rubripes)、非洲爪蟾(Xenopus laevis)、草鱼(Ctenopharyngodon idella)、大鼠(Rattus norvegicus)、猪(Sus scrofa)、鸡(Gallus gallus)、黄牛(Bos taurus)、绵羊(Ovis aries)、抹香鲸(Physeter catodon)14个物种以临近相连算法构建系统进化树,红点为暗纹东方鲀分支。由进化树可表明,暗纹东方鲀与红鳍东方鲀的亲缘关系最近;其次为罗非鱼、大黑口鲈、金头鲷。
3 讨论与结论
MyoD基因第一次被成功克隆出来是由Davis在1987年所完成的。作为生肌调节因子MRFs家族的主要成员之一,MyoD基因不论是对骨骼肌的形成还是分化都起着十分重要的作用[17-19]。该研究首次克隆并测出暗纹东方鲀MyoD基因的CDS区核苷酸序列,进而对其进行了生物信息学分析,得到其片段长度为846 bp,共编码281个氨基酸,这与红鳍东方鲀MyoD基因编码区一致。该試验结果显示,暗纹东方鲀MyoD基因A、G、T、C碱基分别为21.40%、26.12%、18.44%和34.04%,与红鳍东方鲀MyoD基因碱基序列相似度为99%,仅在412 bp处有碱基A→G的变化,这一碱基的突变引起了氨基酸序列的改变,因此该位点突变应为错义突变。将该序列与其他物种的MyoD基因进行同源性比较,结果发现暗纹东方鲀与红鳍东方鲀同源性最高,与哺乳动物的同源性较低。这与传统的生化特征分类和形态学分类的进化地位是相符合的,进一步说明 MyoD基因在对物种与物种间的系统进化关系的研究中是具有一定价值的[20-24]。
生物信息学分析结果显示,暗纹东方鲀MyoD基因分子量为30 960.28 Da,理论等电点为6.41,亲水性平均值(GRAVY)为-0.667,脂肪指数为62.56,半衰期为30 h,不稳定指数为70.51,其多肽链表现出亲水性,为不稳定蛋白。通过软件TMHMM和SignalP 5.0在线分析可知,MyoD蛋白全部在膜外且不存在跨膜区也无信号肽,说明其不是分泌蛋白,这个结果与MyoD基因只在骨骼肌细胞特异表达的组织特异性一致。二级结构预测结果显示,暗纹东方鲀MyoD基因编码蛋白序列中只含有α螺旋(Helix)、无规则卷曲(Coil)和β折叠(Strand),不含有β转角以及其他已知的结构域。由于暗纹东方鲀MyoD三级结构仅有部分模型,因此无法预测完整的三级结构。在线预测发现,MyoD基因存在磷酸化位点共102个,其中有82个Ser磷酸化位点、15个Thr磷酸化位点、5个Tyr磷酸化位点,由此可以敲定,MyoD 蛋白在肌肉与骨骼生长发育中所起作用在一定程度上与这些磷酸化位点有着紧密联系,其亚细胞主要定位在细胞核中。
该试验通过RT-PCR克隆了MyoD基因的编码区,并对其进行了基础的生物信息学分析,为以后对该基因的结构和功能的深入研究奠定了一定基础,以期能够为改良暗纹东方鲀的肉质作出贡献。
参考文献
[1]
SABOURIN L A,RUDNICKI M A.The molecular regulation of myogenesis[J].Clinical cenetics,2000,57(1):16-25.
[2]ALVES H J,ALVARES L E,GABRIEL J E,et al.Influence of the neural tube/notochord complex on MyoD expression and cellular proliferation in chicken embryos[J].Brazilian journal of medical & biological research,2003,36(2):191-197.
[3]ZOU G W,ZHU Y Y,LIANG H W,et al.Association of pituitary adenylate cyclase-activating polypeptide and myogenic factor 6 genes with growth traits in Nile tilapia (Oreochromis niloticus)[J].Aquaculture international,
2015,23(5):1217-1225.
[4]ZHONG X,WANG Q Q,LI J W,et al.Ten-eleven translocation-2 (Tet2) is involved in myogenic differentiation of skeletal myoblast cells in vitro[J].Scintific reports,2017,7:1-11.
[5]于凌云,白俊杰,叶星,等.大口黑鲈MyoD cDNA的克隆和序列分析[J].生物技术通报,2008(S1):301-306.
[6]项露颉,孙丽敏,姜怀志.生肌决定因子(MyoD)基因家族调控动物生产性能发挥的研究概述[J].现代畜牧兽医,2016(2):54-58.
[7]王立新.草鱼MyoD基因cDNA克隆和表达研究[D].杨凌:西北农林科技大学,2005.
[8]AKIZAWA Y,KANNO H,KAWAMICHI Y,et al.Enhanced expression of myogenic differentiation factors and skeletal muscle proteins in human amnion-derived cells via the forced expression of MYOD1[J].Brain & development,2013,35(4):349-355.
[9]BLUM R,DYNLACHT B D.The role of MyoD1 and histone modifications in the activation of muscle enhancers[J].Epigenetics,2013,8(8):778-784.
[10]LIU C,MCFARLAND D C,VELLEMAN S G.Effect of genetic selection on MyoD and myogenin expression in turkeys with different growth rates[J].Poultry science,2005,84(3):376-384.
[11]AVEROUS J,GABILLARD J C,SEILIEZ I,et al.Leucine limitation regulates myf5 and myoD expression and inhibits myoblast differentiation[J].Experimental cell research,2012,318(3):217-227.
[12]成嘉,褚武英,张建社.鱼类肌肉组织发生和分化相关基因的研究进展[J].生命科学研究,2010,14(4):355-362.
[13]卢中华,俞菊华,李红霞,等.奥利亚罗非鱼、尼罗罗非鱼MyoD1和MyoD2基因特征及差异[J].中国水产科学,2010,17(5):903-912.
[14]蒋天明,罗兴春,吴江.暗纹东方鲀养殖技术[J].淡水渔业,2001,31(4):14-17.
[15]马爱军,陆丽君,陈超,等.东方鲀属主要經济鱼种繁育养殖、育种和基因研究现状[C]//第三届全国现代生态渔业管理与技术研究.北京:中国水利技术信息中心,2011.
[16]廖章斌,徐后国,卫育良,等.河鲀营养研究进展及展望[J].动物营养学报,2018,30(4):1286-1296.
[17]KABLAR B,KRASTEL K,TAJBAKHSH S,et al.Myf5 and MyoD activation define independent myogenic compartments during embryonic development[J].Developmental biology,2003,258(2):307-318.
[18]DAVIS R L,WEINTRAUB H,LASSAR A B.Expression of a single transfected cDNA converts fibroblasts to myoblasts[J].Cell,1987,51(6):987-1000.
[19]STUHLMILLER T J,GARCA-CASTRO M I.Current perspectives of the signaling pathways directing neural crest induction[J].Cellular and molecular life sciences,2012,69(22):3715-3737.
[20]刘宏祥,徐文娟,宋卫涛,等.高邮鸭群体 MSTN、MyoD1和 MyoG 基因外显子中SNP位点的分析[J].江苏农业学报,2015,31(3):604-612.
[21]王立新,白俊杰,叶星,等.草鱼My5oD cDNA的克隆和序列分析[J].中国农业科学,2005,38(10):2134-2138.
[22]GALLOWAY T F,BARDAL T,KVAM S N,et al.Somite formation and expression of MyoD,myogenin and myosin in Atlantic halibut (Hippoglossus hippoglossus L.) embryos incubated at different temperatures:Transient asymmetric expression of MyoD[J].Journal of experimental biology,2006,209(13):2432-2441.
[23]FERNANDES J M O,KINGHORN J R,JOHNSTON I A.Differential regulation of multiple alternatively spliced transcripts of MyoD[J].Gene,2007,391(1/2):178-185.
[24]ANDERSEN ,DAHLE S W,VAN NES S,et al.Differential spatio-temporal expression and functional diversification of the myogenic regulatory factors MyoD1 and MyoD2 in Atlantic halibut (Hippoglossus hippoglossus)[J].Comparative biochemistry & physiology part B:Biochemistry & molecular biology,2009,154(1):93-101.
