腹腔镜下卵巢子宫内膜异位症囊肿剔除术对患者卵巢皮质剥除、卵巢功能及预后影响
2021-05-11姜淑丽张欢欢郝学平
姜淑丽 张欢欢 郝学平
1.河南省鹤壁市中医院(458030);2.河南省鹤壁市妇幼保健院;3.河南省鹤壁市京立医院
卵巢子宫内膜异位症(EMs)是子宫内膜异位生长导致的,可侵犯全身任何部位[1]。症状主要表现为下腹痛、痛经、不孕、盆腔结节等[2]。临床治疗原则以减少或清除病灶、控制疼痛、促进生育、预防复发为主[3],治疗方法包括药物和手术。因部分患者药物治疗并不能有效缓解症状、恢复生育功能,故手术治疗仍是目前首选方法。但手术会导致部分正常卵巢组织丢失,且手术对卵巢及其血管造成一定程度损伤,影响术后卵巢功能[4-5]。近年来腹腔镜技术开始广泛应用于临床。本研究通过将腹腔镜下囊肿剔除术与常规开腹手术进行比较,探讨不同术式对患者卵巢皮质剥除、卵巢功能及预后的影响。
1 资料与方法
1.1 临床资料
选择2017年3月-2020年2月本院诊治的卵巢子宫内膜异位症患者90例作为研究对象,年龄25~40岁。随机抛硬币法分为腹腔镜组和开腹组(43例)。本研究中所有手术均由同一医师完成,且本研究经患者知情同意和医院伦理委员会审核通过。
1.2 纳入排除标准
纳入标准:①均经妇科检查、影像学检查确诊为EMs;②单侧卵巢囊肿且月经规律;③近3个月内无激素类药物使用史;④无手术禁忌证。排除标准:①合并恶性肿瘤;②既往存在内分泌疾病、卵巢疾病或者腹部手术史;③合并心、肝、肾等严重器质性病变;④合并多囊卵巢综合征等其他类型的卵巢囊肿。
1.3 手术方法
腹腔镜组:术前均给予常规检查和准备。膀胱截石位,气管插管全身麻醉,常规消毒手术部位,于脐上1.0cm处作纵切口1.0cm,穿刺气腹针入腹腔,穿刺10mm套管针并置入目镜形成气腹。对盆腔器官进行探查,锐性分离粘连部分并游离子宫和卵巢。采用超声刀打开卵巢皮质剥离囊肿,待囊肿壁完整剥离后将其病理冰冻,冲洗卵巢创面,对出血处给予电凝止血。检查腹腔以及创面出血情况,确认无误后清理腹腔并放置盆腔引流管,放CO2气体关腹,并缝合穿刺孔。术后给予补液、止血等对症治疗,观察阴道流血、小便情况,遵医嘱给予患者常规术后护理。开腹组:给予开腹囊肿剔除术,术前准备同腹腔组。全麻生效后,术者在其下腹部作5~19cm切口,进入腹腔,探查腹腔内情况并找到卵巢囊肿,钝性分离囊肿,包膜边缘不整齐者修剪和缝合,术毕确认无出血后逐层缝合腹壁各层。术后处理同腹腔组。
1.4 观察指标
1.4.1卵巢皮质剥除情况统计患者卵巢皮质剥除率、病灶剥除厚度以及卵巢皮质剥除厚度,部位包括卵巢窝、中间以及卵巢门,通过苏木精-伊红染色切片计算。
1.4.2卵巢功能于术前以及术后3个月,采用阴道超声检查卵巢动脉的收缩期峰值血流速度(PSV)和窦状卵泡数目(AFC);酶联免疫吸附法检测血清抗苗勒管激素(AMH)水平,试剂盒由上海信裕生物科技有限公司生产;电化学发光法检测患者卵泡刺激激素(FSH)、雌二醇(E2)和黄体生成素(LH)水平,试剂盒由上海江莱生物科技有限公司生产。
1.4.3免疫功能分别于术前及术后3d采集患者外周静脉血,采用全自动生化分析仪检测血清免疫球蛋白水平(IgM、IgG和IgA)。
1.4.4预后术后随访6个月,统计两组EMs复发率和妊娠率。
1.5 统计学分析
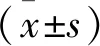
2 结果
2.1 临床资料
两组年龄、体质指数和囊肿直径比较均无差异(P>0.05)。见表1。
表1 两组临床资料对比
2.2 卵巢皮质剥除情况
腹腔镜组卵巢门皮质剥除率低于开腹组,卵巢中间和卵巢门皮质剥除厚度、卵巢门病灶剥除厚度均低于开腹组(均P<0.05),其余部分皮质剥除厚度两组无差异(P>0.05)。见表2。
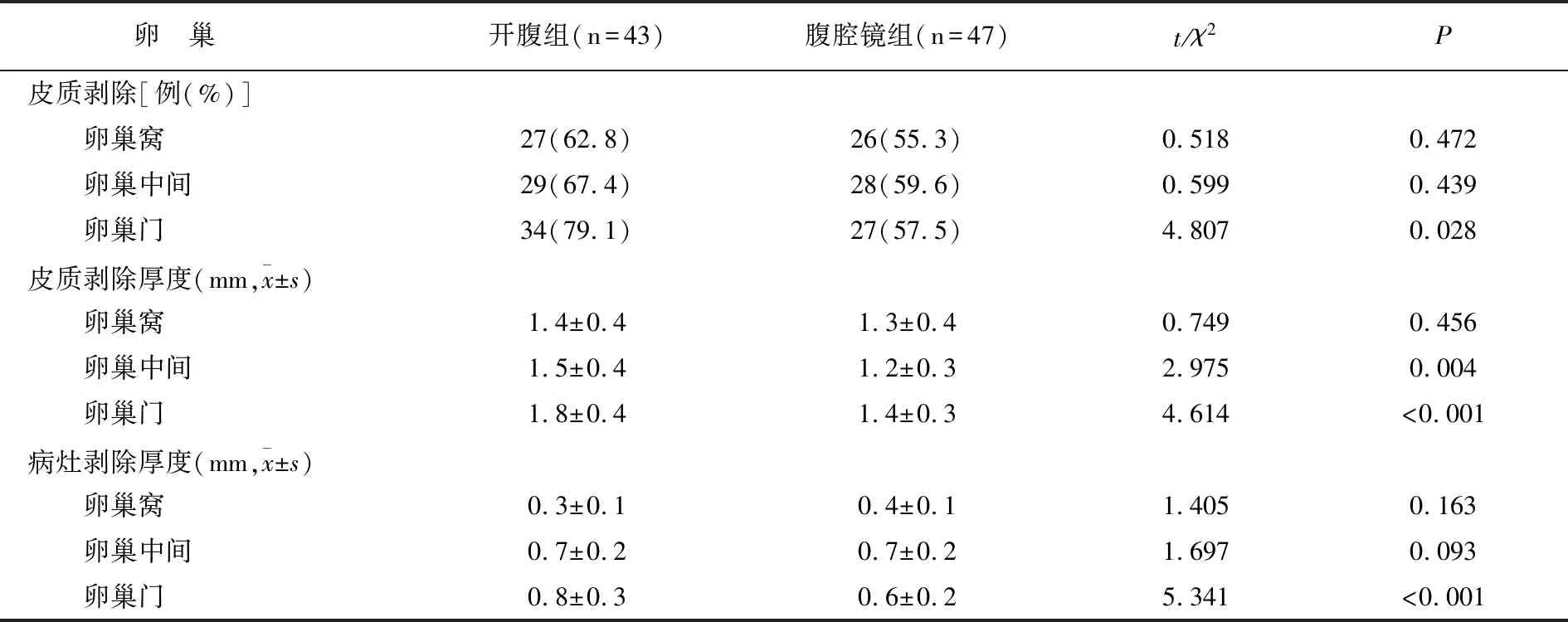
表2 两组卵巢皮质剥除情况对比
2.3 卵巢功能
术前两组PSV、AFC和AMH水平无差异(P>0.05),术后两组上述指标均有降低但腹腔镜组高于开腹组(P<0.05)。见表3。
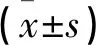
表3 两组手术前后卵巢功能指标对比
2.4 性激素水平
术前及术后两组血清LH、E2和FSH水平均无差异(P>0.05)。见表4。
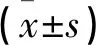
表4 两组手术前后性激素水平对比
2.5 免疫功能
术前及术后两组IgM、IgA水平均无差异(P>0.05),但术后腹腔镜组IgG水平高于开腹组(P<0.05)。见表5。
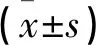
表5 两组手术前后免疫功能指标对比
2.6 预后
术后半年内复发率开腹组(2例,4.7%)与腹腔镜组(3例,6.4%)无差异(P>0.05),妊娠率腹腔镜组(21例,44.7%)高于开腹组(10例,23.3%)(χ2=0.011、4.565,P=0.918、0.03)。
3 讨论
EMs会导致不孕,育龄女性患者首选保留生育功能的腹腔镜下手术。腹腔镜EMs囊肿剔除术被认为是治疗EMs的最佳手术方式,该术式可较好切除卵巢囊肿,改善患者症状[6-7]。但亦有研究表明腹腔镜囊肿剔除术会对机体卵巢储备功能造成损伤[8]。检索文献资料,虽有较多关于腹腔镜EMs囊肿剔除术对卵巢储备功能影响的研究,但关于对卵巢剥除情况的具体影响尚缺乏系统研究,且对患者预后影响多为回顾性研究,受患者资料偏倚等因素影响,结果仍有待论证。基于此,本研究以开腹手术为对照,通过随机、对照、前瞻性研究分析腹腔镜EMs囊肿剔除术对患者卵巢功能以及预后的影响。
卵巢皮质剥离难度与囊壁及其外层皮质的粘连程度密切相关,有研究表明卵巢门附近的囊壁粘连程度最严重,导致剥离难度较大[9]。而剥离难度增大会导致部分正常的卵巢组织和卵泡在术中被剥离,从而对患侧卵巢功能造成严重影响。本研究结果显示,腹腔镜组患者卵巢门皮质剥除率低于开腹组,卵巢中间和卵巢门皮质剥除厚度、卵巢门病灶剥除厚度均低于开腹组,表明两种手术均会导致正常卵巢组织的丢失,但相比之下腹腔镜下囊肿剔除术对卵巢组织损伤更小。可能是因为卵泡在卵巢门附近较多,腹腔镜下囊肿剔除术,术者视野更清晰,可较好注意不同组织的解剖层次,同时结合锐性分离利于减少对于正常卵巢组织的切除,从而减少卵泡的丢失[10]。也有学者认为EMs患者卵巢组织的丢失程度与术者操作经验和熟练度密切相关[11]。EMs本身会对卵巢功能造成影响,研究显示EMs患者排卵障碍率高达17%~27%[12]。而手术会导致部分正常卵巢组织丢失,也会导致卵巢功能降低。血清AMH水平是评估卵巢功能的重要指标,且不受激素类药物影响。本研究结果显示术后两组患者上述指标均有所降低,但腹腔镜组PSV、AFC和AMH水平高于开腹组,提示腹腔镜囊肿剔除术可减少对卵巢功能的损伤,与王珂等[13]研究一致。
分析其原因:一方面与该术式能够减少正常卵巢组织剥离程度有关,另一方面可能是腹腔镜辅助可放大术者视野,发现较为隐匿的病变,更利于完整剥离囊肿,同时术中还可解除盆腔粘连,促进正常解剖结构恢复,从而减少卵巢功能损伤。但该术式仍难以避免对卵巢功能的损伤,其原因可能囊肿囊壁分层不清楚,即使是腹腔镜手术,仍难以避免剥除部分卵巢组织;同时因腹腔镜下操作不便,在卵巢囊肿剥除后,针对卵巢表面的渗血,往往采用双极电凝止血,包括本研究,术中都采用了电凝止血,电凝热能的作用可损伤原始卵泡和颗粒细胞,影响卵巢血供,导致卵巢功能降低[14]。对于术中采用缝合止血是否影响卵巢功能仍有待于进一步探讨。手术无论大小,术中出血、手术时间、麻醉等均会对机体免疫功能产生一定的影响。本研究术后腹腔镜组IgG水平高于开腹组,提示腹腔镜囊肿剔除术对机体创伤更小,对机体免疫能力影响更小。可能是与腹腔镜手术对机体的创伤小等因素有关。此外,本研究还显示腹腔镜组妊娠率高于开腹组,表明腹腔镜EMs剔除术可更好改善患者预后。薛乃瑞等[15]通过回顾性研究也显示,腹腔镜EMs剔除术可提高EMs不孕症患者冻胚移植治疗的临床妊娠率。但本文两组术后半年内复发率未见差异,与张美龄等[16]同类研究结果略有出入,原因可能与本研究随访时间较短、术者手术经验、患者个体性差异等因素有关。笔者通过本次实践,总结出腹腔镜下EMs剔除术中,在剔除囊肿时,要选择合适的切口,尽量轻柔巧妙的剔除囊肿;在遇到较大囊肿时应先穿刺吸净囊内液体,冲洗干净囊内壁,再进行剔除,且剔除时为保护卵巢功能,穿刺和剥离皮质时应避开卵巢门。
综上所述,腹腔镜EMs剔除术相比于开腹手术,可有效减少对卵巢正常组织及功能的损伤,对机体免疫功能影响更小并提高了术后半年内妊娠率。
