PTCH1基因通过Hedgehog信号通路对卵巢癌细胞增殖和凋亡影响
2021-05-11郑芳徐浩
郑 芳 徐 浩
湖北省黄石市爱康医院(435000)
卵巢癌是女性生殖系统常见恶性肿瘤之一[1]。若未及时治疗极易引发腹腔广泛转移,造成病情恶化[2]。早期卵巢癌临床表现隐蔽,延误最佳治疗时机,故临床治疗有效率及生存率较低。积极探究卵巢癌细胞的增殖、凋亡等生物学行为机制,寻找卵巢癌诊疗与靶向治疗的生物标志物对提高卵巢癌的诊疗效果及患者的生存率具有重要意义。Hedgehog信号通路是一种在胚胎发育、细胞增殖分化等方面发挥重要作用的信号传导通路[3]。研究表明,Hedgehog信号通路异常激活参与大肠癌、食管癌、肺癌等多种恶性肿瘤的发生和进展[4]。在Hedgehog信号通路中包含GLI-1、PTCH、HH、SMO 4种重要基因,其中PTCH又包括PTCH1和PTCH2同源基因。相关研究表明PTCH基因可通过Hedgehog信号通路参与恶性肿瘤的病情[5]。既往研究多以PTCH1基因与胃癌、胰腺癌、鼻咽癌等恶性肿瘤的报道,鲜有关于PTCH1基因通过Hedgehog信号通路对卵巢癌细胞生物学行为影响的研究报道。鉴于此,本研究拟分析PTCH1基因通过Hedgehog信号通路对卵巢癌细胞增殖和凋亡的可能影响,为探究卵巢癌发病机理及临床靶向治疗提供参考。
1 资料与方法
1.1 一般资料
经院伦理委员会审核批准,收集2018年1月-2018年12月在本院诊治的80例上皮性卵巢癌患者的癌组织为观察组。纳入标准:①经病理切片检验证实;②未接受放疗、化疗;③患者及家属签署知情同意书。排除标准:①合并多发转移或围术期死亡;②依从性差无法配合完成本研究。同期就诊的良性卵巢囊肿患者80例术中切除的正常卵巢组织为对照组。观察组年龄(51.1±6.4)岁(33~65岁);病理分期为I期21例,II期23例,III期19例,IV期17例。
1.2 细胞、试剂与仪器
卵巢癌细胞系株SKOV3、A2780和人正常卵巢上皮细胞株IOSE80均购自中国科学院上海细胞库。RPMI-1640培养基、DMEM培养基、胎牛血清、0.25%胰蛋白酶等购自美国GIBCO公司;双抗青霉素-链霉素混合液购自美国Sigma;RT-qPCR试剂盒、Trizol RNA提取试剂、免疫组化试剂盒购等购自美国Invitrogen公司;PTCH1 PCR引物购自上海桑尼生物科技有限公司。PTCH1过表达质粒载体pIRES2-Ptch1和无义序列PTCH1质粒载体pIRES2-NC均购自上海泰冷生物科技有限公司。PTCH1蛋白一抗购自Abcam公司;MTT试剂、流式细胞仪试剂购自南京碧云天公司;PCR仪购自美国ABI公司;流式细胞仪购自美国Thermo公司。
1.3 检测方法
1.3.1细胞培养将人卵巢癌细胞株SKOV3、A2780和人正常卵巢上皮细胞株IOSE80行体外培养,置于含有10%胎牛血清和1%青霉素-链霉素的 RPMI-1640培养基中,在37℃ 5% CO2培养箱中培养。观察细胞生长情况并更换新鲜培养基。待培养基底部可见细胞融合至80%时,0.25%胰蛋白酶消化处理,行细胞传代培养。取部分稳定生长的SKOV3卵巢癌细胞随机分成3组:pIRES2-Ptch1组、pIRES2-Scramble组和空白对照组,分别将PTCH1过表达质粒载体、无义序列PTCH1质粒载体转染SKOV3卵巢癌细胞,空白对照组则不做处理。
1.3.2细胞中PTCH1基因表达收集各组织及细胞,Trizol法提取总RNA,微量分光光度计检测RNA纯度和浓度,逆转录合成cDNA。以cDNA为模板行RT-qPCR检测,PCR扩增条件按照试剂盒使用说明进行设置,94℃ 2min;94℃ 30s;退火30s;72℃ 30s,循环30次,72℃ 2min。PTCH1引物序列:上游:5'-CTCCTTTGCGGTGGACAA-3';下游:5'-CCTCAGCCTTATTCAGCATTTC-3',扩增片段109bp。
1.3.3卵巢组织中PTCH1蛋白表达免疫组化法检测。将正常卵巢组织与卵巢癌组织切片、脱蜡、脱苯、水化处理制成石蜡切片,60℃过夜,脱蜡并水化,滴加EDTA后固定于100℃蒸馏水的高压锅中,加热2min自然冷却至室温,加入过氧化物酶阻断试剂,孵育10min,连续洗涤3次,孵育PTCH1一抗60min,加入二抗孵育20min,加入过氧化物酶聚合物,加入显色剂观察3~5min,洗涤,苏木素复染3min,PBS反蓝,脱水、封片、晾干。
1.3.4细胞中PTCH1蛋白表达收集各组织及细胞加裂解液,剪碎并离心处理后提总蛋白,Western Blotting测定蛋白质浓度定量。随后上样、电泳、转膜、封闭,滴加一抗PTCH1(1:1000),4℃孵育过夜。TBST液洗膜加入二抗稀释液(1:6000)4℃孵育1h,TBST液洗膜后底物显色曝光,测定吸光度。
1.3.5卵巢癌细胞增殖情况采用MTT试验检测卵巢癌细胞增殖情况。使用0.25%胰蛋白酶将pIRES2-Ptch1组、pIRES2-Scramble组和Control组的培养12h、24h、48h、72h的SKOV3卵巢癌细胞消化处理,磷酸缓冲液洗涤后1000r/min离心5min,去上清液。采用细胞培养液调整细胞浓度5×107/L,使用96孔细胞培养板每孔加入100ul细胞溶液培养,加入5g/L MTT溶液继续孵育。除上清液,加入100μl二甲基亚砜,振荡反应10min。设置不加入细胞的空白组,重复实验3次,采用酶标仪检测各孔细胞在490nm吸光度值,计算细胞增殖率。
1.3.6卵巢癌细胞凋亡情况采用流式细胞仪检测卵巢癌细胞凋亡情况。使用0.25%胰蛋白酶将pIRES2-Ptch1组、pIRES2-Scramble组和空白对照组培养48h的SKOV3卵巢癌细胞进行消化处理,加EP管内,加培养液调整细胞浓度至1×1010/L。取1ml细胞液,1000r/min离心10min,磷酸缓冲液重悬洗涤细胞2次,再次1000r/min离心10min除上清液。加入500μl结合缓冲液,流式细胞仪检测细胞凋亡情况。
1.4 统计学分析
2 结果
2.1 不同组织与细胞中PTCH1表达
卵巢癌组织中PTCH1 mRNA表达及蛋白阳性率均低于正常卵巢组织,且病理分期越重水平越低(P<0.05)。SKOV3、A2780卵巢癌细胞中PTCH1 mRNA及PTCH1蛋白表达均低于IOSE80人正常卵巢上皮细胞(P<0.05)。见表1。
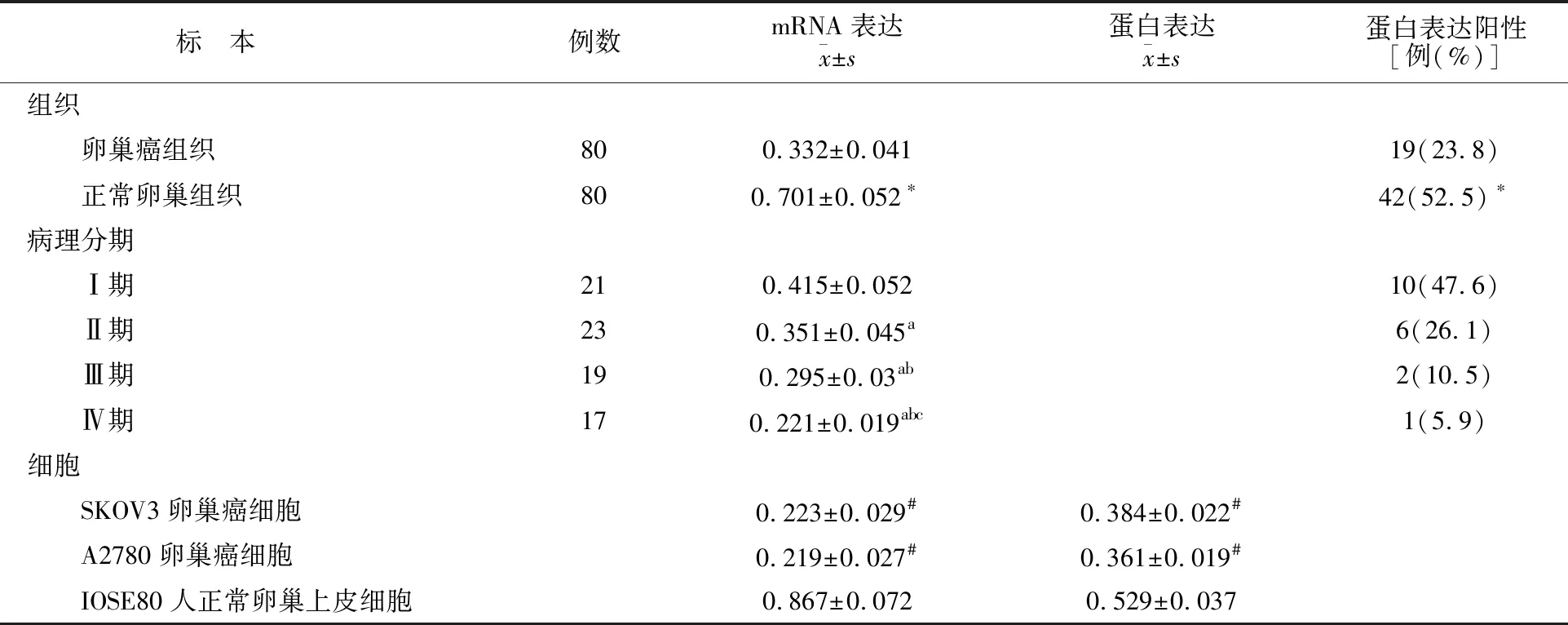
表1 不同标本中PTCH1 mRNA、蛋白阳性比较
2.2 转染处理的SKOV3卵巢癌细胞中PTCH1表达比较
SKOV3卵巢癌细胞中PTCH1表达pIRES2-Ptch1组(0.621±0.091)高于pIRES2-Scramble组(0.227±0.031)和空白对照组(0.229±0.032)(P<0.05),提示过表达pIRES2-Ptch1转染成功。
2.3 过表达PTCH1对卵巢癌细胞增殖的影响
MTT试验显示,PTCH1基因过表达转染的SKOV3卵巢癌细胞增殖活力pIRES2-Ptch1组下降,而pIRES2-Scramble组及空白对照组增加(P<0.05)。见表2。
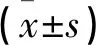
表2 PTCH1对各组各时点卵巢癌细胞增殖比较
2.4 过表达PTCH1对卵巢癌细胞凋亡的影响
SKOV3卵巢癌细胞培养48h后凋亡情况显示,IRES2-Scramble组(5.62±0.34)%与空白对照组(5.49±0.29)%无差异但均低于pIRES2-Ptch1组(16.22±1.08)%(P<0.05)。
3 讨论
卵巢癌中以上皮性卵巢癌最为常见。临床研究证实[6],卵巢癌治疗预后不佳,与卵巢癌细胞极其复杂的生物学行为特征密不可分。探究卵巢癌细胞的生物学特征,不仅利于深入了解卵巢癌的发病机制,同时也助于寻找药物治疗靶点,对提升卵巢癌的诊疗效果及降低卵巢癌死亡率至关重要。
Hedgehog信号通路是一种在胚胎发育中发挥重要作用的进化保守性信号通路,在多种组织与器官的形成中起关键作用。既往研究报道Hedgehog信号通路与多种恶性肿瘤的发生有关。Peng等[7]报道长编码EGOT通过Hedgehog信号通路参与胃癌的发生与进展;Almazan等[8]研究发现Hedgehog信号通路在横机纹肉瘤的发病中发挥重要作用;Leon等[9]研究认为Hedgehog信号通路可作为多种恶性肿瘤的靶向治疗目标。可见,Hedgehog信号通路可能影响多种恶性肿瘤的分化、转移等生物学行为。PTCH1是Hedgehog信号通路中主要组成基因之一。研究表明[10],PTCH1是一种抑癌基因,当PTCH1失去对Hedgehog信号通路另一种跨膜蛋白SMO抑制作用时,会导致Hedgehog信号通路激活。Hasanovic等[11]报道利用Hedgehog信号通路的PTCH1作为药物转运蛋白,能有效提高抗肿瘤药物疗效,这与PTCH1作为抑癌基因的特性有密切关联。陈伟[12]等研究报道PTCH1突变或表达低与肺癌进展密切相关。王祎祎[13]等提出卵巢癌干细胞中PTCH1变异高表达,提示PTCH1变异可能参与了卵巢癌的发生。综合上述分析,Hedgehog信号通路中PTCH1基因可能参与多种恶性肿瘤的发生过程,其根本可能在于PTCH1基因影响恶性肿瘤细胞的生物学行为。
本研究结果表明,卵巢癌组织中PTCH1 mRNA表达和PTCH1蛋白阳性率均低于正常卵巢组织,且随着病理分期加重变化明显;SKOV3、A2780卵巢癌细胞中PTCH1 mRNA和PTCH1蛋白表达水平均低于IOSE80人正常卵巢上皮细胞。提示出卵巢癌组织或卵巢癌细胞中PTCH1低表达,这种低表达可能影响Hedgehog信号通路中PTCH跨膜蛋白形成,进而导致卵巢癌的发生或进展。为进一步验证Hedgehog信号通路中PTCH1基因对卵巢癌细胞的生物学行为影响,本研究使用PTCH1过表达质粒载体、无义序列PTCH1质粒载体和无任何处理分别转染SKOV3卵巢癌细胞,采用MTT试验分析了SKOV3卵巢癌细胞增殖情况,结果显示在12~72h培养期间,PTCH1基因过表达转染的pIRES2-Ptch1组SKOV3卵巢癌细胞增殖活力比pIRES2-Scramble组与空白对照组明显下降。反映出PTCH1过表达转染SKOV3卵巢癌细胞极大降低其增殖活力。SKOV3卵巢癌细胞培养48h后分析凋亡结果显示,pIRES2-Ptch1组凋亡率高于IRES2-Scramble组。提示PTCH1基因过表达将加速诱导卵巢癌细胞的凋亡。
PTCH和SMO是Hedgehog信号通路中两个主要跨膜蛋白受体,PTCH和SMO结合能够在Hedgehog信号通路中下调下游基因表达,从而在胚胎发育、组织或器官形成过程中发挥重要作用[14]。研究表明,当PTCH基因发生变异、去甲基化等改变,将解除对SMO抑制作用,SMO进入细胞并影响下游基因,激活Hedgehog信号通路中的转录因子Gli1蛋白,刺激各种靶基因持续表达,大量细胞以非程序性的无限增殖,诱导恶性肿瘤的发生[15]。因此当卵巢癌细胞中PTCH1低表达时,往往提示对SMO的抑制作用下调,Hedgehog信号通路失调,诱导卵巢癌的分化与增殖[16]。Hedgehog信号通路在卵巢癌细胞的生长与增殖过程中发挥重要作用,而PTCH1基因过表达能够抑制Hedgehog信号通路中转录因子Gli1的表达和Hedgehog信号通路激活,从而抑制卵巢癌细胞的增殖,诱导卵巢癌细胞凋亡。PTCH1基因通过Hedgehog信号通路影响卵巢癌的发生、进展过程。
综上所述,PTCH1基因可通过激活Hedgehog信号通路并抑制转录因子Gli1的表达,从而抑制卵巢癌细胞的增殖,诱导卵巢癌细胞凋亡,说明PTCH1基因通过Hedgehog信号通路影响卵巢癌的发生进展;PTCH1基因可能是上皮性卵巢癌的诊疗靶点,为上皮卵巢癌的临床诊断与治疗提供新选择。
