203株牦牛源大肠杆菌agn43基因与生物被膜表型相关性研究
2021-05-10谭敏汪露甘平陈朝喜李云
谭敏 汪露 甘平 陈朝喜 李云
摘要:为了解牦牛源大肠杆菌agn43基因携带情况及其与生物被膜形成能力的相关性,分别采用PCR扩增和改良结晶紫半定量方法分别对分离鉴定的203株牦牛源大肠杆菌进行agn43基因检测和生物被膜形成能力分析。实验结果表明,分离的203株大肠杆菌中,147株agn43基因检测为阳性,检出率为72.4%;87.19%(177/203)的菌株具有生物被膜形成能力;agn43基因携带率与生物被膜表型之间存在较强的相关性(R2=0.98897)。
关键词:牦牛;大肠杆菌;agn43基因;生物被膜表型
Correlation analysis of agn43 and biofilm-forming phenotype in Yak-derived Escherichia coli
TANMin1, WANG Lu1,GANPing2,CHENChao-xi1, LIYun3*
(1.College ofAnimalHusbandryandVeterinarymedicine,SouthwestMinzuUniversity,Chengdu,Sichuan, China.;2.Instituteof AnimalHusbandry, GanziTibetanAutonomousPrefectureofSichuanprovince, China.3. HaidResearchInstitute, GuangdongHaidGroupCo.,Ltd,Guangzhou, Guangdong,China;4.ZhongshanYunshengAgricultural TechnologyCo.,Ltd.Zhongshan,Guangdong, China.)
Abstract: Tounderstandthecorrelationofagn43andbiofilm-formingabilityinYak-derivedEscherichia coli,PCRmethodandmodifiedcrystal violetstainingsemi-quantitativemethodwereperformedforagn43detectionandbiofilm-formingabilityanalysis, respectively.Theresultsshowed that147E.coliwereagn43positiveandthedetectionratewas72.4%; 87.19%(177/203)strainsrevealedbiofilm-formingability;Thereexisted correlationof agn43andbiofilm-formingphenotype(R2=0.9889).
Key words: Yak;Escherichiacoli;Agn43gene;Biofilm-formingphenotype
大肠杆菌是一种常见的人和动物肠道寄生菌,可以引起人和动物多种不同程度的感染。牦牛大肠杆菌病是严重威胁高原畜牧业的一种重要疾病,一般呈散发或地方流行性,每年3~10月份发生,4~6月份是发病高峰期,泌乳期的母牦牛最易感染,其次为1~4月龄犊牛,公牦牛不易感。此外,大肠杆菌致病性的产生受毒力因子的调控,毒力因子相互协助完成大肠杆菌的粘附、定居、繁殖和致病的过程。
大肠杆菌同源转运蛋白Agn43是一种丰富的抗原外膜蛋白,Agn43是由agn43基因编码的,主要参与大肠杆菌的聚集、生物被膜的形成和上皮细胞的微集落的形成。相关研究发现,Agn43在早期生物膜中高表达,在成熟生物膜中缺乏Agn43,因此认为Agn43在生物膜形成过程中发挥早期作用[1]。生物膜是抵抗外界不良环境的影响而产生的一种生存方式,并作为抵抗机体防御和限制抗菌药物进入细菌的一道天然屏障[2]。一旦形成成熟的生物膜,大肠杆菌就能逃避宿主的免疫系统和阻碍药物的渗透,保护了细菌及其耐药基因的同时导致耐药性的传播,并且出现了许多多重耐药菌株,使得大肠杆菌的耐药性问题变得更加严重,给畜禽疾病的预防和控制带来更多的挑战。
基于此,本研究对分离的牦牛源大肠杆菌进行毒力基因agn43检测,同时对分离菌株进行生物被膜表型分析,分析agn43基因携带与生物被膜形成能力之间的相关性,以期为后续深入探讨牦牛源大肠杆菌生物膜的形成与毒力基因和多重耐药性之间的相关性奠定基础。
1材料與方法
1.1主要仪器设备和实验材料
LDZF-50KB型立式压力蒸汽灭菌器(上海申安医疗器械厂);SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司);电子天平(梅特勒-托利多仪器上海有限公司);TC-96/G/H(b)C基因扩增仪(杭州博日科技有限公司);JY300C 电泳仪(北京君意东方电泳设备有限公司);凝胶图像系统(上海天能科技有限公司);各种规格移液器(10μL、20μL、100μL、1000μL);TGL-16 离心机(四川蜀科仪器有限公司)。LB 肉汤、伊红美蓝琼脂和麦康凯琼脂购自青岛高科园海博生物技术有限公司;2 X Premix TaqTM、DL2000 DNA Marker 和琼脂糖等分子生物学实验所需试剂购自 TaKaRa 公司。
1.2 方法
1.2.1 样本采集及大肠杆菌分离鉴定 250 份健康牦牛粪便样本采自四川省广汉市某牦牛屠宰场:一次性医用棉签蘸取粪便后置于 37℃恒温培养箱增菌培养 8~12h,接种环挑取增菌液后在麦康凯琼脂平板和伊红美蓝琼脂平板上交替传代划线纯化,待培养基上长出疑似大肠杆菌后挑取单菌落进行革兰氏染色并镜检。
1.2.2 agn43 基因 PCR 扩增 采用水煮法进行大肠杆菌 DNA提取:将过夜培养的 203 株大肠杆菌菌液分别移至 1.5mL 离心管中 10,000r/min 离心 4min,弃去上清液后加入 200μL 蒸馏水混悬均匀后煮沸 10min,冰浴 5min 后 10,000r/min 离心 4min,将上清移至干净的离心管中,-20℃保存备用。
参考Clermont 等[ 3 ]方法设计合成agn43 基因扩增引物,引物序列如下:agn43-F:5′-GACTATGACCGGATTSTGGCAGGCT-3′;agn43-R:5′-GTGGCTCCAGCATCARTTGTCAG -3′,目标扩增产物长度大约 499bp。
以分离菌株的 DNA 为模板,采用常规 PCR 方法扩增 agn43基因。10μL PCR 反应体系为:2 X Premix Taq 酶 5μL,上、下游引物各 0.5μL,DNA 模板 1μL,去离子水 3μL,轻轻混匀。PCR 反应条件为:94℃预变性 5min;94℃变性 30s,退火温度为 66.6℃,退火30s,72℃延伸 40s,共 35 个循环;最后 72℃延伸 5min。反应结束后,取 4μL PCR 扩增产物用 1.5%琼脂糖凝胶电泳判断是否与预期扩增产物大小一致。
1.2.3 生物被膜表型分析 参照 Peeters 等[4]和 Stepanovic 等[ 5 ]的方法进行,具体操作如下:无菌96孔细胞培养板的各孔加入200μL 经 1:100 稀释的菌液,阴性对照仅加 TSB 肉汤,37℃培养24h 后弃去培养液,灭菌 PBS 溶液漂洗 3 次,200μL 无水甲醇固定15min 后弃去,室温下自然风干后 2%结晶紫染色 5min,冲洗多余的染料,过夜自然风干加入160μL 33%冰乙酸,酶标仪测定各孔的OD570 值。根据测试孔与阴性对照孔 OD570 比值的不同将生物被膜表型分为无成膜能力(-),弱成膜能力(+),中等成膜能力(++)和强成膜能力(+++)四个表型。每株菌接种 4 孔,重复 3 次。
1.2.4 agn43 基因与生物被膜表型相关性分析 利用 Origin8. 5软件分析 agn43 基因携带率与生物被膜表型之间的关系。
2 结果与分析
2.1 大肠杆菌分离鉴定结果
从 250 份牦牛粪便样本中共分离鉴定 203 株疑似大肠杆菌,麦康凯培养基上为表面光滑、湿润、边缘整齐、微凸起的红色菌落,在伊红美蓝琼脂平板上呈现金属光泽;革兰氏染色镜检为阴性短杆菌,两头略微钝圆,成对或散在分布。与大肠杆菌的菌落特征和革兰氏染色镜检结果一致,初步确定为大肠杆菌,其分离率为81.2%(203/250)。
2.2 agn43基因 PCR检测结果
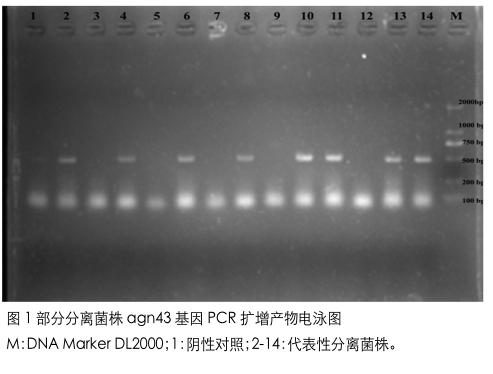
203 株牦牛源大肠杆菌中 147 株菌株检出 agn43 基因,检出率为 72.4%(147/203)。部分菌株 agn43 基因 PCR 扩增产物琼脂糖凝胶电泳显示,扩增片段大小约为 499bp,与预期大小基本一致(图 1)。
2.3 生物被膜形成能力分型
203 株牦牛源大肠杆菌中,87.19%(177/203)菌株表现出生物被膜形成能力。强、中、弱、无四种生物被膜表型的菌株数量分别为6、47、124、26 株,分别占菌株总数的 2.96%、23.15%、61.08%、12.81%。不同生物被膜表型大肠杆菌中,agn43 基因阳性菌株数量分别为2、31、103、11株,分别占agn43基因阳性菌株总数的1.36%、21.09%、70.07%、7.48%。
2.4 agn43基因與生物被膜表型相关性分析
对不同生物被膜表型菌株所占例与agn43基因携带率进行线性回归,agn43基因携带率与生物被膜表型之间存在较强的相关性(R2=0.98897)。
3讨论
生物被膜是指细菌在生长过程为了适应生存环境而粘附于物体或活性组织表面,并包被细胞外多糖基质中形成的一种与浮游细菌生长方式完全不同的细菌微生物群落,是细菌的一种特殊存在形式。
大肠杆菌产生致病性在于在体内繁殖和产生大量毒素,是粘附素定植和毒素致病机理的主要组成部分[6]。agn43基因是大肠杆菌的一种毒力基因,其编码一种主要的可变相外膜蛋白抗原Agn43,在大肠杆菌自身聚集和菌落形态中发挥重要作用,与大肠杆菌粘附和生物膜形成有关[7,8]。
本研究从四川某屠宰场牦牛粪便中分离鉴定的203株大肠杆菌中发现147株携带agn43基因,检出率为72.4%。而实验菌株均来源于屠宰场的健康牛,因此后续研究应检测agn43基因表达水平与致病性之间的相关程度。相关研究对大肠杆菌毒力基因、耐药性和生物被膜均进行检测[9-11],但未对其相关性进行分析。基于此,本研究对牦牛大肠杆菌的agn43基因进行检测,一方面了解其在牦牛中的检出率,另一方面为后续研究生物被膜的形成和细菌耐药性奠定基础,从而为深入探究抗生素压力下生物被膜的形成与耐药性和致病性的相关性提供思路和方法。█
参考文献:
[1] Wallecha A, Oreh H, V and W M W, et al. Control of Gene Expression at a Bacterial Leader RNA, the agn43 Gene Encoding Outer Membrane Protein Ag43 of Escherichia coli[J]. Journal of Bacteriology, 2014, 196(15): 2728-2735.
[2] Dinesh K B, Neetu K T, D.P. Shivaprased, et al. Phenotypic and genotypic characterization of biofilm forming, antimicrobial resistant, pathogenic Escherichia coli isolated from Indian dairy and meat products[J]. International Journal of Food Microbiology, 2021, 336.
[3] Clermont O, Bonacorsi S, Bingen E. Rapid and simple determination of the Escherichia coli phylogenetic group[J]. Applied and environmental microbiology, 2000, 66(10): 4555-4558.
[4] Peeters E, Nelis H J, Coenye T. Comparison of multiple methods for quantification of microbial biofilms grown in microtiter plates[J]. J Microbiol Methods, 2008, 72 (2): 157-165.
[5] Stepanovic S, Cirkovic I, Ranin L, et al. Biofilm formation by Salmonella spp. and Listeria monocytogenes on plastic surface[J]. Letters in Applied Microbiology, 2004, 38(5): 428-432.
[6] Mirhoseini A , Amani J , Nazarian S. Review on pathogenicity mechanism of enterotoxigenic Escherichia coli and vaccines against it[J]. Microbial Pathogenesis, 2018, 117(32): 162-169.
[7] Danese P N , Prattl A , Dove S L, et al. The outer membrane protein, Antigen 43, mediates cell-to-cell interactions within Escherichia coli biofilms[J]. Molecular Microbiology, 2010, 37(2): 424-432.
[8] Klemm P, Hjerrild L, Gjermansen M, et al. Structure-function analysis of the self-recognizing Antigen 43 autotransporter protein from Escherichia coli[J]. Molecular Microbiology, 2010, 51(1): 283-296.
[9]趙燕娟,王刚,索朗斯珠.西藏牦牛源肠出血性大肠杆菌毒力基因检测与进化分析[J].中国农业大学学报,2019,24(2):107-114.
[10]陈传荣,韩敏敏,张乃嘉,等.腹泻仔猪致病性大肠杆菌生物膜与耐药性及毒力的相关性[J].微生物学报,2016,43(10):2234-2241.
[11]张海月,康元环,王姣姣,等.大肠杆菌生物被膜与耐药性的关系[J].中国兽药杂志,2015,49(6):62-65.
