基于酵母表面展示技术的耐热木聚糖酶全细胞催化剂的构建及酶学性质研究
2021-05-09邓香连刘清怡熊海容
邓香连,刘清怡,熊海容,张 莉
(中南民族大学生命科学学院,武汉430074)
木聚糖酶(Xylanase)是可将木聚糖降解为低聚木糖和少量木糖的一类酶,主要包括内切木聚糖酶、外切木聚糖酶和木糖苷酶,其中内切木聚糖酶能水解木聚糖主链中的β-1,4糖苷键生成木二糖、木三糖等寡糖,是降解木聚糖最主要的酶[1,2]。木聚糖酶来源广泛,可从动物、植物或微生物中获得,目前研究较多的是来源于细菌或真菌的木聚糖酶[3]。已有多种不同来源的木聚糖酶在多个宿主中成功进行了异源表达,如大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、毕赤酵母等,不同程度地提高了木聚糖酶的表达量[4,5]。
木聚糖酶是一种重要的工业酶制剂,在饲料、造纸、食品、纺织等领域具有广阔的应用前景[6]。但在具体应用过程中环境条件要求较苛刻,如饲料生产制粒工艺中的调质、制粒等过程需要70℃以上的高温处理,使添加的酶活性损失很大,降低了使用效率[7];麻类纺织中苎麻脱胶、造纸中纸浆溶解和漂白等工艺需要强酸、强碱等处理,也会使酶的活性大大降低[8],因此提高酶在高温、酸性、碱性、含有机溶剂等条件下的稳定性受到越来越多的关注。
微生物表面展示技术近年来发展迅速且应用广泛,利用微生物细胞展示酶作为催化剂(也称全细胞催化剂)不仅具有固定化酶的特性,且可省去繁琐的分离纯化操作,制备方法简单,易于回收和再生利用[9]。多项研究显示全细胞催化剂较游离酶表现出更好的稳定性,Yuzbasheva等[10]在解脂耶氏酵母中获得脂肪酶Lip2p的全细胞催化剂,在50℃处理5 h后残留约83%的酶活力,而游离酶在50℃处理1 h酶活力几乎降为零,此外将全细胞催化剂和游离酶用EDTA、SDS、DMSO等试剂处理24 h,全细胞催化剂残余的酶活力均高于游离酶;Wang等[11]在酿酒酵母中展示表达葡萄糖氧化酶GOx,发现GOx全细胞催化剂较游离酶在30~60℃具有更好的热稳定性。
本研究利用酵母表面展示技术将实验室前期筛选获得的耐热木聚糖酶DSB[12]展示表达在毕赤酵母细胞表面获得DSB全细胞催化剂,并对全细胞催化剂和游离酶的酶学性质进行比较分析,为DSB全细胞催化剂的工业应用提供一定的理论依据,也为获得稳定性更好的酶制剂提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒含木聚糖酶DSB基因的重组质粒pPICZαA/DSB由实验室构建并保藏。克隆宿主大肠杆菌Top10、表达宿主巴斯德毕赤酵母X33均由实验室保藏。
1.1.2 主要试剂PrimeSTAR Max DNA聚合酶、限制性内切酶、T4 DNA连接酶、DNA Marker等购于大连宝生物工程有限公司;DNA凝胶回收试剂盒、PCR清洁试剂盒、质粒小量提取试剂盒等购于上海Axy⁃Prep公司;底物木聚糖为实验室自提桦木木聚糖[13];Tryptone和Yeast Extract购于Oxoid公司;山梨醇、琼脂、无氨基酵母氮源YNB、生物素均购于Biosharp公司;DSB游离酶由实验室制备;其他试剂均为国产分析纯。
1.1.3 培养基大肠杆菌培养基LB、大肠杆菌抗性筛选平板低盐LB(含抗生素Zeocin,终浓度25μg/mL)、毕赤酵母培养基YPD、毕赤酵母抗性筛选平板YPDSZ(含抗生素Zeocin,终浓度100μg/mL)、毕赤酵母生长/诱导培养基BMGY/BMMY等配方见Invitrogen公司毕赤酵母操作手册。
1.2 方法
1.2.1 展示表达DSB重组质粒的构建以毕赤酵母细胞壁蛋白Gcw61(Accession in NCBI XP_002 494332)[14]为锚定蛋白,去除自身信号肽后设计引物(表1),并在5'端和3'端分别引入KpnⅠ和NotⅠ位点(下划线标记)。以毕赤酵母X33基因组为模板进行PCR扩增,对获得的GCW61基因片段与质粒pPICZαA/DSB同时进行双酶切,然后进行连接、转化和筛选后获得展示表达DSB重组质粒pPICZαA/DSB-GCW61,并送至武汉擎科生物技术有限公司进行测序验证。
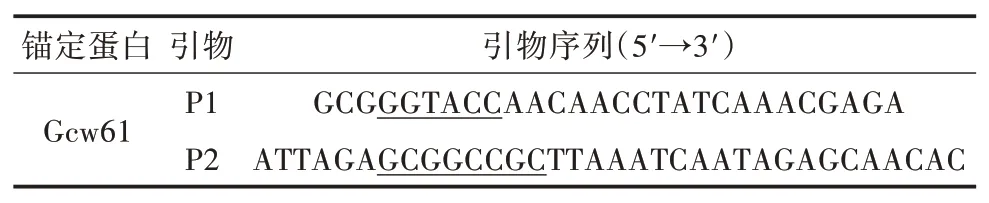
表1 PCR扩增引物序列
1.2.2 展示表达DSB重组菌的构建及诱导表达对pPICZαA/DSB-GCW61使用SacI进行线性化,然后采用电转化法转化宿主菌毕赤酵母X33感受态细胞,涂布于YPDSZ抗性筛选平板上,于28℃培养2~3 d,使用AOX1通用引物对转化子进行菌落PCR鉴定获得展示表达DSB重组菌X33/DSB-GCW61。将该重组菌接种于BMGY培养基中,28℃、250 r/min过夜培养至OD600达2~6,取适量菌体重悬于BMMY培养基中,控制起始OD600约为1,28℃、250 r/min连续发酵168 h,每隔24 h取样,并补加1%的甲醇。以毕赤酵母X33作为阴性对照,所有试验均重复3次。
1.2.3 重组菌的免疫荧光显微镜分析发酵结束后取1 mL菌悬液,离心去除上清,用磷酸盐缓冲溶液(PBS,pH 7.4)洗涤菌体3次,重悬至含10 mg/mL BSA的PBS中,调整样品OD600值约为5。取200μL样品加入鼠源抗6×His标签单抗(1∶200稀释),室温下低速振荡孵育2 h。孵育结束后用PBS洗3次,重悬至含10 mg/mL BSA的PBS中,加入Alexa Flour 488标记羊抗鼠IgG抗体(1∶200稀释)于避光处室温低速振荡孵育1 h。孵育结束后用PBS洗3次,使用激光共聚焦显微镜观察,激发波长为488 nm,以毕赤酵母X33细胞作为阴性对照。
1.2.4 重组菌展示表达DSB酶活力的测定对X33/DSB-GCW61进行诱导表达,每隔24 h取样后离心去除上清,用50 mmol/L pH 6.0磷酸氢二钠-柠檬酸缓冲溶液洗涤菌体3次,然后用等量缓冲溶液重悬后获得DSB全细胞催化剂样品。以0.5%木聚糖为底物,采用DNS法[15]测定酶活力,同时测定菌悬液的OD600值,根据1OD600=0.245 g/L[9]计算出最终酶活力。酶活力单位定义为在最适温度和pH条件下,1 min内水解0.5%木聚糖底物产生1μmol木糖所需要的全细胞催化剂的量。以毕赤酵母X33细胞作为对照,所有试验均重复3次。
1.2.5 DSB全细胞催化剂和游离酶的酶学性质比较分析
1)温度对全细胞催化剂和游离酶酶活力的影响。在pH 6.5条件下,分别在40、50、60、65、70、75、80℃测定全细胞催化剂和游离酶的酶活力,设2种酶的最高酶活力为100%,计算不同温度条件下2种酶的相对酶活力。取用pH 6.5柠檬酸缓冲液适当稀释后的2种酶置于70℃水浴处理2.5 h,每隔30 min测定2种酶的酶活力,设未处理的2种酶的酶活力为100%,计算在70℃条件下处理不同时间2种酶的残余酶活力。
2)pH对全细胞催化剂和游离酶酶活力的影响。分别配制pH 4.0~8.0 50 mmol/L的Na2HPO4-柠檬酸缓冲液体系,以上述缓冲液分别配制0.5%的木聚糖底物,且以对应pH缓冲液稀释2种酶,分别使用上述底物测定2种酶的酶活力,反应温度均为65℃,设2种酶的最高酶活力为100%,计算不同pH条件下2种酶的相对酶活力。分别用pH 3.0和pH 6.0的缓冲液适当稀释2种酶后,放置40℃水浴处理2.5 h,每隔30 min分别测定2种酶的酶活力,设未处理的2种酶的酶活力为100%,计算不同pH条件下处理不同时间2种酶的残余酶活力。
3)高浓度盐对全细胞催化剂和游离酶酶活力的影响。在2种酶的酶活反应体系中分别加入1%、3%、5%、10%、15%的NaCl或KCl,然后在65℃、pH 6.5条件下测定2种酶的酶活力,以不加盐的2种酶的酶活力为100%,计算不同盐浓度条件下2种酶的相对酶活力。
4)有机溶剂对DSB全细胞催化剂和游离酶酶活力的影响。分别配制0~30 %的甲醇、乙醇、正丁醇、丙三醇溶液,用上述不同浓度的有机试剂稀释2种酶并在室温孵育30 min后,在65℃、pH 6.5条件下测定2种酶的酶活力,设未用有机试剂处理的2种酶的酶活力为100%,计算不同浓度有机试剂处理后2种酶的相对酶活力。
5)金属离子和化学试剂对DSB全细胞催化剂和游离酶酶活力的影响。在2种酶的酶活反应体系中加入适量不同金属离子和化学试剂溶液,使其终浓度为1.0 mmol/L,然后在65℃、pH 6.5条件下测定2种酶的酶活力,设未做处理的2种酶的酶活力为100%,计算不同金属离子和化学试剂处理后2种酶的相对酶活力。以上所有试验均重复3次。
2 结果与分析
2.1 展示表达DSB重组菌的构建
以毕赤酵母X33基因组为模板,用引物P1/P2进行PCR扩增获得锚定蛋白Gcw61的基因片段(144 bp),将其与质粒pPICZαA/DSB同时使用KpnⅠ和NotⅠ双酶切,然后进行连接、转化和筛选后获得展示表达DSB的重组质粒pPICZαA/DSB-GCW61,经武汉擎科生物技术有限公司测序验证载体构建成功(图1)。随后将该重组质粒转入毕赤酵母X33,筛选获得展示表达DSB的重组菌X33/DSB-GCW61。
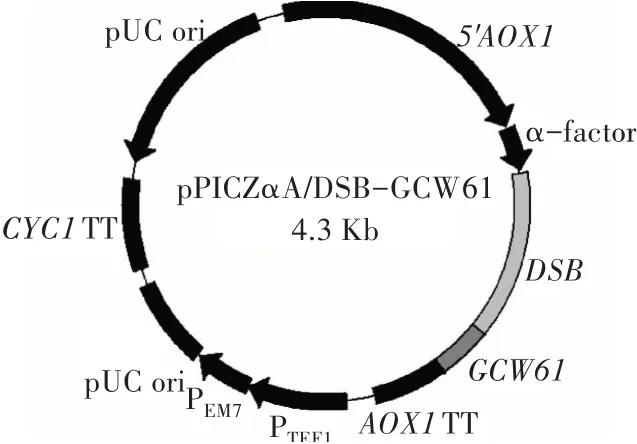
图1 重组质粒pPICZαA/DSB-GCW61
2.2 重组菌荧光的观察
木聚糖酶DSB的N端带有6×His标签,取诱导表达168 h的重组菌使用抗体处理后在激光共聚焦显微镜下观察(激发波长488 nm),结果如图2所示。由图2可见,重组菌细胞发出绿色荧光,表明锚定蛋白Gcw61成功将DSB展示表达在毕赤酵母细胞表面。
2.3 展示表达DSB重组菌的酶活分析
对重组菌X33/DSB-GCW61在摇瓶水平诱导表达168 h,每隔24 h取样,检测木聚糖酶全细胞催化剂的酶活力,结果如图3所示。从图3可以看出,随着发酵时间的增加,DSB全细胞催化剂的酶活力会持续增长,且在72~144 h增长较快,144 h后酶活力趋于稳定,168 h时酶活力最大,达13 510 U/g。
2.4 DSB全细胞催化剂与游离酶酶学性质的比较分析
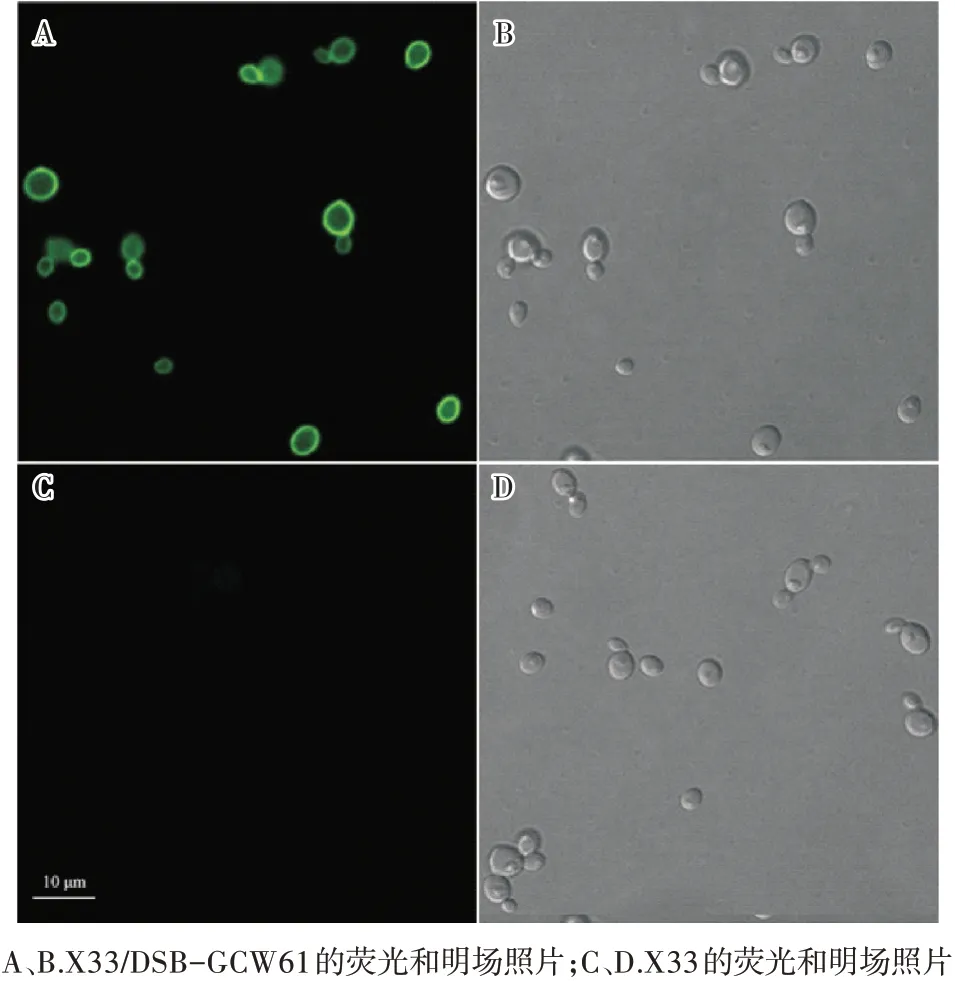
图2 重组菌的荧光显微镜观察
2.4.1 温度对2种酶酶活力的影响测定不同温度下DSB全细胞催化剂和DSB游离酶的酶活力,从图4(A)可以看出,2种酶的最适反应温度均为65℃,属于高温酶,且2种酶在50~75℃都能保持50%以上的相对酶活力,但DSB全细胞催化剂的相对酶活力均高于DSB游离酶。将2种酶在70℃条件下保温处理,监测2种酶酶活力的变化,图4(B)的结果显示随着处理时间的增加,2种酶的酶活力均逐渐降低,但DSB全细胞催化剂的相对酶活力始终显著高于DSB游离酶,在处理120 min时,DSB全细胞催化剂的相对酶活力为50%,而DSB游离酶的相对酶活力已降至30%。工业应用中很多工艺需高温处理,如饲料加工制粒过程温度会高达70℃以上,DSB全细胞催化剂比DSB游离酶具有更好的耐热性,这一特性使其在饲料行业具有较好的应用前景。
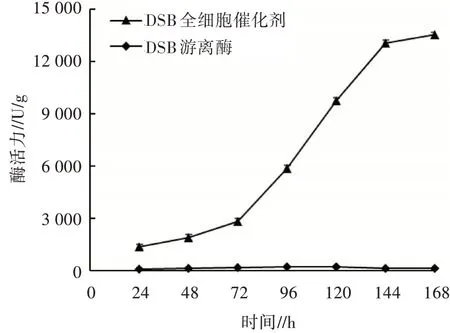
图3 2株菌的酶活曲线
2.4.2 pH对2种酶酶活力的影响测定不用pH条件下DSB全细胞催化剂和DSB游离酶的酶活力,结果见图5(A),2种酶的最适反应pH均为6.5,在pH 5.0~7.5均可保持60%以上的相对酶活力,但DSB全细胞催化剂的相对酶活力略高于DSB游离酶。将2种酶在pH 3.0和pH 6.0酸性条件下处理,监测2种酶酶活力的变化,从图5(B)可以看出,在pH 6.0、40℃条件下处理150 min,DSB全细胞催化剂的酶活力无明显下降,而DSB游离酶的酶活力下降约7%;而在pH 3.0、40℃条件下处理90 min,2种酶可以保持80%以上的相对酶活力,处理150 min也可保持60%以上的相对酶活力,DSB全细胞催化剂的相对酶活力均略高于DSB游离酶。表明DSB全细胞催化剂比DSB游离酶在酸性环境中更稳定,适用于工业应用中的酸性环境。
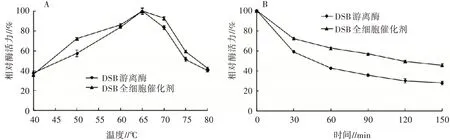
图4 DSB全细胞催化剂和DSB游离酶的最适反应温度(A)及热稳定性(B)
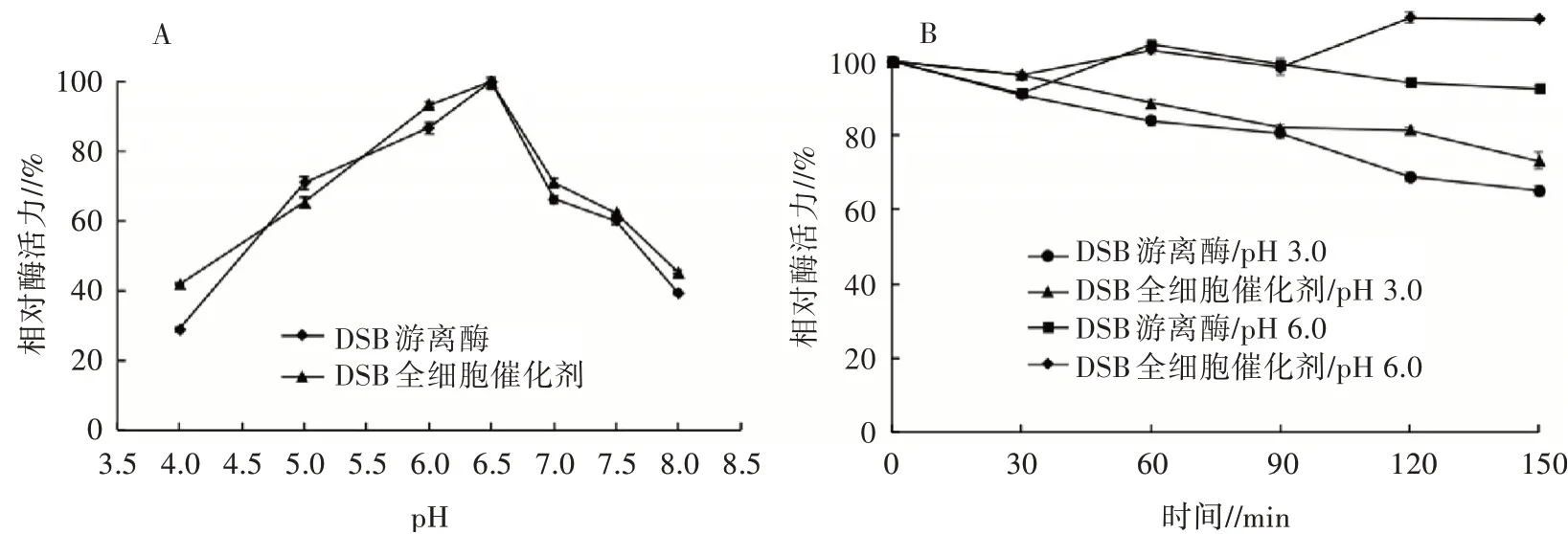
图5 DSB全细胞催化剂和游离酶的最适pH(A)及pH稳定性(B)
2.4.3 不同浓度NaCl和KCl对2种酶酶活力的影响在含不同浓度NaCl或KCl条件下分别测定2种酶的酶活力,从图6(A)可以看出,当NaCl浓度在1%~5%时2种酶的酶活力均略有提高,当NaCl浓度高达10%和15%时,2种酶仍能维持80%以上的相对酶活力,但DSB全细胞催化剂的相对酶活力略高于DSB游离酶。而1%~15%的KCl对2种酶的酶活均有不同程度的促进作用,当KCl浓度为3%时DSB全细胞催化剂和DSB游离酶酶活力提高最多,分别达115%和113%。结果表明,DSB全细胞催化剂和DSB游离酶在高浓度盐溶液中均能保持较高的酶活力,且DSB全细胞催化剂的耐盐性更强,因此适用于工业中高盐的环境。
2.4.4 有机溶剂对2种酶酶活力的影响4种常见有机溶剂对2种酶酶活力的影响见图7。图7(A)显示5%~15%的甲醇对DSB全细胞催化剂的酶活力有显著的促进作用,其中5%甲醇处理后DSB全细胞催化剂的相对酶活力增加幅度最大,达138%,且30%甲醇处理后DSB全细胞催化剂仍能维持94%的相对酶活力;而DSB游离酶的酶活力随着甲醇体积分数的增加呈缓慢下降趋势,30%甲醇处理后DSB游离酶残余87%的相对酶活力。乙醇对2种酶酶活力的影响结果如图7(B)所示,随着乙醇体积分数的提高,2种酶的酶活力均缓慢降低,30%乙醇处理后2种酶均能维持75%以上的相对酶活力,但DSB全细胞催化剂的相对酶活力均略低于DSB游离酶。图7(C)的结果显示,5%丙三醇处理后DSB游离酶的相对酶活力增加至106%,随后随着丙三醇体积分数的提高其相对酶活力逐渐降低,30%丙三醇处理后残留约60%的相对酶活力,而DSB全细胞催化剂随着丙三醇体积分数的增加相对酶活力逐渐降低,且降低趋势与游离酶基本一致。正丁醇对2种酶酶活力的影响见图7(D),5%正丁醇处理后DSB全细胞催化剂和DSB游离酶的酶活力分别提高至122%和110%,随后随着正丁醇体积分数的提高2种酶的酶活力略微降低,30%正丁醇处理后2种酶均能保留90%以上的相对酶活力。
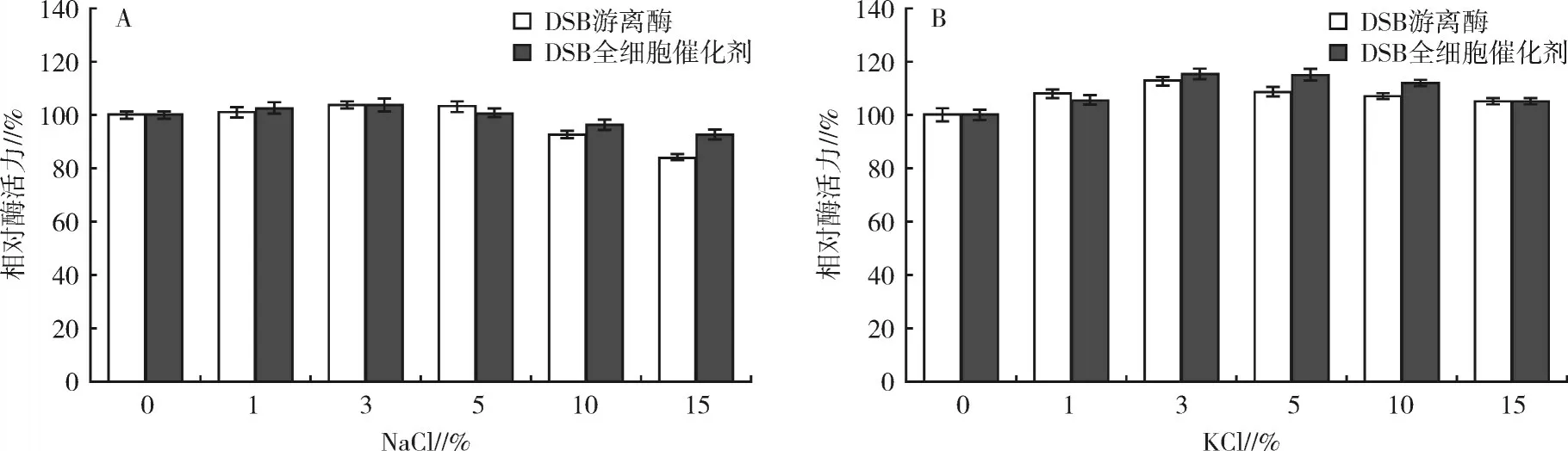
图6 不同浓度NaCl和KCl对2种酶酶活力的影响
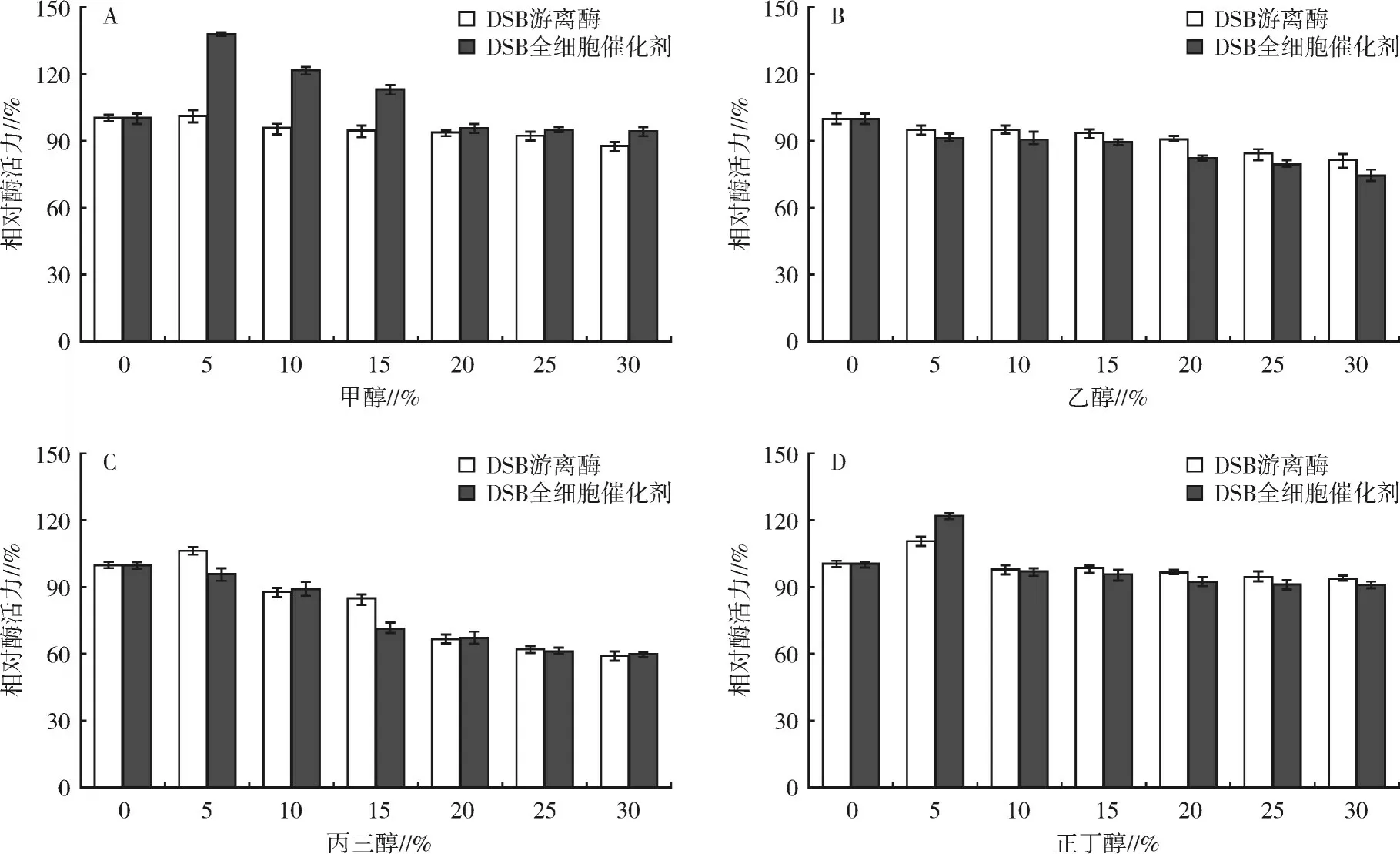
图7 不同浓度有机溶剂对2种酶酶活力的影响
2.4.5 金属离子和化学试剂对2种酶酶活力的影响不同金属离子和化学试剂对2种酶酶活力的影响见表2。Na+、K+、Ca2+、Mg2+、Ni2+对2种酶酶活力均有不同程度的促进作用,且除Mg2+、K+外,其他金属离子存在时DSB全细胞催化剂酶活力的提高幅度均高于DSB游离酶;Zn2+对DSB游离酶酶活力有轻微的抑制作用,而对DSB全细胞催化剂酶活却有显著的促进作用,其相对酶活力提高至120.05%;Mn2+、Pb2+、Fe3+、SDS、EDTA对2种酶酶活力均有不同程度的抑制作用,且同种金属离子或化学试剂导致2种酶酶活力的下降幅度无显著差别;Cu2+对2种酶酶活力均有显著的抑制作用,DSB全细胞催化剂和DSB游离酶的酶活力分别下降至38.84%和52.79%;Li+、Co2+对2种酶酶活力无明显影响。表明DSB全细胞催化剂和DSB游离酶对大部分金属离子和化学试剂有一定耐受性,且DSB全细胞催化剂的耐受性优于DSB游离酶。
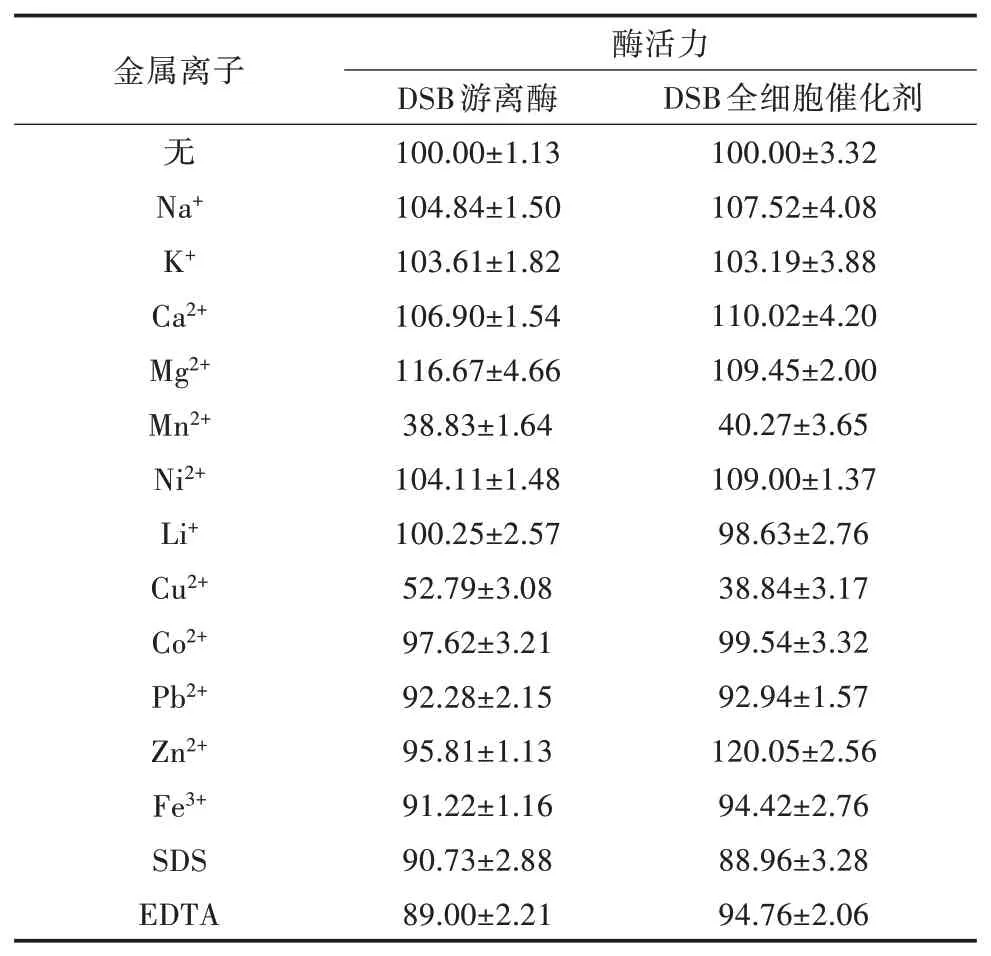
表2 不同金属离子和化学试剂对2种酶酶活力的影响(单位:%)
3 小结与讨论
目前已有多种不同来源的木聚糖酶在大肠杆菌、毕赤酵母、枯草芽孢杆菌等多个宿主中成功进行异源表达[16-18],但大部分均为分泌表达,需进行繁琐的分离和纯化后才能进行应用。利用微生物表面展示技术将酶展示表达在微生物细胞表面获得全细胞催化剂,可省去繁琐的分离纯化步骤,制备方法简单[19]。本研究利用毕赤酵母表面展示技术,以细胞壁蛋白Gcw61为锚定蛋白,将实验室前期筛选获得的耐热木聚糖酶DSB进行展示表达,摇瓶发酵获得的DSB全细胞催化剂的酶活力最高达13 510 U/g,高于木聚糖酶在其他宿主中展示表达的酶活力[4,20]。锚定蛋白的选择对展示表达的酶活力有一定的影响,后续研究可选用更多的锚定蛋白进一步提高DSB全细胞催化剂的酶活力[21]。
木聚糖酶在饲料、造纸、食品、纺织等领域具有广阔的应用前景,然而在具体应用过程中会有一些苛刻的环境条件,如高温环境、强酸环境、高盐环境、含有机溶剂的环境等,会对酶的活性造成很大的影响,从而降低了使用效率[22]。有研究表明在苛刻环境条件下全细胞催化剂较游离酶表现出更优的稳定性,Chen等[4]将来源于Cellulomonas fimi的木聚糖酶Cex展示表达在大肠杆菌细胞表面,Cex全细胞催化剂在40~65℃能维持70%以上的相对酶活力,而Cex游离酶在55℃时酶活力已降至43%,Cex全细胞催化剂在pH 6~8能维持约100%的相对酶活力,而Cex游离酶在pH 8时仅残余29%相对酶活力;Yuzba⁃sheva等[10]在解脂耶氏酵母中构建获得脂肪酶Lip2p的全细胞催化剂,将全细胞催化剂和游离酶分别用EDTA、SDS、DMSO、Tween 80、Triton X-100试剂处理24 h,全细胞催化剂残余的酶活力均高于游离酶。本研究将制备的DSB全细胞催化剂与DSB游离酶的酶学性质进行了比较,分析发现在70℃高温条件和pH 3.0的酸性条件下,DSB全细胞催化剂的稳定性均优于DSB游离酶;此外在高浓度NaCl、高浓度甲醇、多种金属离子(Na+、Ca2+、Ni2+)的环境条件下,DSB全细胞催化剂均能维持较高的酶活力且稳定性优于DSB游离酶,为DSB全细胞催化剂的工业应用提供一定的理论依据,也为获得稳定性更好的酶制剂提供一定的理论基础。
