乳腺癌化疗性肝损伤相关危险因素的研究
2021-05-08刘欣金龚立勤
刘欣金 龚立勤


【摘要】 目的:探讨乳腺癌化疗性肝损伤的相关危险因素。方法:选择2015年1月-2019年12月在本院接受化疗的106例乳腺癌患者的资料进行回顾性分析。对全部患者发生化疗性肝损伤的情况进行描述。按照患者是否发生化疗性肝损伤分组,分为病例组33例和对照组73例。通过单因素分析与多因素分析的方式,筛选乳腺癌化疗性肝损伤的相关危险因素。结果:2015年1月-2019年12月在本院接受化疗的乳腺癌患者共106例,33例患者发生化疗性肝损伤,发病率为31.13%。年龄、BMI、化疗方案、乙肝病毒感染、糖尿病是乳腺癌患者发生化疗性肝损伤的独立危险因素(P<0.05)。结论:多种因素均可导致乳腺癌患者出现化疗性肝损伤,需要进行具有针对性的干预。
【关键词】 乳腺癌 化疗性肝损伤 恶性肿瘤 毒副反应
Study on Risk Factors Associated with Chemotherapy-induced Liver Injury in Breast Cancer/LIU Xinjin, GONG Liqin. //Medical Innovation of China, 2021, 18(05): -136
[Abstract] Objective: To investigate the risk factors associated with chemotherapy-induced liver injury in breast cancer. Method: The data of 106 breast cancer patients who received chemotherapy in our hospital from January 2015 to December 2019 were retrospectively analyzed. The occurrence of chemotherapy-induced liver injury in all patients were described. Patients were divided into case group (n=33) and control group (n=73) according to the occurrence of chemotherapy-induced liver injury. Univariate analysis and multivariate analysis were used to screen the risk factors of breast cancer chemotherapy-induced liver injury. Result: In January 2015 to December 2019, 106 patients received chemotherapy in our hospital, and 33 patients developed chemotherapy induced liver injury, the incidence rate was 31.13%. Age, BMI, chemotherapy regimen, hepatitis B virus infection and diabetes mellitus were independent risk factors for chemotherapy-induced liver injury in breast cancer patients (P<0.05). Conclusion: Many factors can lead to chemotherapy-induced liver injury in patients with breast cancer, which needs targeted intervention.
[Key words] Breast cancer Chemotherapy-induced liver injury Malignant tumor Toxic side effects
First-authors address: Dongguan Kanghua Hospital, Dongguan 523000, China
doi:10.3969/j.issn.1674-4985.2021.05.034
乳腺癌是我國乃至全球范围内女性人群极为常见的一类恶性肿瘤,近年来随着我国人口数量的增加以及各种不良生活习惯等的共同影响,乳腺癌的发病例数以及死亡例数等逐渐增加,已经对女性人群健康构成严重威胁,甚至是导致人群健康寿命明显降低的主要原因之一[1-2]。根据近期的报道显示,全世界的女性人群中,每年乳腺癌的新发病例数超过160万,而其中接近60%的比例均为不发达国家以及地区的人群[3-4]。乳腺癌的研究历来就是医学界所关注的焦点,其治疗方式目前也存在手术、化疗、放疗以及靶向治疗等多种类型[5]。其中化疗属于研究的较为透彻的一类治疗方法,作为绝大多数乳腺癌患者所使用的治疗方式,化疗对于控制患者的病情发展,延长寿命以及维持生命质量方面起到值得肯定的效果[6]。但是化疗的使用一直伴随着毒副反应的问题,由于化疗药物对于细胞杀伤存在普遍性,无论是癌细胞还是体内的正常细胞,均在化疗药物的作用范围内,因此在对肿瘤细胞杀伤的同时,人体也需要承受相当的风险。化疗性肝损伤就是其中十分典型的一类。依据医学定义,化疗性肝损伤是化疗药物或者其代谢产物对肝脏构成的损伤,归属药物性肝脏损伤的范畴内[7-8]。根据我国卫计委所公布数据,我国人群的药物性肝损伤年发病率在24/10万左右,也成了导致肝脏疾病以及死亡的主要原因之一[9]。化疗性肝损伤的轻症患者能够通过调整化疗药量缓解病情,重症则有可能出现肝功能衰竭而死亡。鉴于化疗性肝损伤的危害,本研究选择2015年1月-2019年12月在本院接受化疗的106例乳腺癌患者的资料进行回顾性分析,探讨乳腺癌化疗性肝损伤的相关危险因素,希望为该种疾病的防治提供一定的数据线索,现报道如下。
1 资料与方法
1.1 一般资料 选择2015年1月-2019年12月在本院接受化疗的106例乳腺癌患者的资料进行回顾性分析。(1)纳入标准:①确诊为乳腺癌的女性,在本院接受手术治疗后采用化疗治疗方案,术前未接受新辅助化疗方案;②TNM分期在Ⅰ~Ⅲ期;③部分患者确诊为化疗性肝损伤,且关于本次研究的数据资料完整。(2)排除标准:①治疗前肝功能已经异常;②体内重要脏器具有严重功能障碍,对研究结果构成干扰。本研究通过医院医学伦理委员会审查并获得许可。
1.2 方法 (1)按照纳入和排除标准,查阅患者的病历信息,采集相关数据并进行分析。主要包括患者的年龄、身高、体重、吸烟、饮酒、绝经、TNM分期、化疗方案、长期服药史、乙肝病毒感染、肝脏基础性疾病、糖尿病、是否出现化疗性肝损伤等。(2)化疗性肝损伤的判定依据国际医学科学委员会在1990年颁布的标准:①血清谷丙转氨酶或者结合胆红素水平上升到正常值上限的二倍或以上;②血清谷丙转氨酶、谷草转氨酶和总胆红素同时上升,其中一项指标上升到正常值上限的二倍或以上。以上2条满意任意1条即可诊断[10]。(3)患者的化疗方案分为三联方案和二联方案。三联方案为TAC(多西他赛+多柔比星+环磷酰胺),二联方案为TC(多西他赛+环磷酰胺)和AC(多柔比星+环磷酰胺)。长期服药史是指患者在化疗前半年内连续使用药物的时间超过3个月。乙肝病毒感染是指患者的乙型肝炎病毒表面抗原呈阳性。
1.3 观察指标 (1)对全部患者发生化疗性肝损伤的情况进行描述。(2)按照患者是否发生化疗性肝损伤分组,分为病例组33例和对照组73例,通过单因素分析与多因素分析的方式,筛选乳腺癌化疗性肝损伤的相关危险因素。
1.4 统计学处理 采用SPSS 22.0软件对所得数据进行统计分析,计量资料用(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验。利用logistic多因素回归分析筛选独立危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 患者发生化疗性肝损伤的情况 2015年1月-2019年12月在本院接受化疗的乳腺癌患者共106例,33例患者发生化疗性肝损伤,发病率为31.13%。
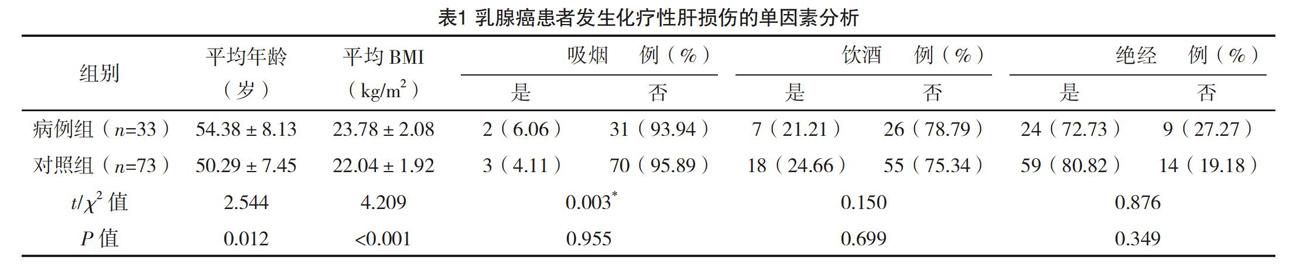
2.2 乳腺癌患者发生化疗性肝损伤的单因素分析 对年龄等因素进行分析,结果显示,平均年龄、平均BMI、化疗方案、乙肝病毒感染、糖尿病可能与乳腺癌患者发生化疗性肝损伤有关(P<0.05)。见表1。
2.3 乳腺癌患者发生化疗性肝损伤的多因素分析 按照患者是否发生化疗性肝损伤分组,其中对照组=0,病例组=1,对以上单因素分析中出现阳性结果的项目进行多因素分析,分类变量赋值结果如表2所示,变量纳入方法为“进入”,结果显示年龄、BMI、化疗方案、乙肝病毒感染、糖尿病是乳腺癌患者发生化疗性肝损伤的独立危险因素(P<0.05),见表3。
3 讨论
乳腺癌在我国人群中的发病率近些年逐渐升高,且发病年龄也呈现出低龄化的趋势。虽然在医学科技飞速发展的基础上,乳腺癌在众多恶性肿瘤中已经属于治疗后生存时间较长的病变类型,但其恶性病变的本质以及无法治愈的属性目前难以改变[11-12]。化疗是治疗各类恶性肿瘤较为常用的方法之一。采用化疗药物能够对癌细胞构成杀伤,但该种杀伤不具有选择性,人体的正常细胞也会被破坏,由此导致的毒副反应成为限制化疗效果以及患者接受程度的瓶颈[13]。本研究将乳腺癌患者的化疗性肝损伤作为探讨的核心。肝脏是人体内最重要的代谢器官,包括化疗药物在内的各类药物及代谢均会对肝细胞产生直接的影响,而一般这种影响均具有破坏性。对于肝细胞结构以及代谢过程的破坏会对肝功能产生极大的损伤,轻症患者会延误治疗的进程,重症患者则可能对生命安全构成威胁。因此对化疗性肝损伤的危险因素探讨具有十分重要的现实意义。
通过本研究的结果显示,年龄、BMI、化疗方案、乙肝病毒感染、糖尿病为乳腺癌患者发生化疗性肝损伤的独立危险因素。人体的肝脏细胞具有强大的自我修复能力,作为人体内最大的代谢以及解毒器官,肝脏的生理功能以及免疫功效均会随着年龄的增加而衰退,高龄患者的肝细胞受到药物损伤之后,其自我修复能力也不足以维持肝细胞的正常水平[14],因此年龄的增加成为独立的危险因素。BMI是由人体的身高以及体重构成的指标,但是对于成年人而言,BMI数值的改变主要是因为体重的变化,而不是身高的变化。BMI数值较高的患者一般意味着体内脂肪含量过多却存在不同程度的脂质代谢异常现象。脂肪的过度堆积不仅导致肝脏的生理负担加重,而且肝脏中聚集的脂滴也可以促使肝脏出现脂肪变性,对肝功能产生直接的干扰[15]。本研究中的患者全部接受化疗方案。化疗药物和药物的代谢产物对肝细胞会不可避免的出现损伤效果。氟尿嘧啶可以诱发肝脏的脂肪变性,导致肝细胞损伤[16],紫杉醇可直接破坏肝细胞[17]。本研究结果显示,三联化疗方案的患者出现肝损伤的风险明显高于二联方案,这提示随着化疗药物种类的增加,发生化疗性肝损伤的风险也在提升。这不仅是由于药物对于肝脏损伤的叠加效果,而且也是药物之间的相互作用抑制了肝脏的解毒功能,导致毒素累积无法排出,加重了肝脏的损伤。本研究中的化疗方案主要含有环磷酰胺,该药物可以抑制胆碱酯酶的活性,直接损伤肝脏。乙肝病毒本来就是嗜肝性病毒,能够在肝臟内持续的增殖,对正常肝细胞构成损伤。化疗药物的使用会对人体产生免疫抑制效果,使乙肝病毒的增殖无法受到限制,被激活的乙肝病毒会更加疯狂的增殖,加重肝部损伤[18-19]。糖尿病也是独立的危险因素。人体的肝脏在糖代谢中扮演着极为重要的角色,肝糖原聚集过度可以诱发肝脏的微血管病变,使肝脏无法得到充分的氧供以及血供,大量的氧自由基生成后可诱发广泛的氧化应激损伤以及炎性因子的释放,构成肝功能损伤。这同时也是糖尿病导致肝损伤的主要机制[20]。研究中还对TNM分期等可能的因素进行分析,但从结果可见,并不是独立的危险因素,这可能与本研究所纳入的样本量较少有关。在今后仍然需要采用大样本量的调查,对本研究的结果进一步分析。
综上所述,多种因素均可导致乳腺癌患者出现化疗性肝损伤,需要进行具有针对性的干预。
参考文献
[1] Desantis C E,Ma J,Sauer A G,et al.Breast cancer statistics, 2017, racial disparity in mortality by state[J].Ca Cancer J Clin,2017,67(6):439-448.
[2]孙淼,杨歌,赵毅,等.乳腺癌生物标志物钙网蛋白的核酸适配体筛选及血清检测和乳腺癌细胞识别[J].分析化学,2020,48(5):642-649.
[3] Siegel R L,Miller K D,Jemal A.Cancer statistics, 2015[J].CA: A Cancer Journal for Clinicians,2015,65(1):5-29.
[4]叶慧贞,郑琎,章月照.益气化瘀利水汤治疗乳腺癌根治术后患者上肢淋巴水肿的疗效观察[J].中国中医药科技,2020,27(3):429-430.
[5] Pilgrim C H C,Thomson B N,Banting S,et al.The developing clinical problem of chemotherapy-induced hepatic injury[J].ANZ Journal of Surgery,2012,82(1-2):23-29.
[6]徐明华,陈静.妊娠期乳腺癌患者围手术期及化疗的护理[J].海军医学杂志,2020,41(2):215-217.
[7]尹雨桐,米秀芳,顾健.保肝药预防急性髓性白血病初次化疗致肝损伤的效果分析[J].临床药物治疗杂志,2019,17(8):53-56.
[8]王立军,王崑,邢宝才.吲哚菁绿清除试验在结直肠癌肝转移患者化疗性肝损伤评估中的作用[J/OL].中华结直肠疾病电子杂志,2019,8(4):353-357.
[9]沈弢,黄昕,王誉雅,等.我国药物性肝损伤流行病学研究现状[J].临床肝胆病杂志,2018,34(6):1152-1155.
[10] Bénichou C.Criteria of drug-induced liver disorders[J].Journal of Hepatology,1990,11(2):272-276.
[11]陈菲.乳腺癌骨转移患者预后相关因素[J].中国肿瘤生物治疗杂志,2020,27(2):191-198.
[12]孙丽丽,张振,潘晴.乳腺癌患者手术前后相关实验室数据的检测意义[J].检验医学与临床,2020,17(8):1061-1062,1066.
[13]陈雁,彭敏婕,刘宁.静脉注射托烷司琼治疗乳腺癌化疗所致恶心呕吐用药时机分析[J].中国药业,2020,29(8):112-114.
[14] Shu C C,Lee C H,Lee M C,et al.Hepatotoxicity due to first-line anti-tuberculosis drugs: a five-year experience in a Taiwan medical centre[J].Int J Tuberc Lung Dis,2013,17(7):934-939.
[15] Hagstrm H,Tynelius P,Rasmussen F.High BMI in late adolescence predicts future severe liver disease and hepatocellular carcinoma: a national, population-based cohort study in 1.2 million men[J].Gut,2018,67(8):1536-1542.
[16] Wang S C,DAngelica M I.Chemotherapy-Associated Hepatotoxicity and Hepatic Resection for Metastatic Colorectal Cancer[J].Current Colorectal Cancer Reports,2014,10(2):195-203.
[17]饶媚,郭丽珍,赖剑锋,等.含紫杉醇联合方案引起肝功能异常的临床分析[J].现代医院,2013,13(10):5-7.
[18] Jang J W.Hepatitis B virus reactivation in patients with hepatocellular carcinoma undergoing anti-cancer therapy[J].World J Gastroenterol,2014,20(24):7675-7685.
[19] Meng Y,He S,Liu Q,et al.High prevalence of hepatitis B virus infection in primary central nervous system lymphoma[J].Int J Clin Exp Med,2015,8(6):9937-9942.
[20] Hazlehurst J M,Woods C,Marjot T,et al.Non-alcoholic fatty liver disease and diabetes[J].Metabolism,2016,65(8):1096-1108.
(收稿日期:2020-06-09) (本文編辑:姬思雨)
