棉花植株发病程度与土壤大丽轮枝菌含量的相关性
2021-04-29权永刚陈爱民陈全家吴家和胡保民
盖 凯,唐 叶,权永刚,陈爱民,陈全家,吴家和,胡保民,
(1.新疆农业大学农学院农业技术重点实验室棉花教育部工程研究中心,乌鲁木齐830052;2.农业部西北棉花品种创新重点实验室九圣禾种业股份有限公司,昌吉831100;3.中国科学院微生物研究所植物基因组国家重点实验室,北京100101)
棉花是一种重要的经济作物[1]。棉花纤维是纺织 工业的重要原料[1]。由大丽轮枝菌(Verticillium dahli⁃ae)引起的棉花黄萎病是影响当前棉花生产的最重要因素之一,因此如何防治黄萎病发生成为当前棉花生产的一个主要问题。
棉花黄萎病俗称棉花的“癌症”,在生产上难以防治[2]。发生面积涉及我国各大种植棉区。然而,在不同年份、不同地区甚至不同棉花单株黄萎病发生程度各不相同;棉花黄萎病发病程度的不均匀性是其主要特征,因此,往往采取病指来对抗感材料进行分类[3⁃5]。一般认为棉花黄萎病发病不均匀原因包括:土壤中病原菌含量不同、单株之间的生长状况不同、农田小气候差异等[6⁃12]。
土壤中黄萎病菌含量应该包括其孢子、菌丝和微菌核等[13⁃14]。测定土壤中大丽轮枝菌的含量可能对棉花抗黄萎病生产有着重要的意义。魏锋等[15]利用土样水筛提纯微菌核和实时荧光定量检测对土壤中黄萎病微菌核量;罗舒文等[10]利用培养土壤中微菌核进行定量检测,探明棉花黄萎病菌的分布区域及在土壤中的动态变化过程;李艳[16]通过菌丝生长速率法,对棉花黄萎病菌的菌丝及微菌核进行统计。但是,对于棉田棉株发病程度差异尚鲜见报道。
本研究利用盆栽棉花作为实验模型,探讨不同时间点病原菌含量的变化与植株发病程度直接关系,并结合一种抑制大丽轮枝菌生长的抑制菌——枯草芽孢杆菌和常年发病严重的病圃地土壤为正负对照,探索棉花黄萎病发病程度与土壤中大丽轮枝菌含量的相关性,以期为棉花抗病生产提供一定的理论依据和实践保证。
1 材料与方法
1.1 材料
1.1.1 供试材料和棉花栽培
本实验所用大丽轮枝菌(V.dahliae)菌株“V991”以及枯草芽孢杆菌(Bacillus subtilis)于本实验室保存。陆地棉(Gosspium hirsutum)新陆早57 由九圣禾种业股份公司提供,盆栽供试土壤样品采集于新疆昌吉市九圣禾产业园区内,没有大丽轮枝菌污染;病圃地土壤来自新疆玛纳斯县六户地镇黄萎病抗性鉴定试验地。
将接菌和对照土壤装入花盆(15 cm × 15 cm)中,然后将盆埋入土中10 cm;在盆里直接播种,最后定苗为每盆1 株。浇水、施肥等农田管理和日常农田管理一致;实验重复3次。
1.1.2 相关试剂盒与引物
DNA 提取试剂盒DNeasy powerSoil Kit 购自德国QIAGEN 公司;DNA 聚合酶2×Super Pfx Master Mix 购自聚合美生物公司;其余试剂盒购自北京擎科生物有限公司。测序及引物合成均由北京擎科公司完成。
1.2 方法
1.2.1 黄萎病菌和枯草芽孢杆菌的活化培养及接种
将用于本实验的黄萎病菌菌株“V991”和枯草芽孢杆菌活化,分别接种至Czapek 和LB 培养液中,使大丽轮枝菌孢子液浓度为1×108mL-1,枯草芽孢杆菌菌液浓度OD600为1.39。将收集到的孢子液及菌液接种土壤,按10 kg土壤50 mL菌量接种。
1.2.2 土壤黄萎病菌基因组DNA提取
将盆栽和温室中接种了黄萎病菌和枯草芽孢杆菌的土壤及棉花病圃地土壤样品分别称取0.1 g,根据土壤样品基因组提取试剂盒DNeasy powerSoil Kit 说明书提取样品DNA进行qPCR分析。
1.2.3 实时荧光定量PCR 定量分析土壤中大丽轮枝菌含量
qPCR 特异引物参照中国农业大学张力群教授提供的大丽轮枝菌glyceraldehyde⁃3⁃phosphate dehydroge⁃nase(G3PD)基因序列。通过Primer premier 5软件设计引物qG3PD⁃F/R,该对引物在NCBI 上进行全物种Blast,结果显示为大丽轮枝菌特异序列。实时荧光定量PCR 按照擎科SYBR Green qPCR Master mix 试剂盒说明书进行操作,以qG3PD⁃F/R 为引物扩增,其中qG3PD⁃F:5'⁃cacggcgtcttcaagggt⁃3',qG3PD⁃R:5' cagtg⁃gactcgacgacgtac⁃3',反应体系为20 μL:SYBR Green qP⁃CR Master mix 10 μL,稀释模板DNA 20 ng/μL,引物qG3PD⁃F/R 各1.0 μL,加ddH2O 补齐至20 μL。扩增条件为:95 ℃预变性1 min;95 ℃变性10 s,58 ℃退火5s,72 ℃延伸15 s,40 个循环。将已知浓度的GFP 质粒作为荧光定量的质粒作为内参,进行实时荧光定量PCR扩增[17]。
1.2.4 水洗涂布菌落计数和PCR鉴定大丽轮枝菌落
称取土样5 g,根据Yang 等[18]的实验方法,对土壤中的黄萎病菌进行水筛,并涂布于PDA 培养基上,待菌落形成时,利用PCR对大丽轮枝菌菌落进行鉴定,然后计数,实验重复3次。
常规PCR反应所用大丽轮枝菌特异引物序列由中国农业大学张力群教授提供,引物扩增基因为G3PD。其中G3PD⁃F:5'⁃gtctatcatgtgctggggttctcc⁃3',G3PD⁃R:5'⁃gagatgatgaccttcttggcgcc⁃3',扩增体系为25.0 μL:模板DNA 20 ng/μL,引物G3PD⁃F/R 各0.5 μL,2×Super Pfx Master Mix 10 μL,加ddH2O 补齐至25 μL。扩增条件:98 ℃预变性30 s;98 ℃变性10 s,56 ℃退火30 s,72 ℃延伸30 s,32个循环;72 ℃再延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测。
1.2.5 发病程度分析
参照农业部棉花抗性鉴定方法与评价标准进行病级划分,发病等级分为0、1、2、3 和4,统计5 个病级的棉花植株,根据植株的发病等级计算接菌植株的发病指数(Disease index,DI),病指计算参照Wang 等[4]并进行适当修改。
将浸染后的植株截取子叶节以下相同部位的茎秆进行徒手斜剖,观察其木质部褐化程度,参照Fradin等[2]方法,将徒手横剖的植株茎秆进行表面消毒,于PDA培养基上恢复培养。
1.2.6 数据统计分析
通过Excel 2010、GraphPad 5和SPSS 21.00等软件进行数据统计分析。
2 结果与分析
2.1 棉花植株之间发病程度差异分析
棉花植株发病程度差异较大,幼苗接种等量的黄萎病菌时,植株发病程度存在明显差异(图1),发病程度5 个级别植株分别为26%、11%、17%、6%和40%,发病指数为51%。统计分析表明,不同发病程度植株的株高、始节高度、果枝数、有效果指枝数、结铃数和铃重等农艺性状呈现显著性差异(表1)。

图1 棉花个体之间的发病程度差异性Figure 1 The difference of disease degree among cotton individuals
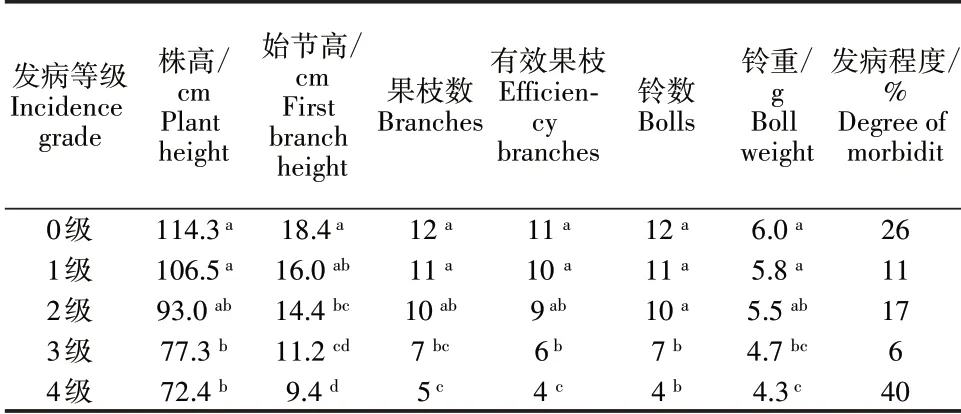
表1 不同盆栽植株农艺性状Table 1 Agronomic character of different potted plants
2.2 土壤大丽轮枝菌含量分析
利用试剂盒提取盆栽土壤中的总DNA,电泳分析表明这些DNA 质量较好(图2),满足qPCR 分析要求。qPCR 分析结果表明:不同取样时间土壤中大丽轮枝菌的相对含量存在显著差异;同一时间点,不同盆栽土壤病菌量差异也为显著水平(图3)。
图2 土壤提取DNA凝胶分析Figure 2 Gel analysis of DNA extracted from soil

图3 土壤中大丽轮枝菌相对含量Figure 3 The relative contents of V.dahliae in soil
使用水洗涂布和PCR 鉴定相结合进一步测定土壤中大丽轮枝菌含量,盆栽土壤浸提液稀释后平板真菌菌落生长情况见图4(a),对不同类型菌落进行PCR扩增鉴定[图4(b)],并进行菌落计数。统计分析表明不同时间点和盆栽土壤病原菌含量呈显著差异,并且随着时间的后移差异越大(表2)。

图4 病圃土壤中真菌菌落分析和鉴定Figure 4 Analysis and identification of fungal colonies in disease nursery soil

表2 盆栽棉株土壤不同时间点大丽轮枝菌含量的方差分析Table 2 Variance analysis of the content of V.dahliae in potted cotton plant soil at different time points
2.3 植株发病程度与土壤大丽轮枝菌含量的相关性
对不同植株的发病程度与其土壤含菌量qPCR 结果进行协方差分析,以土壤样品的发病级数为纵轴(y),Ct值为横轴(x),建立的曲线方程为y = -0.159x +8.289,该方程的相关系数为0.869,说明不同盆栽苗的发病程度与不同时间点土壤里病原菌含量存在相关性,随着时间的推移相关性增大(图5)。

图5 植株发病程度与土壤大丽轮枝菌含量的相关性分析Figure 5 The correlation analysis between the disease degree of individual plant and the V.dahliae content in soil
2.4 枯草杆菌抑制大丽轮枝菌生长影响植株发病程度
为进一步证明土壤大丽轮枝菌含量与植株发病程度的相关性,一个能抑制大丽轮枝菌生长的菌株(枯草芽孢杆菌)被应用。在使用枯草芽孢杆菌的盆里,棉花植株发病很轻或不发病(图6)。用涂布平板和PCR 分析,枯草芽孢杆菌处理盆栽土壤大丽轮枝菌含量显著低(图6)。这些数据再次证明了土壤中大丽轮枝菌含量低,其对应的植株发病程度轻或不发病。

图6 枯草芽孢杆菌抑制黄萎病的发病程度分析Figure 6 Analysis of Verticillium wilt in habited by Bacillus subtilis
为从另一个方向证明土壤大丽轮枝菌含量与植株发病程度的相关性,选取新疆常年发病病圃土壤作为对照,这些病圃中棉花植株发病均为4 级程度[图7(a)]。每个病圃地的微菌核量可以达到每克土壤50个以上,qPCR 分析结果表明这些土壤中的大丽轮枝菌相对含量达到1.25×105以上,为盆栽土壤含量的100倍(图7),0~4 级植株发病程度分析分别为3.85%、6.25%、4.52%、8.94%和76.44%,发病指数为85.92%,这些数据表明土壤中大丽轮枝菌含量直接决定棉花植株发病程度。

图7 病圃土壤大丽轮枝菌含量分析Figure 7 Analysis on the content of V.dahliae in the soil of the disease nursery
3 讨论与结论
研究假设土壤里大丽轮枝菌含量存在局部不均匀是造成地面上棉花单株发病程度不同的主要原因,然而在培养箱、温室和病圃中接种等量病原菌时,也会出现单株发病程度不同的现象[4],利用盆栽棉花接种等量大丽轮枝菌分析不同时间点每盆土壤菌量的变化和其棉株发病程度的关系,结果表明随着时间的推移,不同盆之间的大丽轮枝菌含量呈现显著差异,这些差异可能是造成不同盆间棉株发病程度差异的主要原因。与前人[19⁃20]研究得出的大丽轮枝菌在土壤里含量的变化受多种因素的影响,比如多年种植棉花、气候和耕作处理等结果一致。因此,研究结果证明土壤中病原菌含量是不断变化的,甚至不同棉株下的局部土壤菌量也是变化的,这可能是影响其上棉株发病程度不同的主要原因。研究利用枯草芽孢杆菌抑制大丽轮枝菌生长作为实验的正对照,枯草芽孢杆菌能够抑制土壤大丽轮枝菌的生长,其机制目前还不清楚[21⁃22]。研究结果显示枯草芽孢杆菌降低土壤中大丽轮枝菌的含量,减轻了棉花黄萎病的发病程度,也说明了棉花植株的发病程度与土壤里的病原菌含量呈相关性。同时研究也利用多年发病严重的病圃地土壤为负对照研究菌含量与发病程度的关系,结果发现病圃地土壤含有高的病原菌含量,这与其他报道[23⁃24]结果一致。也再次说明土壤里大丽轮枝菌的含量是影响棉花单株发病程度的一个重要因素。
