GAL/GALR2促进涎腺腺样囊性癌细胞神经侵袭的研究
2021-04-27王珺李欢杨子桧完颜超杰张峰瑞杨新杰魏建华雷德林
王珺 李欢 杨子桧 完颜超杰 张峰瑞 杨新杰 魏建华 雷德林
涎腺腺样囊性癌(salivary adenoid cystic carcinoma, SACC)具有嗜神经侵袭(perineural invasion,PNI)的特性[1],其病理表现为肿瘤细胞沿神经浸润生长[2],患者会出现麻木、面瘫等临床症状,导致治疗难度增大,预后一般较差。PNI的发生涉及多因素的参与[3],SACC的PNI机制目前仍不明确,是国内外众多学者关注的热点之一[4-5]。
目前,微环境理论学说被广泛认可,认为肿瘤与神经之间存在某些因子相互介导,从而促进PNI的发生[6]。甘丙肽(Galanin,GAL)作为一种神经肽,与其受体甘丙肽2型受体(GALR2)在中枢和外周神经系统内广泛分布[7],在多种肿瘤进展中发挥重要作用[8]。既往文献报道,GAL与肿瘤不良预后相关[9]。目前GAL及其受体在SACC嗜神经侵袭过程中发挥的作用尚未明确,本研究基于SACC细胞与小鼠背根神经节(DRG)共培养模型及体外神经侵袭模型,通过qRT-PCR、Western Blot、划痕、迁移侵袭、CCK-8及流式细胞术等实验方法,分析GAL/GALR2在SACC神经侵袭中的作用,为阐明SACC的PNI机制提供参考。
1 材料与方法
1.1 主要试剂及材料
RNA提取试剂盒、qRT-PCR试剂盒(Takara,日本); BCA蛋白浓度测定试剂盒(西安晶彩生物科技有限公司); RPMI-1640培养基(Hyclone,美国); 胎牛血清(Gibco,美国); GAL细胞因子、GALR2拮抗剂M871(Tocris Biosciences,英国); 凋亡试剂盒(北京四正柏生物科技有限公司); Transwell小室(共培养实验0.4 μm,迁移侵袭实验8.0 μm, Corning,美国)。
1.2 细胞
涎腺腺样囊性癌细胞系SACC-83(北京大学口腔医学院)培养于含10%胎牛血清和1%双抗的RPMI-1640培养基中,置37 ℃,5% CO2培养箱(Thermo Scientific,美国)。
1.3 方法
1.3.1 DRG的提取、培养 DRG取自新生BALB/c雄性小鼠脊柱内,取出后置于基质胶中,1640培养基培养48 h,之后更换含0.1% BSA的1640培养基。
1.3.2 qRT-PCR 提取共培养后SACC-83细胞总RNA,并测量各组样本RNA的浓度和纯度(EpochTM超微量微孔板分光光度计)。GALR2和β-actin引物由上海生工生物工程股份有限公司定制合成(表1)。

表1 qRT-PCR所用引物序列
1.3.3 Western Blot 使用含1% PMSF的RIPA裂解液提取各组培养皿中的蛋白,BCA蛋白质定量试剂盒进行蛋白定量。常规电泳转膜后封闭,加入GALR2抗体(1 ∶1 000,GeneTex,美国), GAPDH抗体(1 ∶10 000,GeneTex),置4 ℃冰箱孵育过夜。隔日1×TBST洗膜,二抗(1 ∶10 000,西安晶彩生物科技有限公司)室温孵育1 h,洗膜,敷ECL发光液(晶彩生物公司),使用ChemiDocTMXRS+Image LabTMSoftware(BIO-RAD,美国)检测蛋白条带的灰度值。以目的蛋白灰度值与内参灰度值的比值作为目的蛋白表达的相对水平。
1.3.4 CCK-8实验 SACC-83细胞接种于96 孔板中,待细胞贴壁后分别加入0、5、10、50、100 ng/mL的GAL细胞因子进行干预。分别以0、12、36 h作为节点,吸去原培养液,重新加入90 μL新培养液和10 μL的CCK-8溶液,培养箱孵育2 h,用酶标仪测定在450 nm处的吸光度。
1.3.5 凋亡实验 采用AnnexinV/FITC和PI双染法染色,使用全数字化流式细胞仪(FC500 MCL,贝克曼,美国)检测。将培养后的细胞用不含EDTA的胰酶消化后收集于15 mL离心管中,1 000 r/min离心5 min,小心吸除上清,之后用4 ℃预冷的PBS洗涤重悬,离心去上清。用1×结合缓冲液重悬细胞,调整其细胞密度为1~5×106/mL,取100 μL细胞悬液,加入5 μL Annexin V/FITC混匀后于室温避光孵育5 min,之后加入10 μL PI,并加400 μL PBS,立刻进行流式检测。
1.3.6 划痕实验 SACC-83细胞接种于Transwell下室,上室使用DRG条件培养基,分设SACC-83单独培养组、加入GAL细胞因子的单独培养组、SACC-83与DRG共培养组及加入GALR2抑制剂M871的共培养组。依照划痕实验步骤进行,24 h 后倒置相差显微镜下拍照,测量各组肿瘤细胞的移动距离。
1.3.7 迁移实验 SACC-83细胞(5×104/cm2)和DRG分别接种于Transwell上下室中,模拟肿瘤-神经相互作用。共培养24 h后,4%多聚甲醛固定,1%结晶紫溶液染色,将没有迁移的细胞擦除,双蒸水轻轻漂洗残留染液。倒置相差显微镜下随机选取5 个独立视野,计数各实验组中穿过Transwell膜的细胞数量。
1.3.8 侵袭实验 SACC-83细胞(5×104/cm2)和DRG分别接种于含Matrigel稀释液的Transwell上下室中,模拟肿瘤神经相互作用。其余步骤同迁移实验。
1.3.9 体外SACC细胞神经侵袭模型 体外分离培养DRG,之后将活细胞示踪剂CMFDA(10 μmol/L,上海翊圣生物科技公司)处理过的SACC-83细胞与DRG共培养,24 h后显微镜下观察细胞侵袭面积。
1.4 统计学方法
各实验均重复3 次,采用Graphpad Prism8对实验结果进行统计学分析,采用两独立样本t检验进行差异显著性分析。 以P<0.05为差异具有统计学意义。
2 结 果
2.1 DRG提取、培养
体外培养新生BALB/c小鼠DRG生长状况观察,体外培养24 h可见神经突起伸出,48 h后可见有神经突起伸展至基质胶最大周径的1/3(图1)。
2.2 神经-肿瘤共培养
qRT-PCR、Western Blot结果显示(图2):与单独培养组相比,同DRG共培养的SACC-83细胞中,GALR2表达量显著上调(P<0.05)。
2.3 GAL/GALR2对肿瘤细胞增殖、凋亡的影响
增殖实验显示(图3),加入GAL细胞因子后,SACC-83细胞增殖能力在12 h时达到高峰,最适生长浓度为10 ng/mL。 50 ng/mL组和100 ng/mL组起始作用率低于单独培养的SACC-83细胞,提示浓度过高可能对细胞产生增殖抑制,36 h后各组基本持平。流式细胞术检测SACC-83细胞凋亡率显示,共培养后肿瘤细胞凋亡率显著降低;在共培养组中加入GALR2抑制剂M871后,凋亡率升高(P<0.05)。

图1 DRG形态

图2 SACC-83细胞与DRG共培养前后GALR2的表达
2.3 GAL/GALR2对肿瘤细胞迁移侵袭能力的影响
划痕、Transwell迁移侵袭实验结果表明(图4),共培养组及添加GAL细胞因子的处理组中,SACC-83细胞迁移侵袭能力显著提高(P<0.05),加入受体抑制剂M871后,迁移侵袭能力减弱(P<0.05)。SACC细胞神经侵袭模型发现(图5),共培养组加入M871后,可以抑制SACC细胞神经侵袭能力(P<0.05)。
3 讨 论
SACC嗜神经侵袭特性的发生常导致手术切除范围较难掌握[10],使临床治疗十分棘手。研究表明,神经可通过分泌多种因子参与调控肿瘤细胞与神经之间的互动,促进肿瘤细胞嗜神经侵袭。学者们相继发现了多种参与调控该过程的信号分子[11-14]。然而,SACC的嗜神经侵袭机制仍需深入研究。

A: CCK-8增殖实验; B、C: 凋亡实验
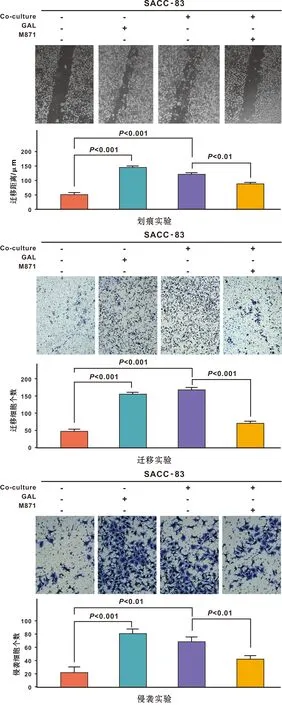
图4 共培养SACC-83细胞的迁移侵袭能力
GAL是一种神经多肽,主要作为大脑和外周神经系统的神经传递的调制器[15],并具有神经营养和神经保护的作用。GAL及其三个G蛋白偶联受体在疾病进展中发挥着不同的作用,相关头颈部鳞癌的研究发现,GAL通过激活GALR2促进肿瘤的增殖、生存[18]和PNI的发生[7]。另有学者发现,在头颈部鳞癌中GALR2蛋白表达水平降低[17-18]。以上研究提示GALR2可能同时拥有促进疾病进展和抑制疾病进展的作用。所以,明确GAL/GALR2在SACC病变进程中发挥的作用对进一步探究该疾病PNI的作用机制具有重要意义。本实验构建了目前被国际广泛认可的神经侵袭模型,利用Transwell小室将SACC-83与DRG进行共培养[19]。通过qRT-PCR及Western Bolt发现,与单独培养组相比,共培养后的SACC细胞中GALR2表达量显著上调(P<0.01),表明该分子参与了肿瘤-神经间的相互作用。CCK-8、流式细胞术结果表明,GAL上调可以促进肿瘤细胞的增殖,而加入其受体抑制剂后能有效减缓PNI进程。Transwell迁移侵袭实验结果表明,共培养组以及GAL处理组的侵袭能力较单独培养组显著提高,而受体抑制剂可使 SACC-83迁移、侵袭能力显著降低,说明GAL可通过激活其受体GALR2来促进SACC的PNI进程。
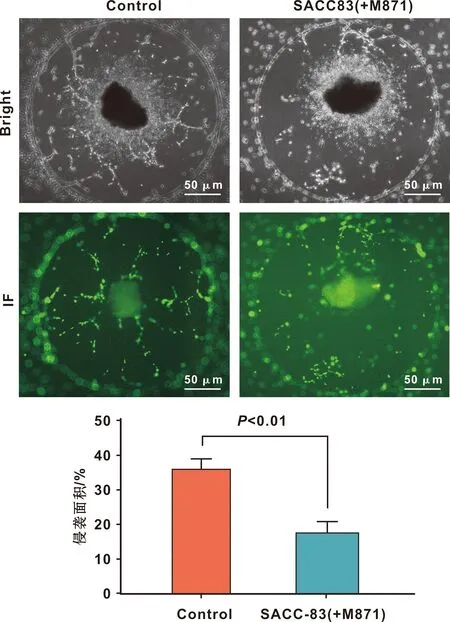
图5 M871对SACC细胞PNI能力的影响
此外,本实验利用PNI体外模型进一步验证了GALR2在PNI过程中的作用。该模型可直观、实时、动态观察肿瘤-神经相互作用,已被广泛应用于前列腺癌、胰腺癌、头颈部鳞癌等多种恶性肿瘤神经侵袭研究中[8,19],是探讨肿瘤细胞神经侵袭机制的可靠模型[20]。结果表明,通过阻断GALR2表达,可以有效抑制SACC细胞PNI的发生。
本研究初步明确了神经来源GAL可以作用于SACC肿瘤细胞,使其受体GALR2高表达,促进SACC侵袭迁移能力,促进PNI进程。该发现为明确PNI发展机制提供了新思路,也为SACC的临床治疗提供了潜在新靶点。但是,GAL在神经及SACC中均有表达[21],它是否在PNI的发生过程中,对神经和肿瘤有双向介导作用,及其更深入的分子机制仍有待探究。
