浅谈血管内亚低温治疗仪技术的研究进展
2021-04-26张晓康
张晓康
(广东省医疗器械质量监督检验所,广东 广州 510663)
亚低温技术已经历了70 多年的发展历史,国内外大量的研究证实了适当的低温及方法的脑保护临床作用。目前,医学界将低温分为轻、中、深度低温,分别为33 ~35℃、28 ~32℃及16℃以下。1993 年我国学者把轻、中度低温定为亚低温,随即此概念被世界同行所广泛引用。亚低温技术在20 世纪50 ~60 年代逐步发展并成熟起来,在80 ~90 年代,取得举世瞩目的成果来自亚低温治疗重型颅脑损伤的实验研究。在80 年代中期,开始有大量关于亚低温与脑缺血的实验研究。现已证实,28 ~33℃的亚低温具有确切的神经保护作用。临床应用结果还发现,亚低温治疗不产生任何严重并发症,从而表明,亚低温治疗重型颅脑损伤患者具有安全方便和疗效肯定等优点。因此,治疗重型颅脑损伤和脑缺血患者的有效措施是亚低温治疗法。
亚低温经历了外敷冰袋、冰帽、冰毯,到低温治疗机、血管内低温灌注、低温体外循环的发展历程,这些方法虽能降低人体温度,但由于人体差异、温度、时间、复温、不良反应等诸多原因而得不到广泛有效应用。此次的研究,经过十几年临床与基础研究,总结了亚低温的方法和经验,研究得出,利用低温介质通过球囊导管在血管内(中心静脉)与血液进行热交换,使患者体温降到理想的目标温度,从而实现了脑保护的目的。
1 作用机理
1.1 低温可抑制代谢率
低温可抑制脑组织的氧代谢率,保存高能磷酸化合物,抑制乳酸蓄积,维持细胞内外的pH 值。
1.2 低温可抑制自由基产生,促进自由基清除
低温可抑制兴奋性氨基酸(EAA)和儿茶酚胺介导的氧化应激、实验研究发现,低温缺血可明显抑制EAA 的释放并且使脑缺血时儿茶酚胺的释放减少60%,减少自由基的产生。
1.3 低温可抑制兴奋性氨基酸(EAA)生物合成、释放和重摄取
低温可维持质膜结构的完整性,降低细胞质Na+和细胞外K+浓度的升高,降低对谷氨酸的重摄取。研究发现,低温可以降低缺血后脑组织中的谷氨酸和甘氨酸浓度。
1.4 低温可以改变缺血后多种酶的活性
研究发现,低温可影响磷脂酶A2、钙调素依赖性蛋白激酶Ⅱ、蛋白激酶、一氧化氮合成酶等多种酶的活性。脑缺血再灌注期间,磷脂酶A2的激活可使细胞膜溶解,导致神经细胞的完整性破环。低温可促进Na+、K+、Ca+、ATP 酶活性的恢复,减少细胞内Ca+超载,进而抑制磷脂酶A2的激活。低温还可保护蛋白激酶C、钙调素依赖性蛋白激酶Ⅱ的活性,减轻缺血性神经元损伤。
1.5 低温可影响信号传递
核因子为一种转录因子,在脑缺血后激活,激活可致多种炎性基因的表达。有人曾对大鼠在过性大脑中动脉闭塞后核因子表达的影响作了研究,在缺血2h 即可见核因子在细胞质表达、核内移位、结合活性,并持续24h。低温可使核因子移位和结合活性减弱,但并不影响核因子的总体表达。低温对炎症的抑制有2 种途径:低温可使炎细胞核因子活性减弱,导致炎症的直接抑制。低温保护的其他细胞如神经元可因炎性信号传递蛋白生成的减少而影响幸存的神经元,间接减少炎性细胞的继发性刺激。
1.6 低温可激活抗炎性机制
近期2 项研究证实,低温可使心脏骤停复苏后昏迷患者存活率升高,明显改善神经功能预后。低温的作用机制涉及细胞保护途径的激活。例如,低温可诱导热休克蛋白70 的表达,导致心肺分流时炎性级联反应变换,减少促炎性介质,增加抗炎性细胞因子白介素10 的水平。
2 产品结构与技术原理
血管内亚低温治疗仪由主机温度控制系统(如图1)、一次性导管连接套件(如图2)、一次性中心静脉球囊导管(如图3)组成。

图1 主机温度控制系统

图2 一次性导管连接套件
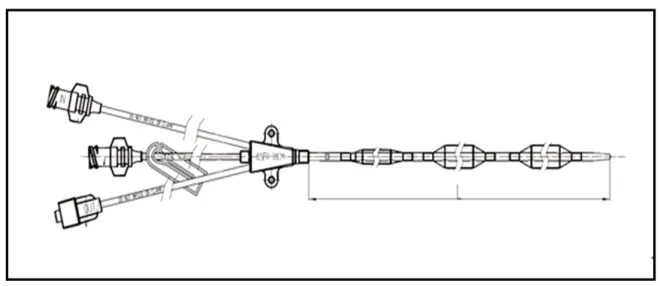
图3 一次性中心静脉球囊导管
产品结构(见图4)和工作方式(见图5):

图4 产品结构
系统工作方式示意图(见图5):

图5 工作方式
中心静脉球囊导管经患者股静脉穿刺(见图6),置于下腔中心静脉位置。一次性无菌套件用于连接热交换系统主机和一次性中心静脉球囊导管,形成封闭的循环系统,生理盐水(见图7)作为传热介质,经蠕动泵推注,在闭环系统中,在计算机控制下,生理盐水通过一次性无菌中心静脉球囊导管的球囊与患者血管内血液形成热交换,从而将人体温度平衡至亚低温区域,从而达到亚低温治疗效果。
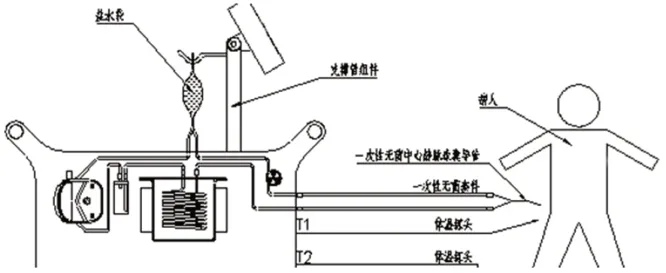
图6 治疗过程示意图
3 产品的临床应用
3.1 心跳骤停后的脑复苏
因各种原因导致的心跳骤停在临床上并不少见,多数患者将会死亡,部分存活者通常遗留严重的永久性神经功能缺损。心脏复苏成功后的脑保护治疗对患者的预后至关重要,其中重要的一项措施就是尽早实施亚低温治疗。

图7 生理盐水流向
3.2 急性卒中
亚低温对急性卒中具有确切的保护作用,以往的临床研究多采用体表降温方法。由于缺血性卒中的脑水肿高峰期在发病后3 ~4h,因此,血管内亚低温技术能够及时实现亚低温治疗,并维持亚低温时间48 ~72h。有研究发现,采用血管内降温方法使其核心温度降至33℃,持续12 ~24h 后复温至36.5℃,复温过程历时12h,采用哌替啶+丁螺环酮+皮肤保温减少寒战。有临床数据表明,所有患者均能耐受血管内降温的不良反应和不适感,延长亚低温持续时间至12~24h,并未出现明显不良反应。因此,认为血管内降温联合应用抗寒战治疗对清醒的急性卒中患者是安全可行的。
3.3 急性心肌梗死
体温是影响急性心肌梗死(acutemyocardialin farction,AMI)患者心肌坏死体积的重要因素,而降低心肌温度可缩小梗死体积,即使是在冠状动脉闭塞后再开始降温也同样有效。研究发现,血管内降温(34℃)可明显降低心肌温度和缩小梗死体积,低温虽可造成心率减慢和收缩压下降,但在复温后均能恢复正常。42 例发病1h 内的AMI 患者随机分为血管内降温组和对照组(每组21 例),血管内降温的目标温度为33℃,维持时间为3h,采用体表保温、口服丁螺环酮和静滴哌替啶以减少寒战,在发病后30h 时测定梗死体积。结果发现,20 例患者成功实施了血管内降温(占95%),全部达到目标温度(33.2±0.9)℃,再灌注期间的平均体温为(34.7±0.9)℃,患者均能耐受低温,无血流动力学障碍,心律失常发生率也未增高。低温治疗组无一例患者出现严重心脏事件,而对照组有2 例,低温治疗组梗死体积有缩小的趋势。因此,学者认为:血管内降温是AMI 患者在冠状动脉支架手术中的一项安全可行的辅助手段。
4 结语
综上,本技术可用于神经内科、外科、重症监护、急诊科、烧伤科、麻醉科、心脏科、器官移植等,在多个临床领域发挥其积极作用,且操作简单、功能齐全;临床中亚低温治疗可以用于神经外科脑损伤的中枢保护,在术中术后均可应用;麻醉科在进行低温麻醉中,本技术具有精准控制体温的性能,因此,大大避免了低温麻醉的并发症;在神经内科,用于卒中患者的脑保护。
