HIF-1α基因沉默对缺氧诱导晶状体上皮细胞转分化的影响
2021-04-23孙乙王惠于腾飞朱艳朱玉广
孙乙,王惠,于腾飞,朱艳,朱玉广
1 潍坊医学院,山东潍坊261053;2 潍坊医学院附属医院
后囊膜混浊(PCO)是白内障术后最常见的并发症,严重影响了患者的视觉质量,目前尚无有效的治疗药物[1-3]。研究发现,PCO 主要是由于白内障术后残留的晶状体上皮细胞(HLECs)发生过度增殖、移行并分化而导致的[4]。在正常情况下HLECs位于富氧的晶状体前部,而白内障手术后HLECs 移动到晶状体后部的缺氧微环境中,并开始增殖、转分化过程[5]。E-cadherin 和 α-SMA 是上皮细胞间质转化的标志性蛋白,通过检测E-cadherin 和α-SMA 表达可以评估上皮细胞间质转化的程度[6]。研究证实,在缺氧微环境下,缺氧诱导因子1α(HIF-1α)发挥着重要作用,并参与启动 HLECs 的转分化[7]。2019 年8 月—2020 年 4 月,本研究观察了 HIF-1α 基因沉默对缺氧诱导HLECs 转分化的影响,为明确PCO 发生的分子生物学机制提供依据。
1 材料与方法
1.1 材料 细胞:HLEC-B3 细胞株购于上海复蒙公司。主要试剂:DMEM 培养液、TRIzol 试剂(美国Gibco 公司),胎牛血清(澳大利亚Hyclone 公司),Power SYBR Green PCR Master Mix 试剂盒(美国ABI公司),逆转录试剂盒、Real-time RNA 提取试剂盒(上海生工生物工程有限公司),兔抗人HIF-1α、E-cadherin 单克隆抗体(美国Santa Cruz 公司),兔抗人α-SMA 单克隆抗体(美国CST 公司),FITC 标记羊抗兔二抗、山羊抗兔IgG(上海生工生物工程有限公司),siRNA Control、HIF-1α siRNA 质粒(上海吉玛制药技术有限公司),LipofectamineTM2000 转染试剂(美国Invitrogen 公司)。质粒:HIF-1α siRNA 委托上海吉玛制药技术有限公司设计合成,HIF-1α siRNA的有效序列为5′-GUGAUGAAAUUCCGAAUTT-3′,并经过mRNA 有效性检测,阴性siRNA 不会引起基因序列变化。
1.2 HLEC-B3 培养及传代 快速解冻液氮保存的HLEC-B3,加入含10%胎牛血清的DMEM 培养液,吹打混匀后培养。3~4 d 更换1 次DMEM 培养液。待HLEC-B3 融合度达90%时,胰酶消化传代。选择传至3代的HLEC-B3进行实验。
1.3 细胞分组与处理 取处于对数生长期的HLEC-B3,随机分为常氧对照组、缺氧对照组、阴性siRNA缺氧组和HIF-1α siRNA缺氧组,胰酶消化,培养24 h后去培养液。缺氧对照组、阴性siRNA缺氧组和HIF-1α siRNA缺氧组加入终浓度为100µmol/L的CoCl2溶液,37 ℃、5%CO2饱和湿度培养箱内进行缺氧培养24 h。阴性siRNA缺氧组和HIF-1α siRNA缺氧组缺氧处理24 h,采用脂质体LipofectamineTM2000转染试剂转染阴性siRNA 和HIF-1α siRNA,转染24 h后进行后续检测。
1.4 细胞HIF-1α、E-cadherin 及α-SMA mRNA 表达检测 采用实时荧光定量PCR 法。取各组细胞,采用TRIzol 试剂提取总RNA,逆转录为cDNA,以cDNA 为模板进行PCR 反应。PCR 引物序列由上海生工生物工程有限公司设计合成,见表1。PCR 反应条件:95 ℃预变性30 s;94 ℃变性5 s,58 ℃退火30 s,74 ℃延伸30 s,共39 个循环;最后58 ℃作用30 s。采用 2-ΔΔCt法计算各组细胞 HIF-1α、E-cadherin 及 α-SMA mRNA相对表达量。

表1 HIF-1α、E-cadherin、α-SMA及内参GAPDH引物序列、引物长度
1.5 细胞HIF-1α、E-cadherin及α-SMA蛋白表达 采用Western blotting 法。取各组细胞,胰酶消化,加入RIPA 裂解液充分裂解,蛋白提取试剂盒提取总蛋白,BCA protein assay reagent 检测蛋白浓度。按体积比为4∶1 加入上样缓冲液,水浴变性,进行SDSPAGE电泳。采用湿转法蛋白转PVDF膜,5%脱脂奶粉封闭,分别加入兔抗人HIF-1α、E-cadherin及α-SMA单克隆抗体(稀释比例分别为1∶600、1∶800、1∶500),4 ℃孵育过夜。洗膜后加入二抗,室温孵育2 h。再次PBS-T 洗膜,取 ECL 试剂盒中 A 液 0.5 mL、B 液 0.5 mL,加入PVDF 膜,避光反应15 min,曝光扫描。采用Image-Pro Plus 图像软件分析条带灰度值,以β-actin 为内参,计算HIF-1α、E-cadherin 及α-SMA 蛋白相对表达量。
1.6 统计学方法 采用SPSS17.0 统计软件。计量资料以-x±s表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组细胞HIF-1α、E-cadherin 及α-SMA mRNA表达比较 与常氧对照组比较,缺氧对照组、阴性siRNA 缺氧组HIF-1α mRNA 相对表达量均升高,HIF-1α siRNA缺氧组HIF-1α mRNA相对表达量降低(P均<0.05)。与常氧对照组比较,缺氧对照组、阴性siRNA 缺氧组E-cadherin mRNA 相对表达量均降低、α-SMA mRNA相对表达量均升高(P均<0.05)。与缺氧对照组、阴性siRNA缺氧组比较,HIF-1α siRNA缺氧组E-cadherin mRNA 相对表达量升高、α-SMA mRNA相对表达量降低(P均<0.05)。见表2。

表2 各组细胞HIF-1α、E-cadherin及α-SMA mRNA表达比较(-x± s)
2.2 各组细胞HIF-1α、E-cadherin 及α-SMA 蛋白表达比较 与常氧对照组比较,缺氧对照组、阴性siR⁃NA 缺氧组 HIF-1α 蛋白相对表达量均升高,HIF-1α siRNA 缺氧组 HIF-1α 蛋白相对表达量降低(P均<0.05)。与常氧对照组比较,缺氧对照组、阴性siRNA 缺氧组E-cadherin 蛋白相对表达量均降低、α-SMA 蛋白相对表达量均升高(P均<0.05)。与缺氧对照组、阴性siRNA 缺氧组比较,HIF-1α siRNA缺氧组E-cadherin 蛋白相对表达量升高、α-SMA 蛋白相对表达量降低(P均<0.05)。见表3、图1。

表3 各组细胞HIF-1α、E-cadherin及α-SMA蛋白表达比较(-x± s)
3 讨论
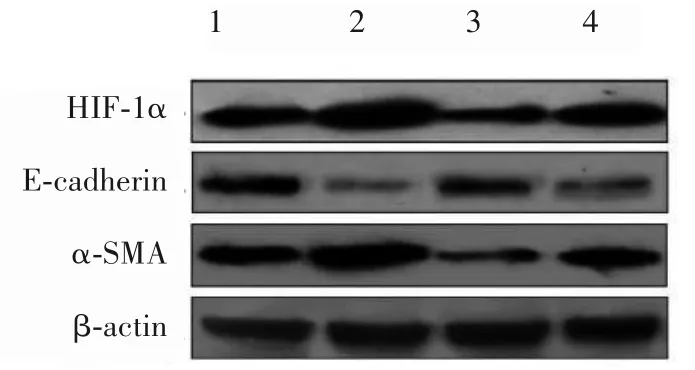
图1 各组细胞HIF-1α、α-SMA、E-cadherin蛋白表达条带图(Western blotting法)
白内障目前是我国发病率最高的致盲性眼病,主要治疗方法是白内障超声乳化联合人工晶体植入术,而对于屈光性白内障手术来说,PCO是高端人工晶体植入术后视觉干扰的主要原因之一[8-11]。在生理状态下,与眼睛中的其他组织相比,晶状体缺乏有氧呼吸[7]。晶状体前部主要从房水中吸收氧气,而晶状体后部的氧气由玻璃体供应[12]。房水中的氧张力比玻璃体中的氧张力高很多,因此晶状体前部处于富氧环境,后部则处于缺氧环境[13-14]。在正常情况下HLECs 位于富氧的晶状体前部,而白内障术后晶状体囊袋内残留的富氧环境中的HLECs 移动到晶状体后部缺氧微环境中,在缺氧、炎症因子等刺激下,HLECs 在数小时内开始增殖、迁移和转分化过程[4,11]。因此,抑制 HLECs 增殖、迁移、转分化是一种预防PCO 的有效方法。本研究对HLECs 进行100 µmol/L CoCl2处理,建立HLECs 缺氧模型,以模拟体内HLECs的缺氧微环境[5,15]。
在缺氧微环境中,术后残存的HLECs 通过多种方式适应缺氧微环境,其中缺氧诱导因子1(HIF-1)发挥着中心介导作用[5,7]。HIF-1 蛋白由 α 和 β 两个亚单位组成,其中HIF-1α 亚单位被认为是特异性氧调节亚单位,决定了HIF-l 的活性。研究发现,活化的HIF-l 可与靶基因上的HIF-l 结合位点结合,形成转录起始复合物,从而启动靶基因转录,使机体适应缺氧环境[16]。因此,本研究以HIF-1α 为靶点进行了HIF-1α 基因沉默实验。本研究结果显示,与常氧对照组比较,缺氧对照组、阴性siRNA 缺氧组HIF-1α mRNA 及蛋白相对表达量均升高,证实缺氧可以诱导 HLECs 的 HIF-1α 表达增加,而 HIF-1α siRNA 缺氧组HIF-1α mRNA 及蛋白相对表达量均低于其他各组,证实成功沉默HIF-1α基因表达。
HLECs 转分化是指上皮细胞的极性改变,失去已分化的上皮细胞表型,出现肌成纤维细胞的表型改变,使HLECs 获得迁移、浸润能力。转分化的特征性改变是介导细胞黏附属性的黏附因子E-cadherin 表达下调或消失,代表肌成纤维细胞的α-SMA 表达增加。白内障术后残存的HLECs 转分化,形成大量细胞外基质,包括纤维蛋白、糖蛋白及各种胶原蛋白纤维沉积于后囊膜上,使后囊膜皱缩,导致PCO 的形成,最终影响患者的视功能[17]。本研究结果显示,与常氧对照组比较,缺氧对照组、阴性siRNA 缺氧组E-cadherin mRNA 及蛋白相对表达量均降低、α-SMA mRNA及蛋白相对表达量均升高,说明缺氧环境会诱导HLECs 转分化;与缺氧对照组、阴 性 siRNA 缺 氧 组 比 较 ,HIF-1α siRNA 缺 氧 组E-cadherin mRNA 相对表达量升高、α-SMA mRNA相对表达量降低,说明沉默HIF-1α 基因表达可以抑制缺氧诱导的HLECs转分化,证实HIF-1α参与了缺氧诱导的HLECs 转分化过程,对于减少PCO 的发生具有重要意义。
综上所述,HIF-1α 基因沉默可以抑制缺氧诱导的HLECs 发生转分化,为白内障术后PCO 的防治提供了新靶点,也为临床了解白内障术后PCO 的发生及发展提供了新思路。
