大黄素联合甲磺酸阿帕替尼通过上调ACE2-Ang(1-7)-Mas受体轴抑制胰腺癌细胞增殖的研究Δ
2021-04-23林海珊曹邦伟
王 婧,马 晓,尚 昆,林海珊,曹邦伟
(首都医科大学附属北京友谊医院肿瘤科,北京 100050)
胰腺癌是恶性度较高的恶性肿瘤之一,2018年全球范围内报告了458 918例胰腺癌新病例,预计至2040年将出现355 317例新病例[1]。尽管在胰腺癌的检测和治疗方面取得了进展,但患者5年生存率仍然只有9%。甲磺酸阿帕替尼是我国独立研发的抑制肿瘤新生血管形成的靶向治疗药物,其不仅具有抑制肿瘤新生血管形成的作用,还有抑制肿瘤细胞增殖的作用[2]。本研究拟通过观察大黄素、甲磺酸阿帕替尼以及上述2种药物联合应用对胰腺癌细胞增殖能力的影响,探讨其作用机制。
1 材料
1.1 细胞株
胰腺癌PANC-1细胞株购自江苏凯基生物技术股份有限公司,于含10%胎牛血清的1640培养基传代培养,当细胞处于对数生长期时开始进行实验。
1.2 药物与试剂
实验所用大黄素购于美国Sigma公司;甲磺酸阿帕替尼购自江苏恒瑞公司;胎牛血清购自ExCell公司;1640培养基购自Hyclone公司。
1.3 仪器
XD-101型CO2培养箱(日本SANYO公司);IX51型生物倒置显微镜(日本OLYMPUS公司);80-2型台式低速离心机(上海医疗器械股份有限公司医疗设备厂);WH-2型振荡器(上海沪西分析仪器厂);UV-2450型紫外光度仪(日本SHIMADZU公司);ELx800型酶标仪(美国BioTek公司)。
2 方法
2.1 分组
本研究共分为对照组、甲磺酸阿帕替尼组、大黄素组及联合用药组(大黄素+甲磺酸阿帕替尼)。实验药物按照特定浓度分别溶于含10%胎牛血清的1640培养基,对照组为不含药物的培养基。
2.2 四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)法检测细胞活力
将胰腺癌PANC-1细胞铺于96孔板内,每孔注入细胞悬液50 μl(约含1×104个细胞),加入1640培养液50 μl。待细胞充分贴壁后进行分组实验。作用72 h后,每孔加入MTT 20 μl,37 ℃孵育4 h后吸出上清液,每孔加入二甲基亚砜 150 μl震荡约10 min,测量波长为490 nm处的吸光度(OD),计算细胞增殖率[3]。
2.3 酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)方法测定白细胞介素6(IL-6)、血管紧张素(1-7)[Ang(1-7)]的表达
分别收集四组细胞的上清液进行检测,选取美国Rapid Bio公司ELISA试剂盒,按照试剂盒使用说明书检测IL-6、Ang(1-7)水平[4]。
2.4 Western blot法检测胰腺癌细胞内血管紧张素转换酶2(ACE2)、Mas受体蛋白表达水平
将细胞接种于6孔板,待细胞贴壁后,按照不同干预组给药处理,置于37 ℃温箱孵育24 h。按照经典Western blot检测方法,提取细胞总蛋白,测定蛋白浓度,每样品上样30 g,进行蛋白电泳,电转移到PVDF膜上,封闭后顺序加ACE2、Mas、GAPDH一抗(1∶1 000)及二抗(1∶5 000),到达反应时间后,检测杂交信号,计算蛋白含量[5]。
2.5 免疫荧光细胞化学法测定ACE2、Mas受体蛋白表达情况
将胰腺癌细胞接种至6孔板中,待其生长融合度达85%时,更换为无血清培养基继续培养24 h,然后进行免疫荧光细胞化学染色,观察ACE2、Mas受体蛋白表达情况,用激光共聚焦显微镜观察并摄取荧光图像[5]。
2.6 统计学方法
数据均采用SPSS 17.0统计软件进行分析,正态分布者通过两独立样本t检验,偏态分布者采用秩和检验;各测定值结果以均数±标准差表示,P<0.05认为有统计学意义。
3 结果
3.1 大黄素、甲磺酸阿帕替尼以及联合用药对PANC-1细胞增殖能力的影响
分别用不同浓度的大黄素(12.5、25、50、100及200 μmol/L)对PANC-1细胞进行处理,检测结果显示,大黄素及甲磺酸阿帕替尼单药刺激PANC-1细胞,其抑制增殖能力均呈现剂量依赖性,见图1。根据半数抑制浓度(IC50),选择大黄素实验浓度为100 μmol/L,甲磺酸阿帕替尼实验浓度为40 μmol/L。加药干预细胞后,大黄素组细胞抑制率为11.72%,甲磺酸阿帕替尼组的抑制率为15.94%,联合用药组的抑制率为28.84%,联合用药组显著高于单药组,差异有统计学意义(P<0.05),见图2。

A.大黄素;B.甲磺酸阿帕替尼A.emodin;B.apatinib mesylate图1 不同浓度大黄素、甲磺酸阿帕替尼对PANC-1细胞的增殖抑制作用Fig 1 Inhibition proliferation effect of emodin combined with apatinib mesylate on PANC-1 cell at different concentrations

图2 不同药物干预对PANC-1细胞的增殖抑制作用Fig 2 Inhibition proliferation effect of different drug interventions on PANC-1 cell
3.2 大黄素、甲磺酸阿帕替尼以及联合用药组细胞上清液中IL-6、Ang(1-7)水平的差异
取各组细胞上清液进行检测IL-6、Ang(1-7)水平,对照组、大黄素组、甲磺酸阿帕替尼组及联合用药组的IL-6水平明显低于对照组,差异均有统计学意义(P<0.01),甲磺酸阿帕替尼组显著低于大黄素组,联合用药组显著低于大黄素组及甲磺酸阿帕替尼组;与IL-6相反,大黄素组、甲磺酸阿帕替尼组及联合用药组的Ang(1-7)水平高于对照组,其中联合用药组最高,与对照组比较,差异有统计学意义(P<0.01),见表1。

表1 四组PANC-1细胞上清液中IL-6、Ang(1-7)水平比较Tab 1 Comparison of levels of IL-6, Ang(1-7) in the cell supernatant of PANC-1 cell among four groups
3.3 Western blot方法检测ACE2、Mas受体蛋白水平
用大黄素、甲磺酸阿帕替尼等药物干预PANC-1细胞后提取细胞蛋白,测定不同组别ACE2、Mas受体蛋白水平。检测结果显示,大黄素组及甲磺酸阿帕替尼组ACE2、Mas受体蛋白表达水平高于对照组,联合用药组表达最高,结果见表2、图3。

表2 四组PANC-1细胞ACE2、Mas受体蛋白水平比较Tab 2 Comparison of levels of ACE2 and Mas receptors protein in the cell supernatant of PANC-1 cell among

C.对照组;A.甲磺酸阿帕替尼组;E.大黄素组;A+E.甲磺酸阿帕替尼+大黄素组C.control group; A.apatinib mesylate group; E.emodin group; A+E.apatinib mesylate+emodin group图3 四组细胞ACE2、Mas受体蛋白表达情况Fig 3 Expression of ACE2 and Mas receptor protein in four groups
3.4 免疫荧光检测ACE2、Mas受体蛋白表达水平
Mas受体阳性表达呈绿色荧光,细胞核呈蓝色荧光;ACE2表达部位在胰腺癌细胞的胞浆中;Mas表达部位在胰腺癌细胞膜。大黄素组及甲磺酸阿帕替尼单药组ACE2及Mas受体表达高于对照组,联合用药组表达明显最高,见图4—5。
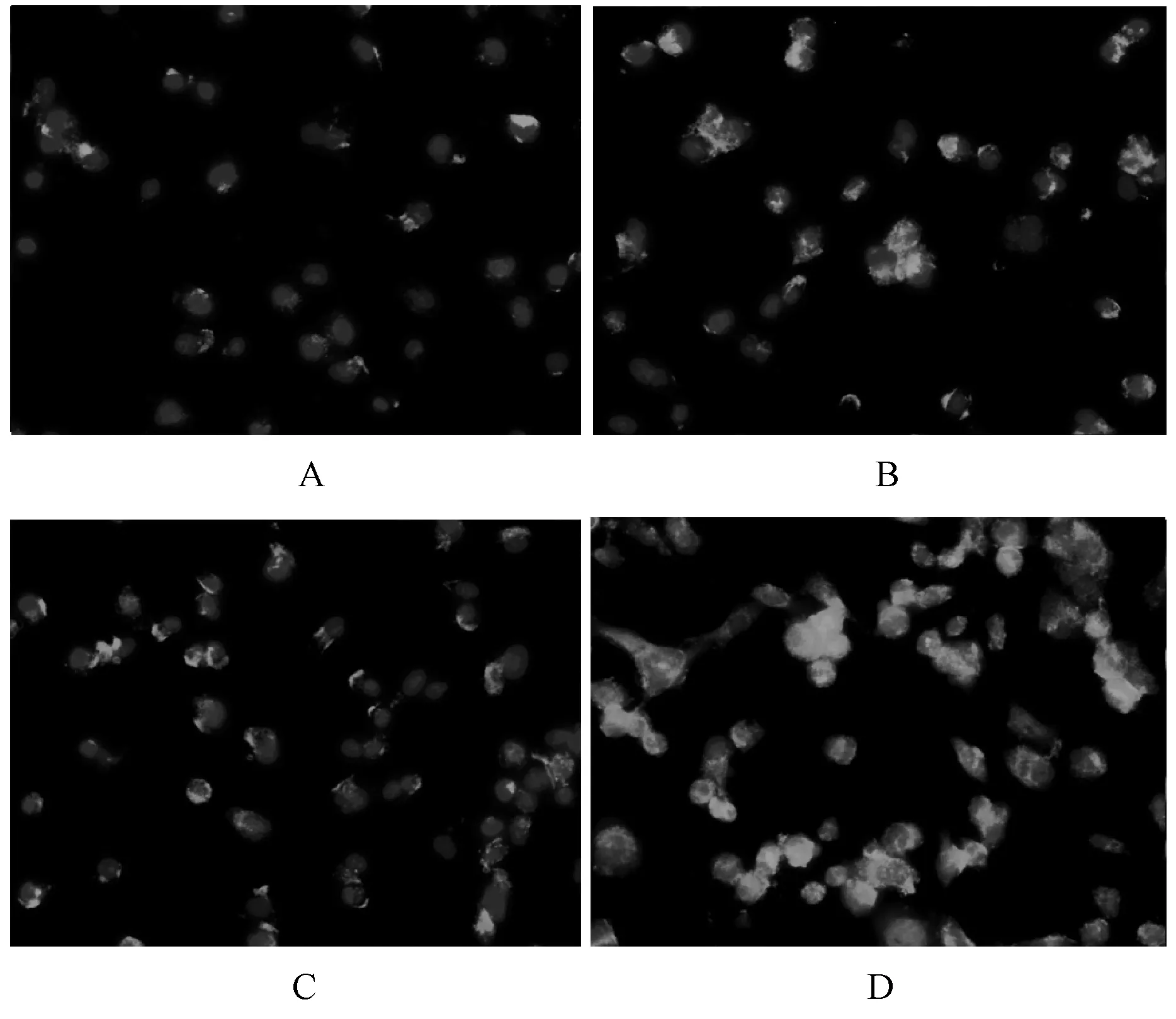
A.对照组;B.甲磺酸阿帕替尼组;C.大黄素组;D.甲磺酸阿帕替尼+大黄素组A.control group; B.apatinib mesylate group; C.emodin group; D.apatinib mesylate+emodin group图4 四组细胞ACE2蛋白表达情况Fig 4 Expression of ACE2 protein in four groups
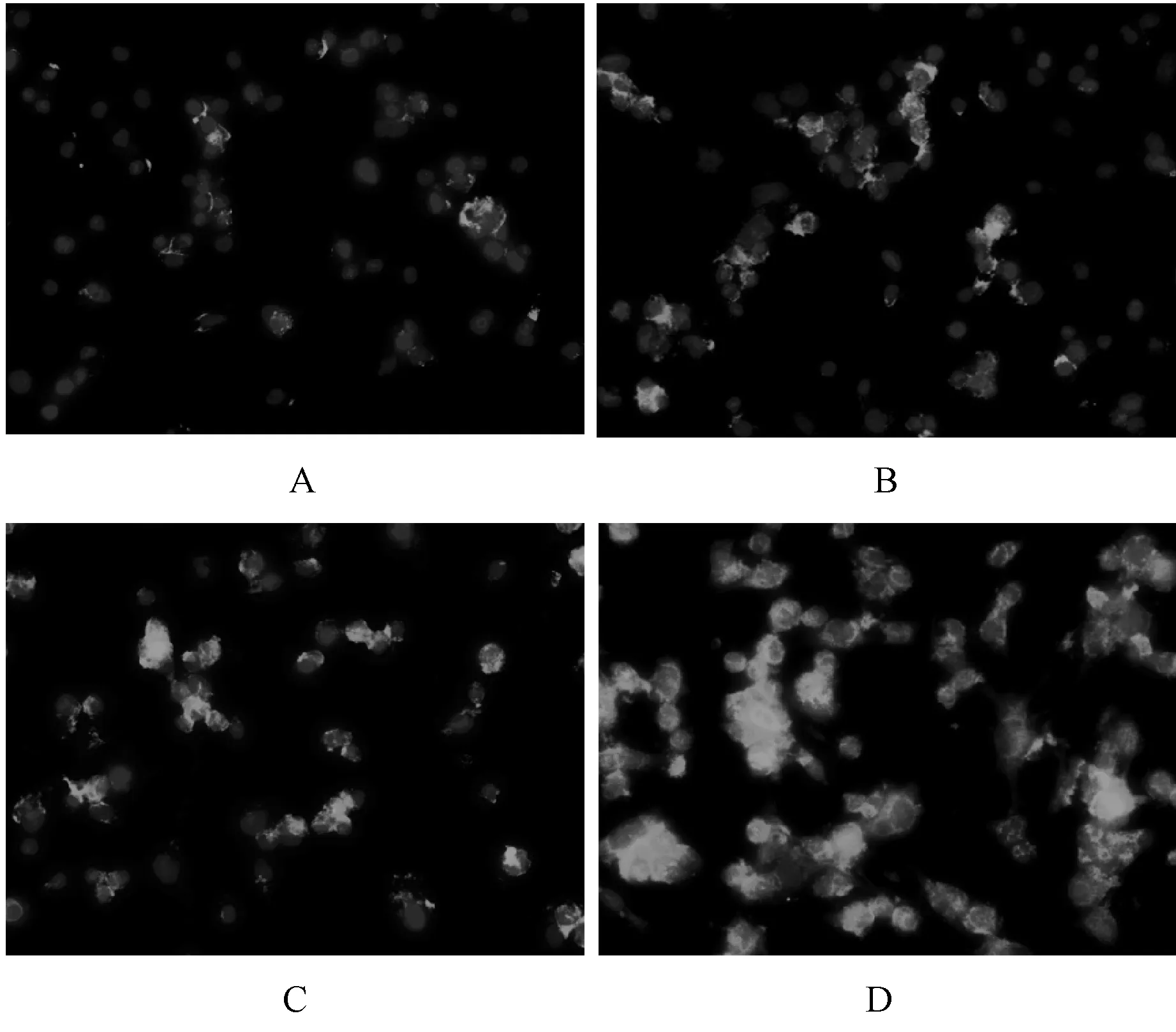
A.对照组;B.甲磺酸阿帕替尼组;C.大黄素组;D.甲磺酸阿帕替尼+大黄素组A.control group; B.apatinib mesylate group; C.emodin group; D.apatinib mesylate+emodin group图5 四组Mas受体蛋白表达情况Fig 5 Expression of Mas receptor protein in four groups
4 讨论
大多数胰腺癌患者就诊时已是晚期,无法进行手术,目前的治疗以化疗为主,靶向治疗尚未有大的突破[6]。诸多研究结果发现,大黄素能够抑制肿瘤细胞的增殖[7]。其机制包括启动线粒体诱导和内质网应激诱导细胞凋亡[8];靶向转录调节因子NCOR2和SerRS抑制血管内皮生长因子A转录和肿瘤血管生成促进肿瘤细胞凋亡[9];通过灭活PI3K/Akt信号通路在体内外逆转耐药[10];可能通过激活RIP1/RIP3轴来诱导肿瘤细胞坏死[11]。因此,大黄素在胰腺癌的治疗中起到重要作用[12]。
甲磺酸阿帕替尼片是我国自主研发的全球首个胃癌靶向药物,其作用机制为高度选择性竞争细胞内血管内皮生长因子受体2的ATP结合位点,进而阻断下游信号转导通路,抑制肿瘤新生血管生成。课题组前期研究结果发现,甲磺酸阿帕替尼本身对肿瘤细胞有一定的抑制能力[2]。已有研究结果证实,多种中药的提取物对胰腺癌细胞可起到抑制其增殖的作用[13-14]。大黄素是传统中药大黄的主要有效成分之一,能够抑制胰腺癌PANC-1细胞增殖,具有促细胞凋亡的作用[15]。本研究观察了大黄素、甲磺酸阿帕替尼单药及二者联合使用对胰腺癌细胞的抑制作用;关于各组IL-6水平的比较,甲磺酸阿帕替尼组明显低于大黄素组,联合用药组明显低于大黄素组及甲磺酸阿帕替尼组。IL-6是核因子κB信号传导通路的下游炎症介质,通过激活转录信号转导子和激活子3,阻断炎症过程中的细胞凋亡,促进肿瘤细胞持续增殖。各用药组IL-6水平的下调有助于抑制肿瘤细胞的增殖。
血管紧张素Ⅰ(Ang Ⅰ)、血管紧张素Ⅱ(Ang Ⅱ)均为血管紧张素转换酶2(ACE2)的作用底物[16]。ACE2的主要生物学作用是水解Ang Ⅱ生成Ang(1-7)[17]。Ang(1-7)通过其特异性受体(为Mas原癌基因编码的G蛋白耦联受体,Mas受体),即ACE2-Ang(1-7)-Mas受体轴,在人体多个系统中发挥舒张血管、抗炎、抗凝以及保护血管内皮等作用[5]。既往研究结果证实了ACE2在胰腺中的表达及其对胰腺的保护作用[17]。ACE2可抑制胰腺癌细胞增殖、血管生成和转移[18]。有研究结果认为,在肿瘤组织中存在ACE2表达下调甚至缺失,且ACE2可抑制肿瘤细胞增殖,可作为一个抑癌基因发挥作用[19]。稳定高表达ACE2基因可抑制获得性铂类耐药的非小细胞肺癌细胞增殖[20]。Ye等[17]亦发现ACE2高水平的肝癌患者的生存期相对更长,而低水平的ACE2可作用预后差的指标之一。本研究结果显示,大黄素和甲磺酸阿帕替尼均可提高ACE2、Mas受体水平,降低Ang(1-7)水平,实现通过上调ACE2-Ang(1-7)-Mas受体轴而发挥抑制胰腺肿瘤的作用。
综上所述,大黄素、甲磺酸阿帕替尼能够通过上调ACE2-Ang(1-7)-Mas受体轴,下调IL-6水平,抑制胰腺癌细胞增殖,两药联合应用的抑制作用更为明显,可起到协同效应,从而为大黄素和甲磺酸阿帕替尼在临床上的应用提供实验基础。
