鱼腥草提取物对慢性阻塞性肺疾病急性加重期大鼠肺功能的影响及对TLR4/NF-κB信号通路的调控作用*
2021-04-20李慧邢学勇王一新杨爽赵丽郭俊华
李慧,邢学勇,王一新,杨爽,赵丽,郭俊华
1.新乡医学院第三附属医院,河南 新乡453000;2.河南大学,河南 开封475000
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种气流受限、伴有气道高反应性的呼吸道疾病,表现为肺功能下降,对患者生存质量造成严重影响[1]。COPD发病过程复杂,易受环境有害气体或颗粒影响而急性发作,气道、肺实质等发生炎症病变,若不及时有效干预则可能造成肺功能持续下降,导致患者呼吸衰竭而死亡[2-3]。寻找有效治疗手段对COPD急性发作期的治疗有重要意义。COPD中医治疗日渐受到关注[4-5]。研究表明,鱼腥草具有多种潜在药用价值,其提取物中含有多种活性成分且均具有显著的抗炎作用,与地塞米松抗炎能力相近[6]。目前,鱼腥草多用于辅助治疗支原体肺炎、支气管哮喘等肺部炎症性疾病[7],但关于其对COPD急性加重期炎症抑制作用及呼吸功能的影响报道较少。本研究观察鱼腥草提取物对COPD急性加重期大鼠模型肺功能的影响,并探讨其抗炎机制,以期指导临床用药。
1 材料
1.1 动物SPF级雄性健康Wistar大鼠50只,6周龄,体质量180~220 g,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2017-0007,饲养于12 h/12 h明暗交替,23~25℃,40%~50%湿度下,所有动物实验操作符合动物伦理学要求。
1.2 药物与试剂鱼腥草(北京同仁堂股份有限公司),100 g鱼腥草加入3倍体积蒸馏水煎煮两次,合并两次煎煮液,蒸发浓缩至100 mL,有效含量为1 000 g·L-1,使用前用蒸馏水稀释至相应浓度。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)ELISA试剂盒(美国 R&D Systems公 司,批 号 分 别 为:ML1421、M6000B、MLB00C);兔抗大鼠Toll样受体4(toll-like receptor 4,TLR4)、核转录因子κB(nuclear factorκB,NF-κB)多抗、山羊抗兔单抗(美国Invitrogen公司,货号分别为:48-2300、46-2725、41-3850);
1.3 仪器AniRes2005型实验用小动物肺功能测定仪(北京贝兰博科技有限公司);QuantStudio 3型实时荧光定量PCR仪(美国ABI公司);CheniDoc XRS型化学发光成像分析仪(美国Bio-rad公司)。
2 方法
2.1 分组与模型建立取50只大鼠,按照体质量排序法随机分为5组:对照组、COPD组、鱼腥草低剂量(1.25 g·kg-1)组、鱼腥草中剂量(2.50 g·kg-1)组、鱼腥草高剂量(5.00 g·kg-1)组,各10只。首先采用烟熏联合气道内滴注内毒素法建立COPD稳定期模型,在此基础上鼻腔内滴菌法建立COPD急性加重期模型[8],具体操作方法为:分别于实验第7、14、28天气管内滴入浓度为1 g·L-1的内毒素0.2 mL,于实验第1~28天(第7、14、28天除外)将大鼠放置于容积为72 L的有机玻璃仓内,注入雄狮牌香烟烟雾,维持烟雾浓度5%(V/V),每次30 min,建立COPD稳定期模型;于第29~32天,鼻腔内滴注浓度为2.4×109CFU·mL-1的金黄色葡萄球菌溶液,每次0.3 mL,每天2次,连续4 d。大鼠表现为呼吸喘促,动则加剧,鼻部潮湿,打喷嚏及体温升高等体征则判定为COPD急性加重期模型建立成功。
2.2 给药方法除对照组外,造模大鼠建立COPD急性加重期模型过程中因气管插管、麻醉等原因分别死亡2、2、1、1只,其余均建模成功,参与后续实验研究。对照组大鼠气逍和鼻腔内每次滴注等体积生理盐水。根据动物与人体间的等效剂量换算[9],计算大鼠给药剂量。所有大鼠每天灌胃1次,连续灌胃4周。
2.3 肺功能指标测定末次灌胃后2 h,各组大鼠用12%的乌拉坦腹腔麻醉,仰卧位固定于实验小动物肺功能测定仪的密闭体积扫描箱内,大鼠颈部备皮,纵向切开皮肤暴露气管,于第3~4气管环中间切倒T型切口,插入气管插管,插管连接三通开关,一端连接动物呼吸机,先描记一段平静呼吸,然后由呼吸机输入4~6倍潮气量模拟用力吸气过程,测定用力肺 活量(forced vital capacity,FVC),再 由25 cm H2O负压系统模拟用力呼气过程,记录由胸廓起伏造成容积变化,通过压力换能器和放大器信号处理系统计算肺功能各项指标,包括用力呼气峰流速(peak expiratory flow rate,PEF)、第0.3秒用力呼气容积(forced expiratory volume at 0.3 second,FEV0.3)/FVC、最大呼气中期流速(maximum middle expiratory flow rate,MMEF)[10]。
2.4 肺泡灌洗液(alveolar lavage fluid,BALF)中炎症因子水平检测肺功能指标测定结束后,处死各组大鼠,于气管切口处插入气管套管,用1 mL磷酸盐缓冲液(phosphate buffered saline,PBS)反复灌洗3次,收集BALF,2 800 r·min-1离心10 min(离心半径为10 cm),取上清液,采用酶联免疫吸附法检测BALF中TNF-α、IL-6、IL-1β水平,按照试剂盒说明书执行操作。
2.5 肺组织病理学观察收集BALF完成后立即打开大鼠胸腔,取部分右肺组织,置于4%中性甲醛中固定48 h,然后经酒精脱水、石蜡包埋,修整后,采用切片机制备厚度为4μm的切片,切片进行常规苏木精-伊红(hematoxylin-eosin,HE)染色,显微镜下观察肺组织病理改变。
2.6 检测肺组织中TLR4 mRNA、NF-κB mRNA表达取新鲜右肺组织70 mg,用组织剪剪碎,按照Trizol法提取肺组织中的总RNA,然后逆转录获得互补链cDNA,以之为模板进行实时荧光定量聚合酶链反应,按照试剂盒设定反应体系,反应条件为95℃,5 min;94℃,30 s,56℃,30 s,72℃,60 s;重复40个循环,72℃延伸5 min。用β-actin基因为内参对照,计算TLR4、NF-κB相对表达强度(2-△△CT)[11]。引物序列:TLR4:F:5′-ACGTGATGCTGTTAACCGT-3′,R:5′-TAGTCGTGAACGTGCGTAC-3′;NF-κB:F:5′-CATCAAGCGTACGTGCGTA-3′,R:5′-CTGATGCGTCTGAGATCTA-3′;β-actin:F:5′-TAACGCCGATGCAATGTCT-3′,R:5′-CATGTGGAACTCTGTGCTC-3′。
2.7 检测肺组织中TLR4、NF-κB蛋白表达取新鲜右肺组织70 mg于EP管中,加入细胞裂解液500μL,置于冰上裂解20 min,4℃、12 000 r·min-1离心15 min(离心半径10 cm),取上清液,BCA蛋白定量后,进行十二烷基硫酸钠聚丙烯酰氨凝胶电泳,电泳后转膜2.5 h,经封闭液封闭,按比例稀释一抗4℃摇床孵育过夜,按比例稀释二抗常温孵育2 h后进行曝光和显影,扫描拍照后,应用BandScan软件进行灰度值分析,相对表达强度用TLR4、NF-κB与内参β-actin灰度值的比值表示。
2.8 统计学方法采用SPSS 19.0统计学软件分析数据,计量资料均用均数±标准差(±s)表示,多样本组间比较采用单因素方差分析,两两样本比较采用SNK-q检验。以P<0.05为差异有统计学意义。
3 结果
3.1 大鼠建模情况及一般体征观察对照组大鼠营养状态、饮食、体温等均正常,实验过程中均未死亡。各造模组大鼠COPD稳定期出现皮毛暗淡、蜷缩少动、呼吸喘促、动则加剧现象,经鼻反复滴注菌液期间上述现象更为严重,逐步出现鼻部潮湿、打喷嚏、体温升高等现象,给药后上述症状得以好转。COPD组、鱼腥草(低、中、高剂量)组模型制备成功分别有8、8、9、9只大鼠,参与后续实验。
3.2 对肺功能指标的影响与对照组比较,COPD组、鱼腥草(低、中、高剂量)组上述肺功能指标均降低(P<0.05);与COPD组比较,鱼腥草(低、中、高剂量)组上述肺功能指标均升高(P<0.05),其中鱼腥草高剂量组高于鱼腥草低、中剂量组(P<0.05),鱼腥草低剂量组与鱼腥草中剂量组比较,差异无统计学意义(P>0.05)。见表1。
3.3 对BALF中TNF-α、IL-6、IL-1β水平的影响与对照组比较,COPD组、鱼腥草(低、中、高剂量)组大鼠BALF中TNF-α、IL-6、IL-1β水平均升高(P<0.05);与COPD组比较,鱼腥草(低、中、高剂量)组上述上述炎症因子水平均降低(P<0.05),其中鱼腥草高剂量组低于鱼腥草低、中剂量组,鱼腥草中剂量组低于低剂量组(P<0.05)。见 表2。
表1 肺功能指标比较 (±s)
注:与对照组比较,a P<0.05;与COPD组比较,b P<0.05;与鱼腥草低剂量组比较,c P<0.05;与鱼腥草中剂量组比较,d P<0.05
组别n FVC(V/mL)PEF/mL·s-1 FEV0.3/FVC/%MMEF/mL·s-1.05±2.01 COPD组8 5.50±0.53a 29.82±3.02a 67.23±4.02a 16.64±1.12a鱼腥草低剂量组8 6.08±0.51ab 36.30±4.37ab 73.65±4.19ab 18.32±1.43ab鱼腥草中剂量组9 6.29±0.54ab 39.14±5.24ab 74.09±4.25ab 19.15±2.54ab鱼腥草高剂量组9 7.18±0.59abcd 50.36±3.94abcd 78.11±5.07abcd 22.30±2.62abcd F值20.238 62.955 10.949 15.261 P值对照组10 7.71±0.72 57.61±4.45 80.45±5.24 23<0.001<0.001<0.001<0.001
表2 BALF中TNF-α、IL-6、IL-1β水平的影响 (±s,ng·L-1)
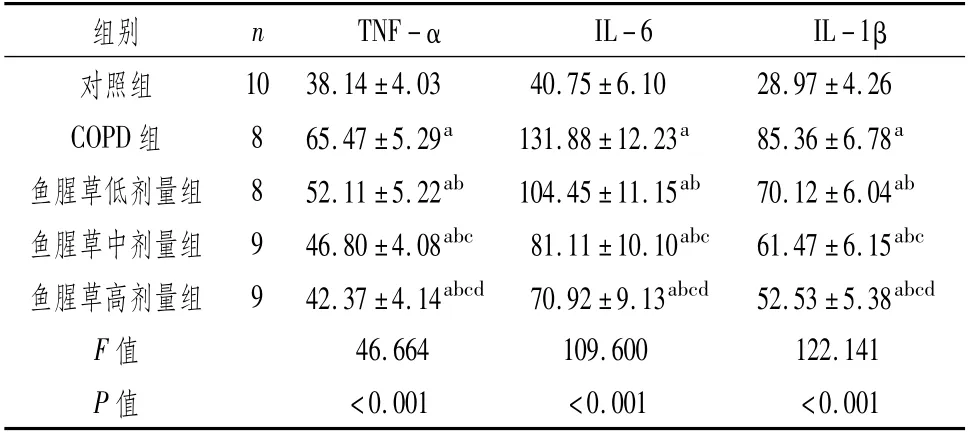
表2 BALF中TNF-α、IL-6、IL-1β水平的影响 (±s,ng·L-1)
注:与对照组比较,a P<0.05;与COPD组比较,b P<0.05;与鱼腥草低剂量组比较,c P<0.05;与鱼腥草中剂量组比较,d P<0.05
组别n TNF-αIL-6 IL-1 β 10 38.14±4.03 40.75±6.10 28.97±4.26 COPD组8 65.47±5.29a 131.88±12.23a 85.36±6.78a鱼腥草低剂量组8 52.11±5.22ab 104.45±11.15ab 70.12±6.04ab鱼腥草中剂量组9 46.80±4.08abc 81.11±10.10abc 61.47±6.15abc鱼腥草高剂量组9 42.37±4.14abcd 70.92±9.13abcd 52.53±5.38abcd对照组F值46.664 109.600 122.141 P值<0.001<0.001<0.001
3.4 肺组织病理观察HE染色结果显示,对照组大鼠支气管、支气管黏膜、肺泡等结构基本正常;模型组大量肺泡壁断裂融合为气腔、肺泡间质大量炎性细胞浸润,支气管黏膜上皮可见大量杯状细胞增生,支气管管腔狭窄,气道内大量炎性细胞浸润,肺小动脉管壁增厚,周围炎性细胞浸润;鱼腥草各剂量组大鼠上述病理改变较模型组均有所减轻,肺泡融合范围减小,肺间质、气道及肺小动脉周围炎性细胞浸润程度减轻,其中鱼腥草高剂量组改善最明显,但仍存在少量炎症细胞浸润。见图1。
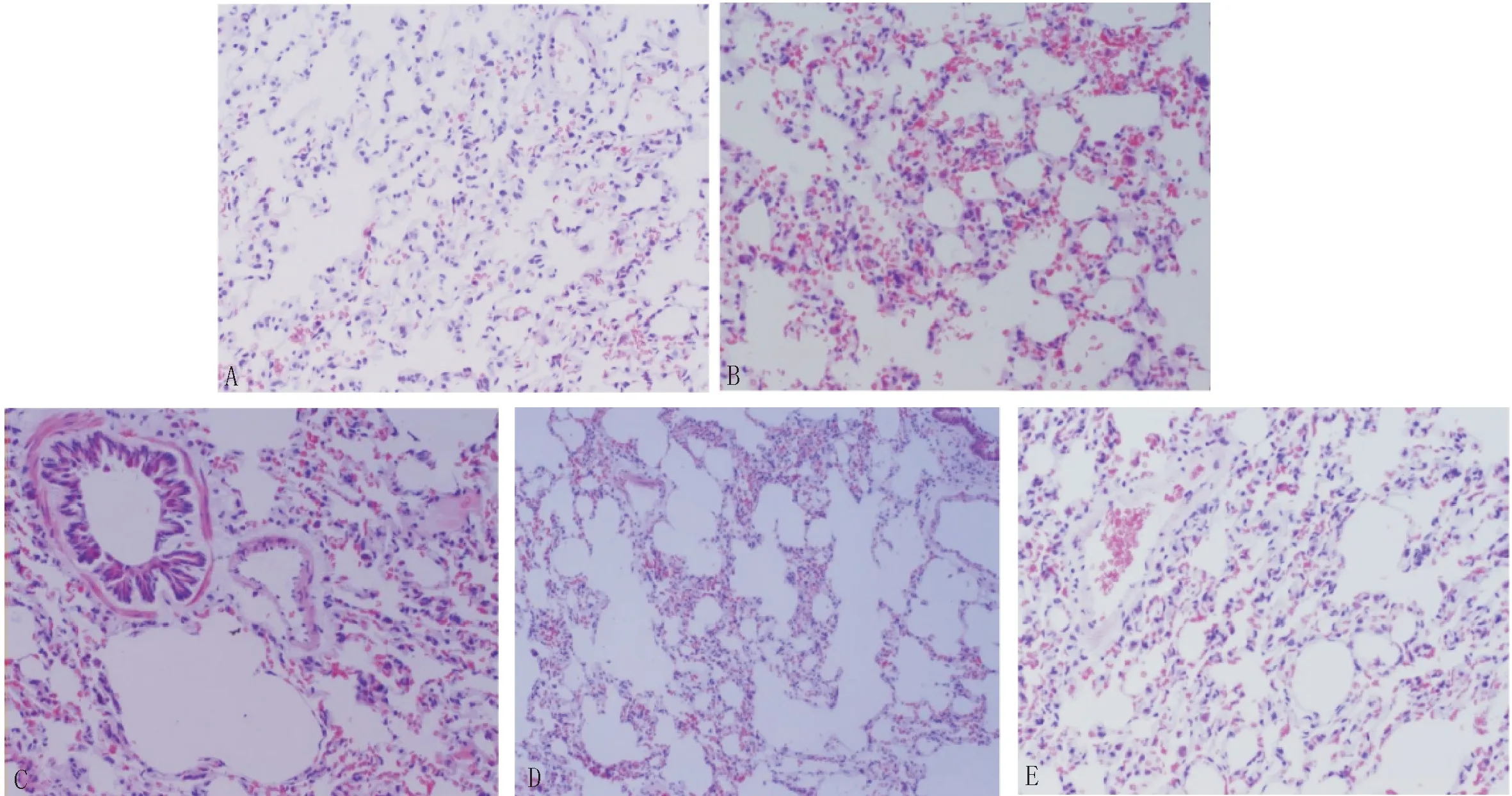
图1 肺组织病理切片(HE染色,×200)
3.5 对肺组织中TLR4 mRNA、NF-κB mRNA表达的影响与对照组比较,COPD组、鱼腥草(低、中、高剂量)组肺组织中TLR4 mRNA、NF-κB mRNA相对表达量均明显升高(P<0.05);与COPD组比较,鱼腥草(低、中、高剂量)组肺组织中TLR4 mRNA、NF-κB mRNA相对表达量均降低(P<0.05),其中鱼腥草高剂量组低于鱼腥草低中剂量组,鱼腥草中剂量组低于鱼腥草低剂量组(P<0.05)。见表3。
3.6 对肺组织中TLR4、NF-κB蛋白表达的影响与对照组比较,COPD组、鱼腥草(低、中、高剂量)组肺组织中TLR4、NF-κB蛋白相对表达量均升高(P<0.05);与COPD组比较,鱼腥草(低、中、高剂量)组肺组织中TLR4、NF-κB蛋白相对表达量均降低(P<0.05),其中鱼腥草高剂量组低于鱼腥草低、中剂量组,鱼腥草中剂量组低于鱼腥草低剂量组(P<0.05)。见表4,图2。
表3 对肺组织中TLR4 mRNA、NF-κB mRNA表达的影响 (±s)
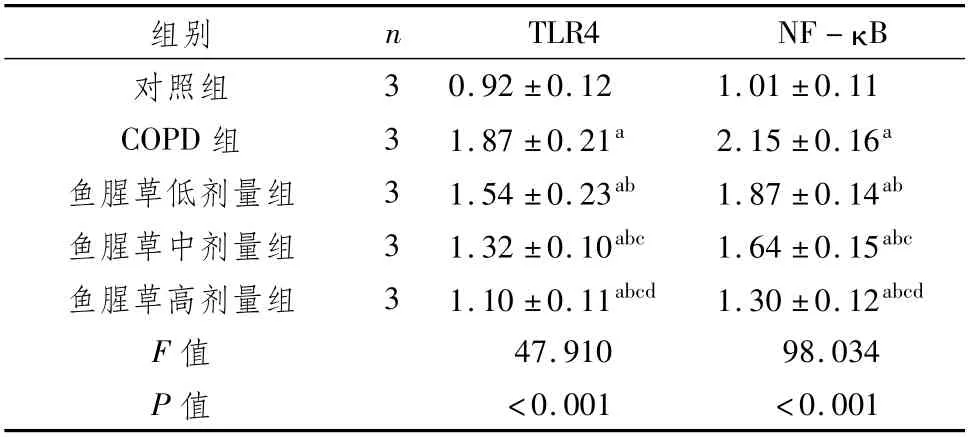
表3 对肺组织中TLR4 mRNA、NF-κB mRNA表达的影响 (±s)
注:与对照组比较,a P<0.05;与COPD组比较,b P<0.05;与鱼腥草低剂量组比较,c P<0.05;与鱼腥草中剂量组比较,d P<0.05
组别n TLR4 NF-κ B对照组3 0.92±0.12 1.01±0.11 COPD组3 1.87±0.21a 2.15±0.16a鱼腥草低剂量组3 1.54±0.23ab 1.87±0.14ab鱼腥草中剂量组3 1.32±0.10abc 1.64±0.15abc鱼腥草高剂量组3 1.10±0.11abcd 1.30±0.12abcd F值47.910 98.034 P值<0.001<0.001
表4 对肺组织中TLR4、NF-κB蛋白表达的影响 (±s)
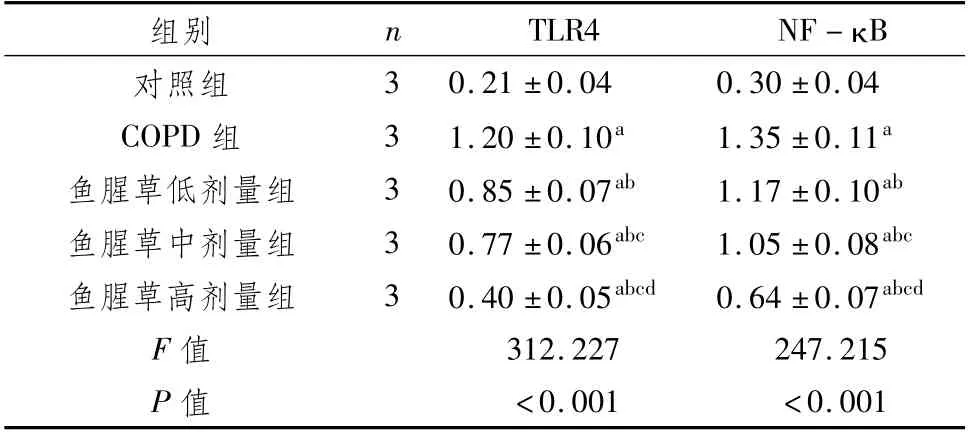
表4 对肺组织中TLR4、NF-κB蛋白表达的影响 (±s)
注:与对照组比较,a P<0.05;与COPD组比较,b P<0.05;与鱼腥草低剂量组比较,c P<0.05;与鱼腥草中剂量组比较,d P<0.05
组别n TLR4 NF-κ B对照组3 0.21±0.04 0.30±0.04 COPD组3 1.20±0.10a 1.35±0.11a鱼腥草低剂量组3 0.85±0.07ab 1.17±0.10ab鱼腥草中剂量组3 0.77±0.06abc 1.05±0.08abc鱼腥草高剂量组3 0.40±0.05abcd 0.64±0.07abcd F值312.227 247.215 P值<0.001<0.001
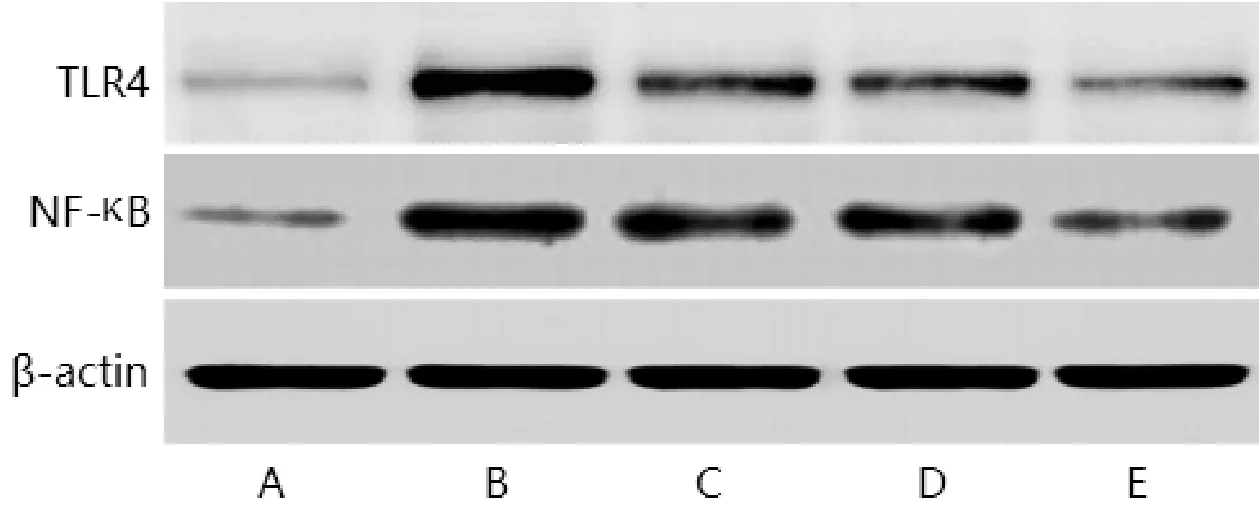
图2 肺组织中TLR4、NF-κB的蛋白表达
4 讨论
COPD病程复杂,发病率和死亡率逐年升高,目前已位列世界疾病经济负担第5位,且已成为全球性主要致死病因,亟须寻求有效治疗手段改善疾病预后[12-14]。多种因素均可导致COPD患者气道、肺实质炎症反应进行性加重,抑制肺呼吸功能[15-17]。吸烟、感染是导致COPD发作及加重的主要因素,烟熏联合气道内滴注内毒素法建立COPD大鼠模型已获得广泛认可[18-19]。本研究在该方法基础上经鼻滴入金黄色葡萄球菌以获得COPD急性加重期大鼠模型,大鼠一般体征观察及肺组织病理改变与临床表现一致[20],可用于实验研究。
肺功能检查是COPD诊疗、预后评价的首要指标,反应肺组织损伤程度。本研究发现,不同浓度鱼腥草干预后,大鼠FVC、PEF、FEV0.3/FVC、MMEF均较COPD组升高,且高剂量组最高,说明鱼腥草提取物可有效改善COPD急性加重期大鼠肺功能;干预后BALF中TNF-α、IL-6、IL-1β水平均降低,且呈剂量依赖性;病理观察显示肺泡融合范围减小,肺间质、气道及肺小动脉周围炎性细胞浸润程度减轻,说明鱼腥草提取物可有效减轻COPD急性加重期大鼠肺病理损伤。药理学研究表明,鱼腥草水煎液具体显著的体外抑菌作用,可能通过抑制细菌生物被膜发挥抗菌作用[21-22]。体内实验发现[23],鱼腥草提取物可有效改善支原体肺炎小鼠肺组织病理变化,降低血清γ-干扰素、IL-6水平,与本研究结果相符,证实鱼腥草有显著抗炎作用,推测鱼腥草提取物通过抑制气道、肺实质内的炎症反应,达到改善肺功能的作用。
TLR4属于天然免疫受体Toll样受体家族成员之一,可通过直接结合病原体或其产物的特定分子结构,引发一系列的信号转导,促进炎症介质释放[24-27]。NF-κB是TLR4下游信号通路,TLR4可通过髓样分化因子88依赖和非依赖两种途径激活NF-κB信号通路,从而发挥调节炎症介质合成和释放的作用[28-31]。本研究发现,应用不同浓度鱼腥草提取物干预后肺组织中TLR4 mRNA、NF-κB mRNA和蛋白相对表达量均较COPD组降低,其中鱼腥草高剂量组降低最显著,提示鱼腥草提取物可能通过抑制TLR4/NF-κB信号通路,调节TNF-α、IL-6、IL-1β炎症因子水平,从而发挥改善COPD急性加重期大鼠肺功能,减轻肺病理损伤的作用。
综上所述,鱼腥草提取物可有效改善COPD急性加重期大鼠肺功能,减轻肺病理损伤,推测与抑制TLR4/NF-κB信号通路有关。在进一步的研究中,应重点探讨鱼腥草提取物能否通过其他信号通路发挥相应调控作用,为鱼腥草相关药物的研发和临床应用提供更全面、充分的理论支持。
