间作麦冬对茶园土壤理化性质及微生物群落结构的影响
2021-04-15李奇松雷卫星刘江西朱捷文史凌珊蔡普默张见明贾小丽
李奇松 雷卫星 刘江西 朱捷文 史凌珊 蔡普默 张见明 贾小丽


摘要:【目的】分析間作麦冬对春季茶园土壤养分、酶活性和微生物群落结构的影响,探讨不同种植模式条件下,茶园土壤环境、微生物群落间的互作机制,为茶园间作模式提供理论依据。【方法】以山地梯田茶园为研究对象,通过16S rDNA高通量测序技术等,分析茶树单作、茶树—麦冬间作及茶园空地土壤(CK)的土壤养分含量、土壤酶活性及细菌群落结构多样性与丰富度差异。【结果】相对于单作,间作麦冬能显著提高茶园土壤含水量与有机质、速效氮、速效磷和速效钾含量(P<0.05,下同),以及脲酶、蛋白酶、纤维素酶和酸性磷酸酶活性,而pH无明显变化。相对于单作和CK,间作麦冬对茶园土壤细菌群落的多样性和丰富度无明显影响,但群落结构发生显著变化;其土壤变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和芽单胞菌门(Gemmatimonadetes)的相对丰度显著提高,而绿弯菌门(Chloroflexi)的相对丰度显著降低。相关分析结果表明,变形菌门和放线菌门与土壤速效营养、有机质和土壤相关酶呈显著正相关;芽单胞菌门与速效氮、速效磷呈显著正相关;绿湾菌门与有机质呈显著负相关。LEfSe分析结果表明,变形菌门中的根瘤菌目(Rhizobiales)、黄单胞菌目(Xanthomonadales)、罗丹诺杆菌科(Rhodanobacteraceae)、褚氏杆菌属(Chujaibacter)、伯克氏菌科未分类菌属(unidentified_Burkholderiaceae),以及放线菌门中的放线菌门未分类菌纲(unidentified_ Actinobacteria)为间作茶园土壤样本的标志性微生物,且相对丰度显著高于CK和单作处理。【结论】茶园间作麦冬可诱导土壤细菌群落结构发生变化,能富集更多参与土壤营养循环和拮抗病原菌的有益细菌,有利于提高土壤养分供给能力和茶树的抗病性。
关键词: 间作;细菌多样性;微生物群落结构;茶园;高通量测序
中图分类号:S154 文献标志码: A 文章编号:2095-1191(2021)12-3366-09
Effects of intercropping Ophiopogon japonicus into tea plantation on its soil physicochemical properties and
microbial community structure
LI Qi-song1,2, LEI Wei-xing1, LIU Jiang-xi1, ZHU Jie-wen1, SHI Ling-shan1,
CAI Pu-mo1, ZHANG Jian-ming1, JIA Xiao-li1,2 *
(1College of Tea and Food Science, Wuyi University, Wuyishan,Fujian 354300, China; 2Fujian Provincial Key Laboratory of Agroecological Processing and Safety Monitoring/College of Life Sciences,Fujian
Agriculture and Forestry University, Fuzhou 350002, China)
Abstract:【Objective】The effects of Ophiopogon japonicus intercropping with tea plantation in springon soil nu-trient, enzyme activity and microbial community structure were analyzed to study the interaction mechanism between soil environment and microorganism under different culture mode conditions, and provide theoretical basis for intercropping practice of tea plantation. 【Method】The tea plantation located at mountain terrace was used as the research objective to analyze the nutrient content, enzyme activity, bacterial community structure and diversity in soilunder tea monoculture, tea-O. japonicus intercropping and tea plantation soil(CK) by using 16S rDNA high-throughput sequencing technology. 【Result】Compared to monoculture, O. japonicus intercropping significantly increased soil water content, organic matter, available nitrogen(N), available phosphorus(P), available potassium(K), urease, protease, cellulase and acid phosphatase(P<0.05,the same below), while pH was not evidently changed. The diversity and richness of soil bacterial community in tea plantation were not greatly influenced by intercropping as compared with that of monoculture and CK, whereas the community structure was significantly changed. The relative abundances of Proteobacteria, Actinobacteria and Gemmatimonadetes were significantly increased in the intercropping treatment, while Chloroflexi was significantly decreased. The correlation analysis showed that Proteobacteria and Actinomycetes were significantly positively correlated with the soil available nutrients, soil organic matter and enzymes;Gemmatimonadetes were significantly positively correlated with available N and available P;Chloroflexi had negative correlation with soil organic matter. LEfSe analysis results showed that Rhizobiales, Xanthomonadales, Rhodanobacteraceae, Chujaibacter and unidentified Burkholderiaceae from Proteobacteria,and unidentified Actinobacteria from Actinobacteria were the biomark microorganisms in soil of intercropping tea plantation, and their abundance were significantly higher than that of CK and monoculture treatment. 【Conclusion】Intercropping O. japonicus in tea plantation can alter the community structure of soil bacteria and enrich more beneficial bacteria that involve in nutrient cycling and antagonistic pathogens, which is conducive to improve soil nutrient supply capacity and tea disease resistance.
Key words: intercropping;bacterial diversity;microbial community structure; tea plantation; high-throughput sequencing
Foundation item: Fujian Natural Science Foundation (2020J05217); Project of the Central Government Guided Local Science and Technology Development(2019L3012); Project of Fujian Young and Middle-aged Teachers Education Research(JAT190787); Open Fund Project of Fujian Provincial Key Laboratory of Agroecological Processing and Safety Monitoring(NYST-2019-02)
0 引言
【研究意義】茶树是多年生常绿木本植物,是我国南方地区重要的特色经济作物。近年来,随着种植时间的推移,单一化栽培带来的茶园土壤生态系统失衡问题日益凸显(Arafat et al.,2017)。一方面,南方地区地形崎岖,多为山地,茶树多采用梯田种植,同时降水量大且不均匀,实际生产中极少种植护坡植物,造成茶园土壤中钙、镁、钾等碱基离子严重流失,进而导致水体污染和土壤酸化;另一方面,茶树自毒分泌物不断累积导致土壤微生物群落失衡,植物病原菌群数量增加,茶园病害频发(Arafat et al.,2017;王海斌等,2018)。间作是一种可持续的耕作方式,能有效提高农田的生物多样性,修复和维持土壤微生物群落结构和功能多样性,抑制田间杂草和病虫害(林文雄和陈婷,2019)。麦冬是多年生耐阴耐旱的常绿草本药用植物,有一定的经济价值。将麦冬间作于茶园梯面和梯壁上,具有提高茶园生物多样性水平,减少土壤及养分流失和抑制茶园杂草的潜力(李洋洋等,2011)。因此,探讨间作麦冬对茶园土壤微生物群落结构、土壤养分和土壤酶活性的影响,阐明茶树—土壤环境—微生物之间的互作机制,可为茶园复合配置提供理论依据,对建设可持续生态茶园具有重要意义。【前人研究进展】近年来,越来越多的学者认为,对作物生长发育及产量形成机制的研究应回归根际(Philippot et al.,2013)。间套作已被证实能对土壤微生物群落结构及多样性产生显著影响,能提高有益菌群数量和减少病原微生物数量,对改良土壤环境和提高植物抗病能力具有积极作用(Li et al.,2014)。目前,关于茶园间作模式的研究主要集中在豆科植物间作和农林间作等。茶园间作三叶草促进了土壤可培养细菌的碳源代谢多样性,改良茶园土壤理化性状(徐华勤等,2008);大豆间作可增加茶园土壤中可培养细菌、真菌和放线菌的数量(韦持章等,2018),提高茶园土壤中有效氮含量,尤其是铵态氮含量,进而影响茶叶主要理化成分的组成及茶叶的口感和香气(Duan et al.,2019);间作豆科植物(大豆和紫云英)不仅能改善茶园土壤营养环境,还能提高土壤中参与碳循环相关微生物的丰度,有利于促进茶树对旱涝的多重抗性(Wang et al.,2021)。对于农林间作,Ma等(2017)研究发现,间作板栗提高了茶园土壤养分的可用性和土壤酶活性,利于茶叶产量和质量的提高;Zhang等(2021)比较了桂花—含笑—茶、含笑—茶和桂花—茶3种间作模式,发现桂花—含笑—茶间作模式最优,可有效提高茶园土壤中拟杆菌门和厚壁菌门的丰度,菌群的变化与茶园土壤营养环境改善密切相关。可见,间作模式具有缓解单一化茶树栽培带来的土壤微生态恶化的作用。【本研究切入点】梯田茶园间作配置中,与豆科植物相比,麦冬为多年生低矮草本,不会影响茶园通风,具有一次种植产生长期效益的特点,可降低劳力成本;与农林间作相比,麦冬能有效降低林下土壤水肥流失。系统了解茶园土壤微生物对麦冬间作的响应机制,是维持茶叶产量和土壤养分可持续性的基本前提。然而,目前尚缺乏相关研究。【拟解决的关键问题】通过高通量测序技术,分析茶树与麦冬间作模式下土壤微生物群落结构的变化,明确茶树麦冬间作模式下土壤微生物群落结构与土壤环境因子的相关性,为茶园间作模式的科学构建提供理论支撑。
1 材料与方法
1. 1 研究区概况
试验在国家水土保持科技示范园(武夷学院)进行(东经118°00′35″,北纬27°44′25″),该地区属中亚热带季风湿润气候区,年平均日照时数1629.5 h,年平均降水量1926.9 mm,年平均气温18.3 ℃,有效积温在5000 ℃以上,相对湿度在80%左右,适合茶树生长。茶园基础土壤肥力(0~20 cm):pH 4.6,全氮0.61 g/kg,全磷0.37 g/kg,全钾9.97 g/kg,有机质12.36 g/kg。
1. 2 试验设计
供试茶树均为6年树龄的肉桂茶树(Camellia sinensis L. Rougui)。茶园为梯田式,总面积为13.3 ha,大行间距为1.5 m,双行单株条列式种植,小行距×株距为0.4 m×0.3 m。分别随机设茶树单作和茶树—冬麦间作2个处理,每处理5个小区样地,每小区样地面积为5.0 m×20.0 m。麦冬于2018年3月6日种植于间作小区的梯面和梯壁(图1),与茶树最小距离为0.3 m,种植行株距为0.18 m×0.18 m。不同处理茶园的栽培管理措施保持一致。
1. 3 土壤样品采集
于2019年4月25日进行田间调查,麦冬株高为18.21 cm,单株叶片数83.59片,覆盖度56.73%。按五点采样法采集距茶树主干15 cm,深度10~20 cm的土壤,将5个点的样品均匀混合,每处理有3次重复。以茶园内的空地土壤作为空白对照(CK)。每个土壤样品分为两部分,一部分储存在-80 ℃用于提取土壤DNA,另一部分储存在4 ℃用于测定土壤酶活性和土壤养分含量。
1. 4 土壤理化性质及酶活性测定
土壤速效氮含量用碱解扩散法测定,速效磷含量用磷钼蓝比色法测定,速效钾含量用火焰原子吸收光谱法测定,土壤pH采用酸度计测定,土壤有机质含量采用重铬酸钾—硫酸消化法测定(鲍士旦,2000)。参考关松荫(1986)的方法测定脲酶、蛋白酶、转化酶、纤维素酶、过氧化物酶、酸性磷酸酶和过氧化物酶等7种土壤酶的活性。
1. 5 土壤总DNA提取
采用BioFast Soil Genomic DNA Extraction Kit试剂盒(BioFlux,杭州,中国)提取土壤总DNA,并以1%琼脂糖凝胶电泳检测其纯度,再用NanoDrop 2000C Spectrophotometer(Thermo Scientific,马萨诸塞州,USA)测定DNA浓度,质量合格的DNA用于根际细菌群落高通量测序分析。
1. 6 16S rDNA高通量测序分析
采用Illumina Hiseq测序方法对茶园土壤微生物群落的丰度和结构进行评价。采用引物341F和806R对16S DNA中V3~V4区域进行扩增,检测细菌的群落结构与多样性。使用TruSeq?DNA PCR-free Sample Preparation Kit试剂盒将纯化的PCR产物进行文库构建。经过Qubit和Q-PCR验证文库合格后,使用NovaSeq6000对DNA文库进行测序。测序数据通过Qiime V1.9.1去除平均质量分数低(Q<20)和长度短(<100 bp)的低质量序列,得到最终的有效数据(Effective Tags)。利用Uparse对所有样本的全部Effective Tags进行聚类,默认以97%的一致性序列聚类成为OTUs。进一步用Qiime V1.9.1中的blast方法与Unit(v7.2)数据库对OTUs序列进行物种注释,获得不同分类水平微生物丰度数据。
1. 7 统计分析
采用DPS 7.05进行单因素方差分析(LSD test,P<0.05)。利用Qiime V1.9.1在OTU水平计算Alpha多样性指数和构建UPGMA样本聚类树。使用LEfSe(Line discriminant analysis effect size)分析不同样本组间显著差异的标志性微生物。使用R软件分析并制作稀释曲线、NMDS图和Spearman相关系数热图。
2 结果与分析
2. 1 麦冬间作对茶园土壤理化性质和酶活性的影响
从表1可看出,茶园梯面和梯壁间作麦冬后,茶园土壤的含水量、有机质、速效氮、速效磷、速效钾含量均显著高于单作(P<0.05,下同),其含水量、有机质、速效钾含量也显著高于CK。单作茶园土壤有机质含量显著高于CK,但速效氮、速效磷和速效钾含量与CK无显著差异(P>0.05,下同)。不同处理间的土壤pH无显著差异。除过氧化物酶和纤维素酶外,不同处理间其他5种土壤酶的活性变化趋势一致,表现为间作>单作>CK。与单作处理相比,间作显著提高了茶园土壤脲酶、蛋白酶、纤维素酶和酸性磷酸酶活性;与CK相比,单作茶树显著提高了脲酶和蛋白酶活性。
2. 2 间作麦冬对茶园土壤细菌群落多样性影响
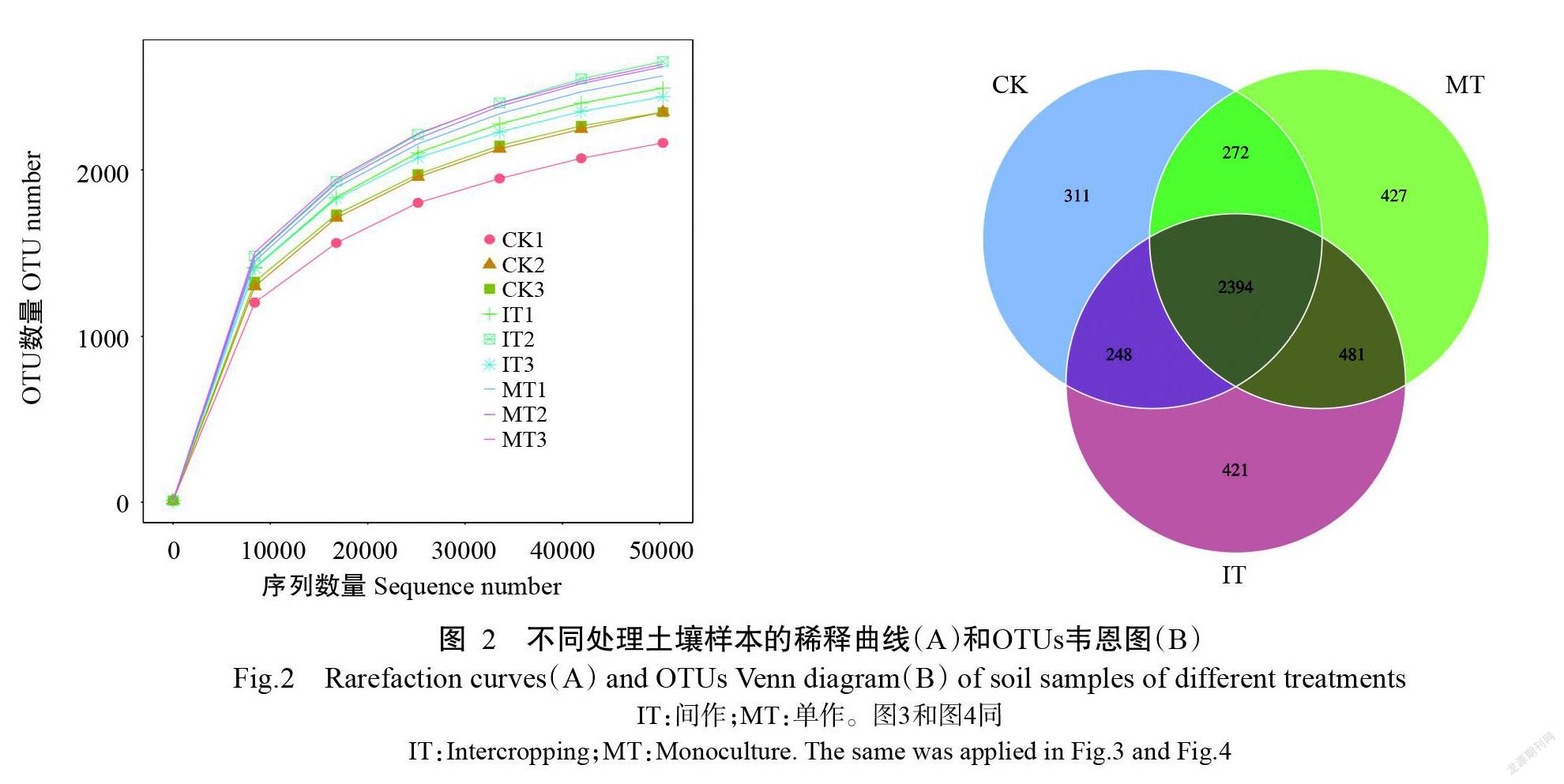
经过高通量测序和Qiime V1.9.1质控处理,9个土壤样品共得到577276条有效序列,每个样品平均有效序列为64142条。稀释曲线可反映测序深度及合理性,也能反映样本中物种的丰富程度。结果显示,在测序数达到40000后曲线趋向平坦,说明测序数据量渐进合理,测序深度足够满足后续分析要求(图2-A)。有效序列经过聚类,间作处理得到3544个OTUs,单作处理获得3574个OTUs,CK获得3225个OTUs(图2-B)。不同处理间共有的OTUs为2394个,即不同处理间至少有66.98%的OTUs是共有的。分别有96.29%、88.27%、72.16%、54.62%、33.75%、4.88%的OTUs成功注释到35门、46纲、102目、185科、388属和192种。
由表2可知,样本的文库覆盖度在99.0%以上,说明注释所获得的种群数据基本能代表土壤细菌群落的真实情况。间作处理的菌群丰富度(物种数、Chao1指数、ACE指数)和多样性指数(香农指数、辛普森指数)均略高于单作处理,但未达到顯著水平。间作处理和单作处理的菌群丰富度和多样性均显著高于CK,说明种植茶树能提高土壤细菌多样性和丰富度,但间作麦冬无法显著改变茶园土壤的细菌群落多样性和丰富度。
2. 3 茶园土壤细菌群落组成与群落结构
为明确不同处理土壤细菌群落结构的差异,对不同处理的土壤细菌群落结构进行非度量多维尺度NMDS和UPGMA聚类分析(图3),结果表明,间作处理土壤微生物群落结构显著区别于单作处理和CK(图3-A);与CK相比,单作处理和间作处理的土壤微生物群落结构一致性更高(图3-B),说明种植茶树可构建茶树特有的土壤细菌群落结构,间作麦冬进一步影响了土壤细菌群落组成。
从门水平看,前十大菌门涵盖了土壤样品中超过95.37%的细菌,其中酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)为优势菌门,占比超过87.98%(图3-B)。与CK相比,茶树单作显著降低土壤中酸杆菌门的相对丰度,提高变形菌门和拟杆菌门(Bacteroidetes)的相对丰度。与单作茶树相比,间作麦冬茶园土壤中变形菌门、放线菌门和芽单胞菌门(Gemmatimonadetes)的相对丰度显著提高,而绿弯菌门、拟杆菌门和疣微菌门(Verrucomicrobia)的相对丰度降低。
2. 4 不同处理间显著性差异菌群
LEfSe分析可用于不同样本组之间微生物群落的比较,能在组与组间获取具有统计学显著差异的标志性微生物种类(Segata et al.,2011)。图4结果显示,当LDA Score>4时,不同处理间酸杆菌门、酸杆菌纲(Acidobacteriia)和酸杆菌目(Acidobacteriales)为CK样本标志性微生物,且相对丰度显著高于单作和间作处理;单作茶园土壤样本中,拟杆菌门、拟杆菌纲(Bacteroidia)、纤线杆菌科(Ktedonobactera-ceae)为标志性微生物,且相对丰度显著高于CK和间作处理;变形菌门、γ-变形菌纲(Gammaproteobacteria)、伯克氏菌科未分类菌属(unidentified_Burkholderiaceae)、黄单胞菌目(Xanthomonadales)、罗丹诺杆菌科(Rhodanobacteraceae)、褚氏杆菌属(Chujaibacter)、放线菌门、放线菌门未分类菌纲(unidentified_Actinobacteria)、根瘤菌目(Rhizobiales)为间作茶园土壤样本标志性微生物,且相对丰度显著高于CK和单作处理。
2. 5 细菌群落结构与土壤理化性质的相关性
土壤环境变量与优势菌门的相关分析结果(图5)表明,变形菌门、放线菌门、蓝藻门与速效钾、有机质、含水量、脲酶、蛋白酶、纤维素酶、转化酶、酸性磷酸酶、多酚氧化酶均呈显著正相关,绿湾菌门与有机质呈显著负相关,芽单胞菌门与速效氮、速效磷呈显著正相关,硝化螺旋菌门(Nitrospirae)与速效钾、含水量、转化酶呈显著负相关。
3 讨论
植物多样性已被证实能改变土壤生物区系的组成和功能(Eisenhauer et al.,2017)。间作是植物多样性在农业实践中的具体应用,有利于保持土壤微生态稳定性和提高土壤养分利用率(Li et al.,2014)。土壤酶是土壤中重要的生物活性物质,与土壤物质循环和养分供应能力紧密相关,是评价土壤肥力和土壤环境质量的重要指标(Dindar et al.,2015)。间作麦冬能否对茶园土壤环境产生影响还未知。据此,本研究对单作、间作茶园土壤理化性质进行分析,结果表明,间作麦冬能显著提高茶园土壤的含水量、有机质、速效氮、速效磷和速效钾含量;同时,其脲酶、蛋白酶、纤维素酶和酸性磷酸酶活性也显著上升,与其他茶园间作体系相似(韦持章等,2018;Duan et al.,2019)。
茶园土壤酸化是茶树种植中面临的重要问题。前人对不同茶园间作模式的研究中,部分学者发现间作不能显著提高土壤pH(李艳春等,2019);而黎健龙等(2008)、邢瑶等(2020)研究发现,茶园间作大豆和玉米后,将其秸秆还田后能显著提高土壤有机质和pH。本研究中,间作麦冬对茶园土壤pH未产生影响,但提高了土壤的有机质含量。这可能与麦冬间作过程中,凋落的叶片和根系的不断输入,并被土壤纤维素酶降解有关。但本研究中麦冬间作的时长仅为1年,因而对土壤pH的影响还不显著,有待今后开展长期定位试验进行验证。综合麦冬间作茶园土壤理化及酶活性结果,麦冬和茶树间作下,地下部相互作用提高了土壤酶活性,促进了土壤物质循环,改善了土壤的水肥条件。土壤酶主要来源于微生物,其活性与土壤微生物群落的变化密切相关(Dindar et al.,2015)。土壤细菌参与植物生长发育中的营养吸收、生长调节和拮抗病原微生物等生态学过程(Lladó et al.,2017;Maron et al.,2018)。间作条件下,不同植物来源的根系分泌物能介导土壤中微生物群落结构及功能发生变化(Li et al.,2018;Zhang et al.,2019)。间作种植模式常被认为可提高土壤微生物群落多样性(Li and Wu,2018;Zhang et al.,2019)。在本研究中,间作麦冬没有显著提高茶园土壤细菌群落多样性指数,但显著改变了茶园土壤微生物群落,与小麦/西瓜(Yu et al.,2019)、马铃薯/玉米(伏云珍等,2020)、灵芝/茶树(李艳春等,2019)等间作组合的研究结果相似。可见,细菌多样性水平是否发生变化可能取决于间作类型和土壤环境条件,而土壤生态系统功能多样性主要取决于功能微生物群落组成而非分类多样性(Chaparro et al.,2012;Lakshmanan et al.,2014)。
本研究发现,与单作茶树相比,间作麦冬茶园土壤中的变形菌门、酸杆菌门、放线菌门和芽单胞菌门的丰度显著提高,而绿弯菌门的丰度显著降低。有报道表明,变形菌门是富营养细菌,常在氮营养较高的土壤环境中聚集(彭玉娇等,2020);绿弯菌门生长缓慢,通常聚集于低营养环境(Nu?bel et al.,2001)。放线菌门广泛分布于土壤中,在纤维素分解和腐殖质形成中起到至关重要的作用(Ventura et al.,2007)。Lin等(2019)報道称,有机肥的使用显著增加了酸杆菌门和芽单胞菌门的相对丰度。由此可见,麦冬—茶树间作体系中绿弯菌门减少的同时变形菌门、放线菌门和芽单胞菌门增加,从而促进土壤养分循环和纤维素降解,与土壤速效养分和有机质含量上升密切相关。土壤环境变量与优势菌门的相关分析进一步证实了这一结果,即变形菌门和放线菌门与土壤速效营养、有机质和营养循环相关酶呈显著正相关;芽单胞菌门与速效氮、速效磷呈显著正相关;绿湾菌门与有机质呈显著负相关。
根际促生菌在农业生态系统中具有重要作用,可以抑制植物土传病原微生物,提高速效养分浓度和促进植物生长(Khatoon et al.,2020)。在本研究中,LEfSe分析表明,变形菌门中的根瘤菌目、黄单胞菌目、罗丹诺杆菌科、褚氏杆菌属和伯克氏菌科未分类菌属,以及放线菌门中的放线菌门未分类菌纲为间作茶园土壤样本标志性微生物,且丰度显著高于空白土壤和单作茶树处理。根瘤菌目和褚氏杆菌属与固氮、氨氧化和硝化作用有关(Cloutier et al.,2021)。伯克氏菌广泛存在于健康土壤中,与植物生长密切相关,能有效控制土壤病害的发生,部分菌种具有解磷能力(Bontemps et al.,2010)。黄单胞菌目和所属的罗丹诺杆菌科,以寡养单胞菌属(Stenotrophomonas)为主(占菌科相对丰度的92%),该菌属不仅能促进植物生长,而且能代谢土壤中大量有机化合物(Robert et al.,2009)。放线菌门参与土壤中纤维素和腐殖质代谢。综上所述,麦冬间作茶树可诱导土壤细菌群落结构发生变化,富集更多参与物质循环和拮抗植物病原菌的有益细菌。
4 結论
间作麦冬对茶园土壤细菌群落的多样性和丰富度无明显影响,但可诱导土壤细菌群落结构发生变化,能富集更多参与土壤营养循环和拮抗植物病原菌的有益细菌,有利于提高土壤养分供给能力和茶树抗病性。
参考文献:
鲍士旦. 2000. 土壤农化分析[M]. 北京:中国农业出版社. [Bao S D. 2000. Soil agrochemical analysis[M]. Beijing:China Agriculture Press.]
伏云珍,马琨,李倩,李光文,崔慧珍. 2020. 马铃薯||玉米间作对土壤细菌多样性的影响[J]. 中国生态农业学报(中英文),28(11):1715-1725. [Fu Y Z,Ma K,Li Q,Li G W,Cui H Z. 2020. Effects of potato intercropped with maize on soil bacterial diversity[J]. Chinese Journal of Eco-Agriculture,28(11):1715-1725.] doi:10.13930/j.cnki.cjea.200 240.
关松荫. 1986. 土壤酶及其研究法[M]. 北京:农业出版社. [Guan S Y. 1986. Soil enzyme and its research methods[M]. Beijing:Agriculture Press.]
黎健龙,涂攀峰,陈娜,唐劲驰,王秀荣,年海,廖红,严小龙. 2008. 茶树与大豆间作效应分析[J]. 中国农业科学,41(7):2040-2047. [Li J L,Tu P F,Chen N,Tang J C,Wang X R,Nian H,Liao H,Yan X L. 2008. Effects of tea intercropping with soybean[J]. Scientia Agricultura Sinica,41(7):2040-2047.] doi:10.3864/j.issn.0578-1752.2008. 07.022.
李艳春,林忠宁,陆烝,刘明香. 2019. 茶园间作灵芝对土壤细菌多样性和群落结构的影响[J]. 福建农业学报,34(6):690-696. [Li Y C,Lin Z N,Lu Z,Liu M X. 2019. Microbial diversity and community structure in soil under tea bushes-Ganoderma lucidum intercropping[J]. Fujian Journal of Agricultural Sciences,34(6):690-696.] doi:10. 19303/j.issn.1008-0384.2019.06.010.
李洋洋,樊吉,张庆国,严力蛟,伍少福,朱雅莉,沈艳. 2011. 麦冬与黄花菜在南方丘陵山区坡耕地保育土壤作用研究[J]. 土壤通报,42(5):1070-1075. [Li Y Y,Fan J,Zhang Q G,Yan L J,Wu S F,Zhu Y L,Shen Y. 2011. Soil protection and fertility improvement via Ophiopogonis and Hemerocallis plantations in the slope farmlands in southern hilly region of China[J]. Chinese Journal of Soil Science,42(5):1070-1075.] doi:10.19336/j.cnki.trtb.2011.05.009.
林文雄,陈婷. 2019. 中国农业的生态化转型与发展生态农业新视野[J]. 中国生态农业学报,27(2):169-176. [Lin W X,Chen T. 2019. Transition of agricultural systems to ecologicalizaton and new vision of modern eco-agriculture development in China[J]. Chinese Journal of Eco-Agri-culture,27(2):169-176.] doi:10.13930/j.cnki.cjea.181056.
彭玉娇,崔学宇,谭梦超,阮红燕,邵元元,曾文萍,区燕丽,侯彦林. 2020. 不同立地条件沙田柚果园土壤微生物多样性分析[J]. 南方农业学报,51(5):1136-1144. [Peng Y J,Cui X Y,Tan M C,Ruan H Y,Shao Y Y,Zeng W P,Ou Y L,Hou Y L. 2020. Soil microbe and diversity in Shatian pomelo orchard under different site conditions[J]. Journal of Southern Agriculture,51(5):1136-1144.] doi:10.3969/j.issn.2095-1191.2020.05.019.
王海斌,陈晓婷,丁力,邱丰艳,孔祥海,叶江华,贾小丽. 2018. 连作茶树根际土壤自毒潜力、酶活性及微生物群落功能多样性分析[J]. 热带作物学报,39(5):852-857. [Wang H B,Chen X T,Ding L,Qiu F Y,Kong X H,Ye J H,Jia X L. 2018. Analysis on autotoxic potential,enzyme activity and microbial community function diversity of the rhizosphere soils from tea plants with continuous cropping years[J]. Chinese Journal of Tropical Crops,39(5):852-857.] doi:10.3969/j.issn.1000-2561.2018.05.004.
韋持章,农玉琴,陈远权,陈海生,韦锦坚,李金婷,陆金梅,覃潇敏. 2018. 茶树/大豆间作对根际土壤微生物群落及酶活性的影响[J]. 西北农业学报,27(4):537-544. [Wei C Z,Nong Y Q,Chen Y Q,Chen H S,Wei J J,Li J T,Lu J M,Qin X M. 2018. Effects of tea and soybean intercropping on soil microbial community and enzyme activity[J]. Acta Agriculturae Boreali-occidentalis Sinica,27(4):537-544.] doi:10.7606/j.issn.1004-1389.2018.04.010.
邢瑶,唐锁海,陈暄,徐德良,孙春霞,张春,马俊. 2020. 幼龄茶园间作大豆、玉米对土壤养分的影响[J]. 江苏农业科学,48(24):132-135. [Xing Y,Tang S H,Chen X,Xu D L,Sun C X,Zhang C,Ma J. 2020. Effects of intercropping soybean and maize on soil nutrients in young tea garden[J]. Jiangsu Agricultural Sciences,48(24):132-135.] doi:10.15889/j.issn.1002-1302.2020.24.025.
徐华勤,肖润林,宋同清,罗文,任全,黄瑶. 2008. 稻草覆盖与间作三叶草对丘陵茶园土壤微生物群落功能的影响[J]. 生物多样性,16(2):166-174. [Xu H Q,Xiao R L,Song T Q,Luo W,Ren Q,Huang Y. 2008. Effects of mulching and intercropping on the functional diversity of soil microbial communities in tea plantations[J]. Biodiversity Science,16(2):166-174.] doi:10.3321/j.issn:1005-0094. 2008.02.009.
Arafat Y,Wei X Y,Jiang Y H,Chen T,Saqib H S A,Lin S,Lin W X. 2017. Spatial distribution patterns of root-associated bacterial communities mediated by root exudates in different aged ratooning tea monoculture systems[J]. International Journal of Molecular Sciences,18(8):1727. doi:10.3390/ijms18081727.
Bontemps C,Elliott G N,Simon M F,Dos Reis Júnior F B,Gross E,Lawton R C,Neto N E,de Fátima Loureiro M,De Faria S M,Sprent J I,James E K,Young J P W. 2010. Burkholderia species are ancient symbionts of legumes[J]. Molecular Ecology,19(1):44-52. doi:10.1111/ j.1365-294X.2009.04458.x.
Chaparro J M,Sheflin A M,Manter D K,Vivanco J M. 2012. Manipulating the soil microbiome to increase soil health and plant fertility[J]. Biology and Fertility of Soils,48(5):489-499. doi:10.1007/s00374-012-0691-4.
Cloutier M,Chatterjee D,Elango D,Cui J,Bruns M A,Chopra S. 2021. Sorghum root flavonoid chemistry,cultivar,and frost stress effects on rhizosphere bacteria and fungi[J]. Phytobiomes Journal,5(1):39-50. doi:10.1094/PBIOMES-01-20-0013-F1.
Dindar E,?a?ban F,Ba?kaya H S. 2015. Evaluation of soil enzyme activities as soil quality indicators in sludge-amended soils[J]. Journal of Environmental Biology,36(4):919-926.
Duan Y,Shen J,Zhang X,Wen B,Ma Y,Wang Y,Fang W,Zhu X. 2019. Effects of soybean-tea intercropping on soil-available nutrients and tea quality[J]. Acta Physiologiae Plantarum,41(8):1-9. doi:10.1007/s11738-019-2932-8.
Eisenhauer N,Lanoue A,Strecker T,Scheu S,Steinauer K,Thakur M P and Mommer L. 2017. Root biomass and exudates link plant diversity with soil bacterial and fungal biomass[J]. Scientific Reports,7:44641. doi:10.1038/srep 44641.
Khatoon Z,Huang S,Rafique M,Fakhar A,Kamran M A,Santoyo G. 2020. Unlocking the potential of plant growth-promoting rhizobacteria on soil health and the sustainabi-lity of agricultural systems[J]. Journal of Environmental Management,273:111118. doi:10.1016/j.jenvman.2020. 111118.
Lakshmanan V,Selvaraj G,Bais H P. 2014. Functional soil microbiome:Belowground solutions to an aboveground problem[J]. Plant Physiology,166(2):689-700. doi:10. 1104/pp.114.245811.
Li L,Tilman D,Lambers H,Zhang F S. 2014. Plant diversity and overyielding:Insights from belowground facilitation of intercropping in agriculture[J]. New Phytologist,203(1):63-69. doi:10.1111/nph.12778.
Li Q S,Chen J,Wu L K,Luo X M,Li N,Arafat Y,Lin S,Lin W X. 2018. Belowground interactions impact the soil bacterial community,soil fertility,and crop yield in maize/peanut intercropping systems[J]. International Journal of Molecular Sciences,19(2):622. doi:10.3390/ijms 19020622.
Li S,Wu F. 2018. Diversity and co-occurrence patterns of soil bacterial and fungal communities in seven intercropping systems[J]. Frontiers in Microbiology,9:1521. doi:10.3389/fmicb.2018.01521.
Lin W,Lin M,Zhou H,Wu H,Li Z,Lin W. 2019. The effects of chemical and organic fertilizer usage on rhizosphere soil in tea orchards[J]. PLoS One,14(5):e0217018. doi:10.1371/journal.pone.0217018.
Lladó S,López-Mondéjar R,Baldrian P. 2017. Forest soil bacteria:Diversity,involvement in ecosystem processes,and response to global change[J]. Microbiology and Molecular Biology Reviews,81(2):e00063-16. doi:10.1128/MMBR.00063-16.
Ma Y H,Fu S L,Zhang X P,Zhao K,Chen H Y H. 2017. Intercropping improves soil nutrient availability,soil enzyme activity and tea quantity and quality[J]. Applied Soil Eco-logy,119:171-178. doi:10.1016/j.apsoil.2017.06.028.
Maron P A,Sarr A,Kaisermann A,Lévêque J,Mathieu O,Guigue J,Karimi B,Bernard L,Dequiedt S,Terrat S. 2018. High microbial diversity promotes soil ecosystem functioning[J]. Applied and Environmental Microbiology,84(9):e02738-17. doi:10.1128/AEM.02738-17.
Nu?Bel U,Bateson M M,Madigan M T,Ku?Hl M,Ward D M. 2001. Diversity and distribution in hypersaline microbial mats of bacteria related to Chloroflexus spp.[J]. Applied and Environmental Microbiology,67(9):4365-4371. doi:10.1128/AEM.67.9.4365-4371.2001.
Philippot L,Raaijmakers J M,Lemanceau P,van der Putten W H. 2013. Going back to the roots:The microbial ecology of the rhizosphere[J]. Nature Reviews Microbiology,11:789-799. doi:10.1038/nrmicro3109.
Robert R,Sebastien M,Massimiliano C,Safiyh T,Lisa C,Avison M B,Gabriele B,Lelie Daniel van der,Maxwell D J. 2009. The versatility and adaptation of bacteria from the genus Stenotrophomonas[J]. Nature Reviews Microbiology,7:514-525. doi:10.1038/nrmicro2163.
Segata N,Izard J,Waldron L,Gevers D,Miropolsky L,Garrett W S,Huttenhower C. 2011. Metagenomic biomarker discovery and explanation[J]. Genome Biology,12(6):R60. doi:10.1186/gb-2011-12-6-r60.
Ventura M,Canchaya C,Tauch A,Chandra G,Fitzgerald G F,Chater K F,Van Sinderen D. 2007. Genomics of Actinobacteria:Tracing the evolutionary history of an ancient phylum[J]. Microbiology and Molecular Biology Reviews,71(3):495-548. doi:10.1128/MMBR.00005-07.
Wang T,Duan Y,Liu G D,Shang X W,Liu L F,Zhang K X,Li J Q,Zou Z W,Zhu X J,Fang W D. 2021. Tea plantation intercropping green manure enhances soil functional microbial abundance and multifunctionality resistance to drying-rewetting cycles[J]. Science of The Total Environment,151282. doi:10.1016/j.scitotenv.2021.151282.
Yu H,Chen S,Zhang X,Zhou X,Wu F Z. 2019. Rhizosphere bacterial community in watermelon-wheat intercropping was more stable than in watermelon monoculture system under Fusarium oxysporum f. sp. niveum invasion[J]. Plant and Soil,445(1):369-381. doi:10.1007/s11104-019- 04321-5.
Zhang C,Wang J,Liu G B,Song Z L,Fang L C. 2019. Impact of soil leachate on microbial biomass and diversity affected by plant diversity[J]. Plant and Soil,439:505-523. doi:10.1007/s11104-019-04032-x.
Zhang G,Chu X,Zhu H,Zou D,Li L,Du L S. 2021. The response of soil nutrients and microbial community structures in long-term tea plantations and diverse agroforestry intercropping systems[J]. Sustainability,13(14):7799. doi:10.3390/su13147799.
(責任编辑 王 晖)
