咪唑乙烟酸对黏质沙雷氏菌酶活性的影响
2021-04-14李唯一于凯悦刘宇航董爱荣刘君旭
李唯一 于凯悦 刘宇航 董爱荣 刘君旭


摘 要:为探究黏质沙雷氏菌(Serratia marcescens)降解咪唑乙烟酸有关的酶,用靛酚蓝比色法、3.5-二硝基水杨酸(DNS)比色法、高锰酸钾滴定法和邻苯三酚比色法分别检测黏质沙雷氏菌培养液中脲酶、蔗糖酶、过氧化氢酶、多酚氧化酶和纤维素酶的酶活性,以不加咪唑乙烟酸的纯培养液作为对照。结果表明:以咪唑乙烟酸为唯一碳源培养的黏质沙雷氏菌,脲酶活性培养初期时最高,然后逐渐下降,最后趋于平衡;蔗糖酶活性随培养时间缓慢上升;过氧化氢酶活性呈上升—下降—上升—下降的趋势;多酚氧化酶活性培养初期时活性最高,后一直呈下降趋势,72 h后急剧下降至最低水平;纤维素酶活性先下降后上升,培养结束时恢复至初期水平。通过相关性分析得知,咪唑乙烟酸降解率与脲酶活性呈高度负相关关系,与蔗糖酶活性呈高度正相关关系。
关键词:咪唑乙烟酸;黏质沙雷氏菌;酶活性;降解率
中图分类号:S154.2;S481;S565.1 文献标识码:A 文章编号:1006-8023(2021)02-0018-05
Effect of Imazethapyr on the Enzyme Activity of Serratia marcescens
LI Weiyi1, YU Kaiyue1, LIU Yuhang1, DONG Airong1*, LIU Junxu2
(1.School of Forestry, Northeast Forestry University, Harbin 150040, China;
2.Qingdao Institute of Termite Control, Qingdao 266012, China)
Abstract:In order to explore the enzymes related to the degradation of imazethapyr by Serratia marcescens, the enzyme activities of urease, sucrase, catalase, polyphenol oxidase and cellulase in the culture medium of Serratia marcescens were detected by indophenol blue colorimetry, 3.5-dinitrosalicylic acid (DNS) colorimetry, potassium permanganate titration and pyrogallol colorimetry, respectively. The pure culture medium without imazethapyr was used as control. The results showed that the urease activity of Serratia marcescens cultured with imazethapyr as the sole carbon source was the highest at the initial stage of culture, gradually decreased, and then tended to balance, and the sucrase activity increased slowly with the culture time. The activity of catalase showed a trend of increased-decreased-increased-decreased. The activity of polyphenol oxidase was the highest at the beginning of culture, and then decreased sharply to the lowest level after 72 hours. The cellulase activity decreased at first and then increased, and returned to the initial level at the end of culture. Through correlation analysis, it was found that the degradation rate of imazethapyr was highly negatively correlated with urease activity, highly correlated with sucrase activity.
Keywords:Imazethapyr; Serratia marcescens; enzyme activity; degradation rate
收稿日期:2020-09-30
基金項目:国家自然科学基金项目(31670494)
第一作者简介:李唯一,硕士研究生。研究方向为森林病理学。E-mail: 921376776@qq.com
通信作者:董爱荣,博士,副教授。研究方向为森林病理学。E-mail: darlmy@163.com
引文格式:李唯一,于凯悦,刘宇航,等.咪唑乙烟酸对黏质沙雷氏菌酶活性的影响[J].森林工程,2021,37(2):18-23.
LI W Y, YU K Y, LIU Y H, et al. Effect of imazethapyr on the enzyme activity of Serratia Marcescens[J]. Forest Engineering,2021,37(2):18-23.
0 引言
咪唑乙烟酸是一种咪唑啉酮类除草剂,与其他常用除草剂相比,具有杀草谱广、除草效果好、成本低、苗前苗后都可用、活性高和用量低等优点,在我国被广泛使用[1]。例如,咪唑乙烟酸能有效提高苜蓿产量、降低杂草种类[2-3]。目前黑龙江省主要使用于单季大豆田[4]。农药的大量使用会对生态环境造成破坏,并且农药的残留也将危害人畜的健康[5]。
微生物是农药转化降解的重要因素之一。研究表明,微生物主要是通过酶促反应对农药起作用[6]。黏质沙雷氏菌(Serratia marcescens)是一种在自然界中广泛存在的兼性厌氧菌,是水和土壤的常居菌群,同时也是一种应用前景非常广阔的微生物[7]。例如,黏质沙雷氏菌能分泌高活性的几丁质酶,具有杀菌杀虫作用,可用于防治植物病虫害[8]。黏质沙雷氏菌对亚洲柑橘木虱(Diaphorina citri)若虫有较高的杀虫活性,其发酵的上清液也可导致亚洲柑橘木虱若虫死亡[9]。黏质沙雷氏菌产生的脂肪酶可广泛应用于食品、制药以及生物能源等领域[10]。从黏质沙雷氏菌细胞壁提取的灵杆菌脂多糖可以抗肿瘤[11]。黏质沙雷氏菌作为一种生防菌,对连作土壤具有修复作用[12]。此外,黏质沙雷氏菌还可以降解油脂[13]。
自然条件下,咪唑乙烟酸的降解不是以单一的方式进行,它可以在多种不同酶作用下以不同的方式进行[14]。酶具有专一性,而能降解同一类底物的酶通常具有相似的性质。脲酶是一种催化尿素水解成氨和二氧化碳的酶。蔗糖酶不仅能催化蔗糖水解生成葡萄糖和果糖,也能催化棉子糖水解,生成密二糖和果糖。过氧化氢酶能催化过氧化氢分解成氧和水。多酚氧化酶是一类含铜的氧化还原酶,能催化邻苯二酚氧化成邻苯二醌,也能作用于单酚单加氧酶的底物。纤维素酶能在分解纤维素时起生物催化作用,是可以将纤维素分解成寡糖或单糖的蛋白质。本文通过测定咪唑乙烟酸对黏质沙雷氏菌生化酶活性的影响,探寻与降解咪唑乙烟酸相关酶系,为咪唑乙烟酸及其他咪唑啉酮类除草剂的生物酶降解提供理论基础。
1 材料与方法
1.1 试验材料
黏质沙雷氏菌(Serratia marcescens)为课题组前期驯化得到的高效降解菌株。菌株富集培养采用牛肉膏蛋白胨培养基。其他实验采用无机盐培养基。
1.2 试验方法
将黏质沙雷氏菌接种于盛有100 mL的富集培养基的锥形瓶中,置于28 ℃、160 r/min的摇床上培养2 d。取10 mL培养液加入盛有90 mL质量分数为100 mg/kg的咪唑乙烟酸的无机盐培养基中,其中咪唑乙烟酸为唯一碳源,对照组为加10 mL的无机盐培养基,均置于25 ℃、160 r/min的摇床上培养4 d,从中取12、24、48、72、96 h的菌液,12 000 r/min离心10 min,取上清液即为粗酶液,测定各培养时间的酶活性和降解率。
1.3 酶活性测定
脲酶活性测定采用靛酚蓝比色法[15]。蔗糖酶活性测定采用3,5-二硝基水杨酸(DNS)比色法[16]。过氧化氢酶活性测定采用高锰酸钾滴定法[17]。多酚氧化酶活性测定采用邻苯三酚比色法[18]。纤维素酶活性测定采用3,5-二硝基水杨酸(DNS)比色法[19]。
1.4 降解率的测定
参照靳颖华[20]的方法,采用液相色谱法测定咪唑乙烟酸降解率。采用Waters2695液相色谱仪与Waters2996紫外检测器(上海力明生物科技有限公司),流动相:VA液为0.05%冰乙酸乙腈,VB液为0.4%冰乙酸水溶液,VA与VB体积比为40∶60;分离分析柱为Agilent ZORBAX Extend-C18柱(250 mm,4.6 mm,5μm);进样条件:柱温室温,进样量10 μL,检测波长254 nm。
咪唑乙烟酸降解率= [(CK残留质量分数-加培养液残留质量分数)/CK残留质量分数]×100%。
1.5 数据分析
数据整理计算和作图采用Excel 2010,相关性分析采用SPSS 22.0统计分析软件(IBM公司)。
2 结果与分析
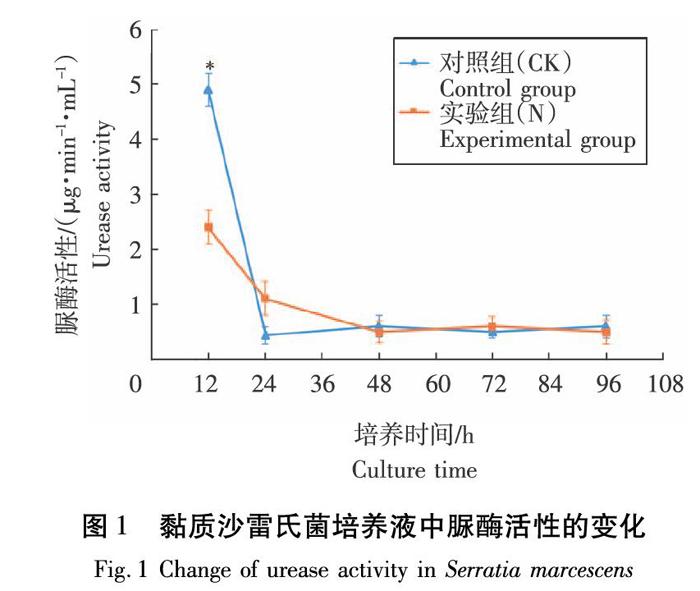
2.1 咪唑乙烟酸对黏质沙雷氏菌脲酶活性影响
对照组(CK)为黏质沙雷氏菌的纯培养液,实验组(N)为加入咪唑乙烟酸的黏质沙雷氏菌培养液。培养初期,实验组(N)脲酶活性远低于对照组(CK),说明咪唑乙烟酸抑制了黏質沙雷氏菌分泌脲酶。24 h时,两组脲酶活性均降低,对照组(CK)脲酶活性最低值达0.423 μg/(min·mL),之后两组脲酶活性都逐渐趋于水平,差异性不大(图1)。
2.2 咪唑乙烟酸对黏质沙雷氏菌蔗糖酶活性影响
对照组(CK)为黏质沙雷氏菌的纯培养液,实验组(N)为加入咪唑乙烟酸的黏质沙雷氏菌培养液。实验组(N)蔗糖酶活性呈缓慢上升的趋势,而对照组(CK)蔗糖酶活性是先降低后升高。培养12 h时,两组蔗糖酶活性基本相同。之后加入咪唑乙烟酸的实验组(N)蔗糖酶活性开始缓慢上升,直到培养结束。对照组(CK)蔗糖酶活性在培养24 h时有所下降,达到最低值807.23 μg/(min·g),之后逐渐上升并趋于平稳(图2)。
2.3 咪唑乙烟酸对黏质沙雷氏菌过氧化氢酶活性影响
对照组(CK)为黏质沙雷氏菌的纯培养液,实验组(N)为加入咪唑乙烟酸的黏质沙雷氏菌培养液。加入咪唑乙烟酸的实验组(N)和未加咪唑乙烟酸的对照组(CK)过氧化氢酶活性的变化趋势大致相同,呈上升—下降—上升—下降的趋势。培养12 h时,两组过氧化氢酶活性最低。培养24 h时,两组过氧化氢酶活性均升高,而对照组(CK)的过氧化氢酶活性高于实验组(N)。这可能是因为黏质沙雷氏菌的数量增加,活性增强,促进了过氧化氢酶的分泌。培养48 h时,实验组(N)过氧化氢酶活性有所下降,对照组(CK)过氧化氢酶活性显著降低。培养72 h时,两组过氧化氢酶活性又开始上升,均恢复至24 h时的水平。之后又开始下降,直到培养结束(图3)。
2.4 咪唑乙烟酸对黏质沙雷氏菌多酚氧化酶活性影响
对照组(CK)为黏质沙雷氏菌的纯培养液,实验组(N)为加入咪唑乙烟酸的黏质沙雷氏菌培养液。在培养期间,两组多酚氧化酶活性的变化趋势大致相同。培养12 h时,两组多酚氧化酶活性相差不多。培养24 h时,两组多酚氧化酶活性均开始下降,可能是因为咪唑乙烟酸抑制了黏质沙雷氏菌分泌多酚氧化酶,但实验组(N)比对照组(CK)高3.6 U/mL。之后48 h和72 h时的多酚氧化酶活性变化不大,72 h之后兩组多酚氧化酶活性均急速下降,直到培养结束(图4)。
2.5 咪唑乙烟酸对黏质沙雷氏菌纤维素酶活性影响
对照组(CK)为黏质沙雷氏菌的纯培养液,实验组(N)为加入咪唑乙烟酸的黏质沙雷氏菌培养液。在培养初期,两组纤维素酶活性的变化趋势相同,纤维素酶活性均有所升高。从24 h开始,加入咪唑乙烟酸的实验组(N)与不加咪唑乙烟酸的对照组(CK)的变化趋势在各个时期均相反。培养48 h时,对照组(CK)纤维素酶活性达到最高值47.91 μg/(min·mL),而实验组(N)纤维素酶活性显著降低,达到最低值8.74 μg/(min·mL)。培养72 h时,对照组(CK)纤维素酶活性为最低值36.73 μg/(min·mL),而实验组(N)则显著升高(图5)。
黏质沙雷氏菌各酶活性各时间点对照组和实验组显著性差异分析情况见表1。
2.6 黏质沙雷氏菌对咪唑乙烟酸的降解率
黏质沙雷氏菌对咪唑乙烟酸的降解率趋势如图6所示,在96 h内,随着时间的增长,咪唑乙烟酸的降解率逐渐增加,48 h后达到86.45%,之后缓慢增长,直至92.33%。
2.7 黏质沙雷氏菌液中各酶活性与降解率相关性分析
通过SPSS 软件对不同培养时期的黏质沙雷氏菌的各种酶活性数据与对应时期的咪唑乙烟酸降解率进行相关性分析,结果见表2。以咪唑乙烟酸为唯一碳源培养黏质沙雷氏菌,咪唑乙烟酸的降解率与脲酶活性呈高度负相关;与蔗糖酶活性呈高度正相关,与过氧化氢酶、多酚氧化酶和纤维素酶活性相关性不显著。
3 结论与讨论
利用本身对农药有降解作用的酶系基因,微生物会将农药直接作为唯一碳源和能源,分解成诸多分子量小的化合物[21]。以咪唑乙烟酸为唯一碳源培养黏质沙雷氏菌,所选择的5种酶活性均有变化,说明咪唑乙烟酸的降解跟这5种酶均有一定的关系。脲酶活性在培养初期最高,24 h急剧下降,然后趋于平衡;蔗糖酶活性呈缓慢上升;过氧化氢酶活性呈上升—下降—上升—下降的趋势;多酚氧化酶活性培养初期时活性最高,后一直呈下降趋势,直至下降至最低水平;纤维素酶活性先下降后上升,培养结束时恢复至初期水平,变化趋势与对照组相反。
目前研究发现,能够降解咪唑啉酮类除草剂的微生物主要为土壤中的细菌,包括酸单胞杆菌属、产碱菌属、芽孢杆菌属、海球菌属、节细菌属、丙酸杆菌属和无色杆菌等,还有黑曲霉和放线菌[22]。本文通过对黏质沙雷氏菌各酶活性与降解率之间的相关性分析,发现咪唑乙烟酸的降解率与脲酶活性呈高度负相关,与蔗糖酶活性呈高度正相关,与过氧化氢酶、多酚氧化酶和纤维素酶活性相关性不显著,这与李德斌[23]的研究结果一致。同时进一步说明了脲酶和蔗糖酶在咪唑乙烟酸的降解中起到了较大的作用,为后续黏质沙雷氏菌降解农药除草剂提供了理论基础。
【参考文献】
[1]吴昊.咪唑乙烟酸对土壤微生物群落的影响及其降解的手性差异研究[D].杭州:浙江大学,2019.
WU H. The effects of imazethapyr on soil microbial community structure, and the chiral differences of degradation in soils[D]. Hangzhou: Zhejiang University, 2019.
[2]刘刚.咪唑乙烟酸和高效氟吡甲禾灵为黄河三角洲地区紫花苜蓿田较为理想的除草剂品种[J].农药市场信息,2017, 32(19):51.
LIU G. Imazethapyr and high-efficiency floropyrin are ideal herbicides in alfalfa fields in the Yellow River Delta [J]. Pesticide Market Information, 2017, 32 (19): 51.
[3]林长福,高爽,杨玉廷,等.紫花苜蓿田除草剂的选择与应用[J].现代农药,2005,4(5):31-33.
LIN C F, GAO S, YANG Y T, et al. Selection and use of herbicides for alfalfa[J]. Modern Agrochemicals, 2005, 4(5): 31-33.
[4]ZHANG W Q, LINSCOMBE S D, WEBSTER E, et al. Risk assessment of the transfer of imazethapyr herbicide tolerance from Clearfield rice to red rice (Oryza sativa)[J]. Euphytica, 2006, 152(1): 75-86.
[5]CASIDA J E. Hayes' handbook of pesticide toxicology[M]. USA: Academic Press, 2010.
[6]赵炎,陈晨,韩亮,等.微生物降解磺隆类除草剂的研究进展[J].湖北农业科学,2017,56(23):4443-4446.
ZHAO Y, CHEN C, HAN L, et al. The research progress of microbial degradation of sulfonylurea herbicide[J]. Hubei Agricultural Sciences, 2017, 56(23): 4443-4446.
[7]王贝贝.粘质沙雷氏菌膜结合葡萄糖酸脱氢酶的纯化、鉴定与表征[D].镇江:江苏大学,2019.
WANG B B. Membrane-bound gluconate dehydrogenase from Serratia marcescens: purification, identification and characterization[D]. Zhenjiang: Jiangsu University, 2019.
[8]陈晓通,袁淑博,张钲,等.一株高产几丁质酶的粘质沙雷氏菌筛选、鉴定及应用[J].绿色科技,2018,9(12):164-167.
CHEN X T, YUAN S B, ZHANG Z, et al. Screening, identification and application of a strain of Serratia marcescens with high chitinase production [J]. Journal of Green Science and Technology, 2018, 9(12): 164-167.
[9]邝凡.一株粘质沙雷氏菌(KH-001)对亚洲柑橘木虱若虫杀虫作用研究[D].赣州:赣南师范大学,2019.
KUANG F. Insecticidal effects of Asian Citrus psyllid nymph (Diaphorina citri kuwayama) on Serratia marcescens KH-001[D]. Ganzhou: Gannan Normal University, 2019.
[10]林康.粘质沙雷氏菌脂肪酶的应用、固定化及突变体研究[D].上海:华东理工大学,2012.
LIN K. Application, immobilization and mutagenesis of recombinant Serratia marcescens lipase[D]. Shanghai: East China University of Science and Technology, 2012.
[11]张帅,卢磊,王靖瑶,等.粘质沙雷氏菌在免疫调节及抗肿瘤方面的应用[J].黑龍江医药,2015,28(4):718-720.
ZHANG S, LU L, WANG J Y, et al. Application of Serratia marcescens in immunomodulatory and anti-tumor[J]. Heilongjiang Medicine Journal, 2015, 28(4): 718-720.
[12]马海燕.粘质沙雷氏菌对花生连作土壤的修复及其高产灵菌红素的研究[D]. 南京:南京师范大学,2015.
MA H Y. Study on remediation of continuous cropping soil of peanut by Serratia marcescens and its high production of lycopene [D]. Nanjing :Nanjing Normal University, 2015.
[13]孟卓妮.油脂降解菌的筛选及生物法降解油脂的初步研究[D].贵阳:贵州大学,2019.
MENG Z N. Screening of oil-degradation strains and preliminary study on biodegradation of oil wastewater[D]. Guiyang: Guizhou University, 2019.
[14]李岩,蒋继志,刘翠芳.微生物降解农药研究的新进展[J].生物学杂志,2007,24(2):59-62
LI Y, JIANG J Z, LIU C F. New progress in microbial degradation of pesticides[J]. Journal of Biology, 2007, 24(2): 59-62.
[15]关松荫.土壤酶与土壤肥力[J].土壤通报,1980,11(6):40-41.
GUAN S Y. Soil enzyme and soil fertility[J]. Soil Bulletin, 1980, 11(6): 40-41.
[16]关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
GUAN S Y. Soil enzyme and its research method[M]. Beijing: Agricultural Press, 1986.
[17]周礼恺.土壤酶学[M].北京:科学出版社,1987.
ZHOU L K. Soil enzymology[M]. Beijing: Science Press, 1987.
[18]刘莉莉,林匡飞,苏爱华,等.四溴双酚A对土壤酶活性的影响[J].环境污染与防治,2008,30(6):13-16.
LIU L L, LIN K F, SU A H, et al. Effects of tetrabromobisphenol A on soil enzyme activities[J]. Environmental Pollution and Control, 2008, 30(6): 13-16.
[19]张爱梅,殷一然,齐汝楠.产纤维素酶沙棘根瘤内生放线菌的筛选、鉴定及其酶活性测定[J].西北师范大学学报(自然科学版),2019,55(5):71-76.
ZHANG A M, YIN Y R, QI R N. Screening, identification and enzyme activity of endophytic actinomycetes producing cellulase from root nodules of Hippophae rhamnoides[J]. Journal of Northwest Normal University (Natural Science), 2019, 55(5): 71-76.
[20]靳颖华.液相色谱法测定燕窝中唾液酸含量研究[J].中国医药导刊,2011,13(6):1071-1072.
JIN Y H. Determination of sialic acid in birds nest by liquid chromatography[J]. China Journal of Medicine, 2011, 13(6): 1071-1072.
[21]郭曉青,王秀娟,孙爱丽,等.环境中拟除虫菊酯类农药微生物降解技术研究进展[J].中国生物工程杂志,2017,37(5):126-132.
GUO X Q, WANG X J, SUN A L, et al. Advances in microbial degradation of pyrethroid pesticides in the environment [J]. Chinese Journal of Biological Engineering, 2017, 37(5): 126-132.
[22]卢美名,尹雯悦,刘传龙,等.除草剂微生物降解的研究进展[J].湖北农业科学,2019,58(3):5-8.
LU M M, YIN W Y, LIU C L, et al. Research progress on microbial degradation of herbicides[J]. Hubei Agricultural Sciences, 2019, 58(3): 5-8.
[23]李德斌.氯嘧磺隆降解及其对土壤微生态影响的研究[D].哈尔滨:东北林业大学,2012.
LI D B. Study on the degradation of chlorosulfuron and its effect on soil microecology[D]. Harbin: Northeast Forestry University, 2012.
