红茶菌中细菌纤维素产生菌的筛选、鉴定及其发酵动力学模型构建
2021-04-01余瞻赵福权徐成龙王珍珍张泽鑫沙如意毛建卫
余瞻,赵福权,徐成龙,王珍珍,张泽鑫,沙如意*,毛建卫,2*
1(浙江科技学院 生物与化学工程学院,浙江省农产品化学与生物加工技术重点实验室,浙江省农业生物资源生化制造协同中心, 浙江 杭州,310023)2(浙江工业职业技术学院,浙江 绍兴,312000)
细菌纤维素(bacterial cellulose,BC)是由微生物合成的天然生物纳米高聚物,因其具有高结晶度、高聚合度,强亲水持水能力,较高的生物相容性、适应性和良好的生物可降解性[1-2],黏稠性、凝胶性、稳定性和完全不被人体消化[3]等特点而被广泛应用于食品工业中,如以椰子水为原料发酵而成的椰果[4],代替肥肉制备低热量发酵肉肠[5],作为食品添加剂添加进酸奶[6]及冰淇凌中[7]等。同时作为一种膳食纤维,BC是由美国食品药品监督管理局公认的安全食品添加剂[8]。目前限制BC广泛应用的主要因素在其产量低、生产成本高等方面。要实现BC的工业化生产,寻找合适的产生菌和产量的提高显得至关重要。
产BC的菌属有醋酸杆菌属、根瘤菌属、八叠球菌属、假单胞菌属、固氮菌属、气杆菌属和产碱菌属等[9-10],但其中真正能应用于工业化生产的菌种却很少。赵航等[11]和尹园等[12]分别利用葡糖醋杆菌J2-1和居间驹形氏杆菌进行发酵,通过对发酵培养基中碳源、氮源、乙醇、有机酸及无机盐的优化,使得细菌纤维素产量得到有效提高,分别达到9.34和15.68 g/L。红茶菌[13-14]是获得高产BC菌种的良好来源。它是一种由糖茶水经酵母、醋酸菌以及少量的乳酸菌的共生菌群发酵而成的茶饮料,在中国已有100多年的使用历史。尽管目前已有一些利用红茶菌选育优良菌株的研究[15-16],但BC的产量仍无法满足工业化生产的需求。因此本研究以红茶菌发酵液中各菌种为研究对象,经筛选、分离、鉴定,获得BC产生菌株,并对该菌株发酵过程中的菌体生长、产物生成及底物消耗动力学模型进行构建和研究,分析发酵过程中各指标动态变化,为BC发酵工艺优化及其工业化生产提供一定的技术支持和理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
红茶菌,由浙江省农产品化学与生物加工技术重点实验室提供;蔗糖、琼脂、蛋白胨、葡萄糖、NaOH、MgSO4、K2HPO4,国药集团化学试剂有限公司;乙醇,上海凌峰化学试剂有限公司;酵母浸粉,北京奥博星生物技术有限责任公司;冰醋酸、制霉菌素,上海阿拉丁生化科技股份有限公司。
1.1.2 培养基
富集培养基:葡萄糖2 g,酵母浸粉0.5 g,蛋白胨0.5 g,柠檬酸0.1 g,MgSO40.5 g,制霉菌素500单位/L,水100 mL,pH 6.0。
分离培养基:葡萄糖2 g,酵母浸粉0.5 g,蛋白胨0.5 g,K2HPO40.1 g,醋酸0.15 mL,琼脂2 g,水100 mL,pH 5.0。
发酵液体培养基:葡萄糖2 g,酵母浸粉1 g,MgSO41 g,K2HPO40.1 g,无水乙醇3 mL,水100 mL。
发酵固体培养基:葡萄糖2 g,酵母浸粉1 g,MgSO41 g,K2HPO40.1 g,无水乙醇3 mL,琼脂2 g,水100 mL。
种子培养基:葡萄糖1 g,酵母浸粉1 g,无水乙醇3 mL,水100 mL,pH 6.0。
以上培养基均121 ℃灭菌15 min;无水乙醇均在各培养基灭菌后,无菌条件下进行添加。
1.2 仪器与设备
GZX-9140MBE电热鼓风干燥箱、YXQ-LS-75SII立式压力蒸汽灭菌器,上海博讯实业有限公司;Allegra X-12R冷冻离心机,美国贝克曼库尔特有限公司;EM-1011电子显微镜,日本电子公司。
1.3 试验方法
1.3.1 产细菌纤维素菌株的筛选
将红茶菌接于富集培养基中,30 ℃、160 r/min,摇床培养24 h。随后准确移取100 μL梯度稀释后的菌液至分离培养基中涂布分离[17]。挑选分离培养基平板上生长较好的单菌落,于发酵液体培养基中30 ℃培养,观察并挑选出具有菌膜的菌株即为BC生产菌株。将筛选所得菌株按1%的接种量接种于液体发酵培养基中,每组3个平行,30 ℃培养箱中培养4 d,取出BC膜,经过0.1 mol/L的NaOH溶液处理后,烘干称量挑选产量高且遗传性状稳定的菌株,保存于4 ℃冰箱中备用。
1.3.2 菌种鉴定
1.3.2.1 形态及生理生化特征鉴定
将挑选出的菌株分别同时接种于发酵固体培养基和液体培养基中,30 ℃恒温培养72 h,记录菌落大小、形状、颜色、液面是否有菌醭或菌岛,底层是否有沉淀等。对菌种进行革兰氏染色,于显微镜下观察细菌的形态,记录菌体大小、形状、繁殖方式等。
根据《伯杰氏细菌鉴定手册》[18]和《常见细菌系统鉴定手册》[19]进行生理生化特征检测,主要包括:色素实验、生酮实验、唯一氮源实验、产5-酮基葡萄糖酸盐、运动性实验、高糖实验、乙醇生长实验、产醋酸定性试验、氧化乙酸实验以及产BC试验等。
1.3.2.2 分子生物学鉴定
对挑选出的菌株进行16S rDNA序列检测(委托生工生物工程(上海)股份有限公司),将菌株测序的序列提交至美国国立生物技术信息中心(national center for biotechnology information, NCBI)Genbank数据库,采用基本检索工具进行同源性序列比对相似性分析,并利用分子进化遗传分析软件MEGA 8.0构建16S rDNA基因的系统发育树,采用邻接(neighbor-joining, NJ)法进行菌株16S rDNA基因分析,以确定菌株种属。
1.3.3 细菌纤维素的发酵制备
将筛选所得菌株接种至种子培养基中,30 ℃、150 r/min恒温活化培养24 h。随后将活化后的种子液以6%接种量接入发酵培养基中,30 ℃恒温静置培养14 d获得BC膜,每隔24 h取样测量菌体浓度、还原糖含量以及BC产量并记录。每个菌株做3个平行。
1.3.4 菌体浓度的测定
在培养基(培养14 d)中加入2 mL在0.1 mol/L的醋酸钾-醋酸缓冲液中活化完全的纤维素酶溶液(100 IU/g),于50 ℃,pH 5.0的条件下充分水解 2 h。取适量稀释后水解液在610 nm波长下测量菌体浓度OD610。
1.3.5 还原糖含量的测定
使用DNS法[20]测定发酵液中还原糖含量。
1.3.6 细菌纤维素产量的测定[21]
将BC膜取出水洗后,置于0.1 mol/L的NaOH溶液溶液中,100 ℃水浴30 min以除去残余的培养基和细菌残骸,用纯水反复洗涤或浸泡直至中性,得到白色透明状的BC膜。将膜置于烘箱中105 ℃烘干至恒重,称量记录。
1.3.7 发酵动力学模型的建立
利用Origin 8.0 软件对BC发酵过程中菌体生长、产物生成以及底物消耗的实验数据进行拟合分析,分别建立菌体生长模型、产物生成模型以及底物消耗动力学模型。
1.3.7.1 菌体生长动力学模型
选用Logistic方程模拟菌体生长趋势,建立菌体生长模型。菌体生长模型的微分表达式如公式(1)所示:
(1)
公式(1)积分可得公式(2):
(2)
式中:X0为菌体初始生物量,OD值;Xm为菌体最大生物量,OD值;X为t时刻的菌体生物量,OD值;μm为最大比生长速率,h-1;t为发酵时间,d。
将公式(2)积分变形得到公式(3):
(3)
1.3.7.2 产物生成动力学模型
选取Luedeking-Piret方程[30]来描述BC产物的生成模型,如公式(4)所示:
(4)
式中:P为产物浓度,g/L;X为菌体生物量,OD值;t为发酵时间,d;α为与菌体生长有关的合成常数;β为与菌体量有关的合成常数。
将公式(1)、(2)代入公式(4)式并积分得公式(5):
(5)
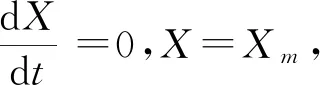
(6)
1.3.7.3 底物消耗动力学模型
底物消耗的模型表达式如公式(7)所示:
(7)
式中:S为底物浓度,g/100mL;YX/S为菌体对底物的得率系数;YP/S为产物对底物的得率系数;m为细胞维持系数;t为时间,d。
将公式(4)代入公式(7)可得公式(8):
(8)

(9)
(10)
分别将公式(1)、(2)代入公式(9)并积分可得
S=S0-k1C(t)-k2D(t),即如公式(11)所示:
(11)
2 结果与分析
2.1 分离菌株的形态特征观察
采用涂布分离法分离得到5株BC生产菌株,将它们分别命名为C1、C2、C3、C4、C5,并在相同的条件下进行发酵培养,形态特征和产BC的能力如表1所示。5株菌均为白色圆形菌落,菌落光滑不透明且边缘整齐,微凸黏稠,无沉淀和菌醭,在培养特征以及细胞形态学特征上并无明显差别,初步判定为同一菌属。5株菌发酵4 d后都具有比较良好的BC的产量,其中C1菌株产量最高。进一步对C1菌株进行电镜观察,如图1所示,C1菌体表面光滑,呈近似棒状,菌体之间有丝状物连接,符合产纤维类杆菌菌细胞及形态的特征。

表1 分离菌株细菌纤维素产量及形态特征观察Table 1 Morphological characteristics and the production of bacteria cellulose of the isolated strains

图1 C1电镜观察图Fig.1 Electron microscope picture of C1
2.2 菌株生理生化特征
从5株菌中挑选BC产量最高的C1进一步进行鉴定实验。对C1进行生理生化鉴定的实验结果如表2所示。该菌株产生5-酮基葡萄糖酸盐;没有生酮作用;不能氧化利用乙酸;不产生褐色素;能在乙醇中生长;不利用硫酸铵作为唯一氮源,即不属于氮源自养型微生物;不具有鞭毛,不具有运动性;能产生醋酸;在高糖环境下不能生存;革兰氏染色呈阴性。将实验所得结果与《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》对比,得出该菌株为醋酸菌属。

表2 菌株生理生化试验结果Table 2 Physiological and biochemical test results of strains
2.3 分子生物学鉴定
利用ITS1和ITS4、NS1和NS6两对引物扩增供试菌16S rDNA近5′端的区域,得到约600、1 300 bp片段,供试菌的内转录间隔区1和2、16S rDNA电泳结果见图2。将该菌序列结果在GenBank数据库进行比对,同源菌株基因用MEGA 8软件处理,得到系统进化树如图3所示,C1与木糖驹形氏杆菌(Komagataeibacterxylinus)在同一分支且具有极高同源相似性。结合菌株C1形态学特征分析,将菌株C1鉴定为木糖驹形氏杆菌。

图2 供试菌的内转录间隔区1和2、16S rDNA凝胶电泳图Fig.2 The internal transcribed spacers 1 and 2 and 16S rDNA gel electrophoresis of the tested bacteria

图3 C1菌株系统进化树分析Fig.3 Phylogenetic tree analysis of C1
2.4 细菌纤维素发酵过程中各参数的变化
糖驹形氏杆菌发酵过程中pH、菌体浓度、BC产量以及还原糖消耗量变化如图4所示。
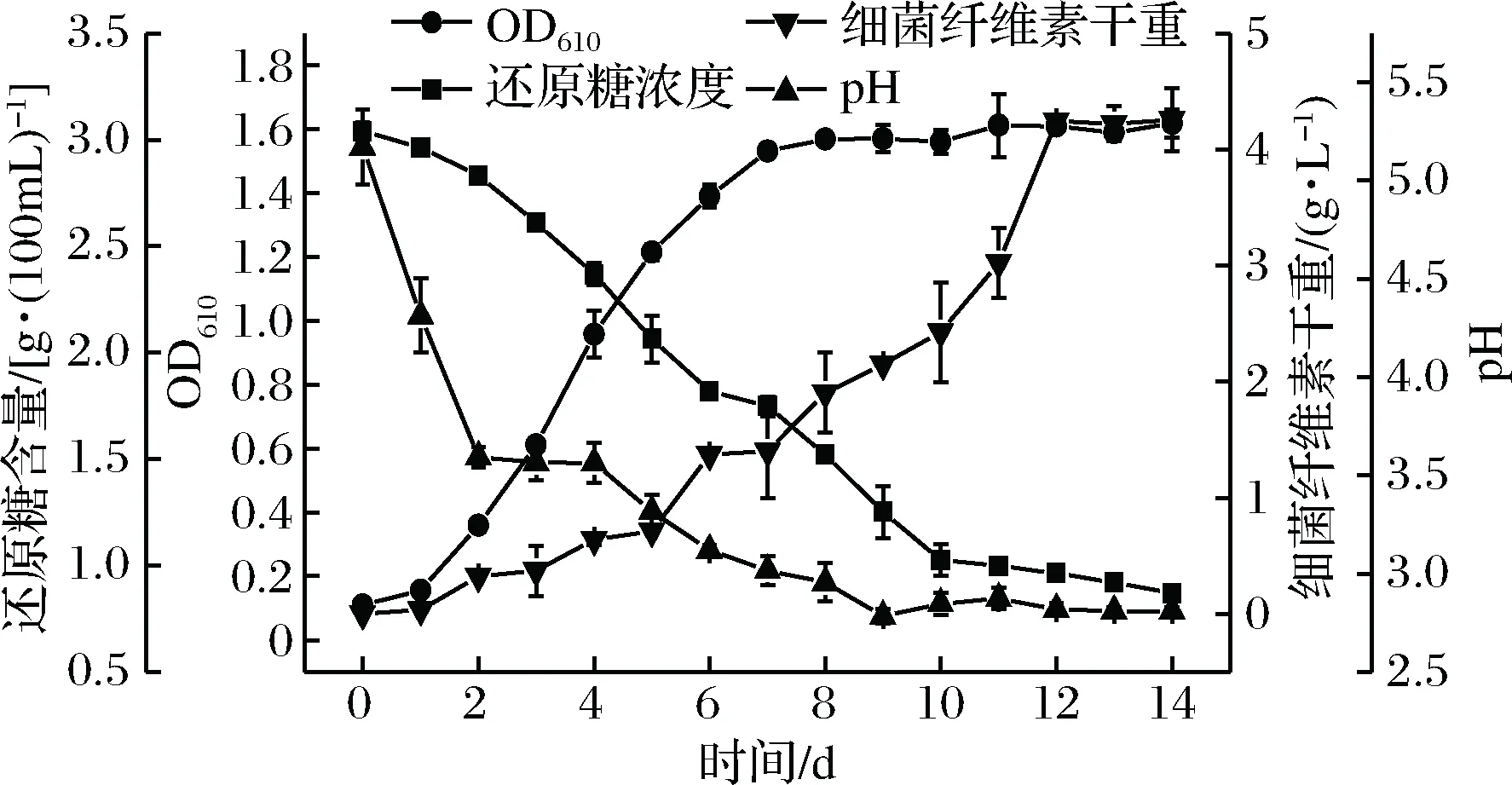
图4 细菌纤维素发酵过程中各参数变化Fig.4 Changes of various parameters during bacteria cellulose fermentation
由图4可知,木糖驹形氏杆菌的菌体生长总体呈现S型曲线,在1~7 d处于对数生长期,7 d之后趋于平缓进入平稳期。同时随着菌体浓度上升,BC的产量同样呈现上升趋势,还原糖含量和pH值呈下降趋势;当菌体进入稳定期后,BC生成速率大幅提高,还原糖的消耗速率以及pH值的变化逐渐趋势平缓。发酵初期菌种生长代谢旺盛,大量产酸,导致pH快速下降;而随着发酵过程的继续推进,菌体生长逐渐进入稳定期,菌种少量产酸甚至不产酸,pH也相应的缓慢下降至稳定。发酵第14天产BC达到最高产量4.26 g/L。从实验结果中可以看出在BC的发酵过程中还原糖的消耗主要被用于菌体的生长,而BC在发酵初期随着菌体的生长而缓慢合成,其合成速率主要取决于菌体浓度的多少。木糖驹形氏杆菌产BC的发酵过程属于部分生长偶联型,这与察可文等[22]认为的BC生成与菌体细胞的生长以及细胞的浓度均有相关性相一致。而邵伟等[23],齐香君等[24]通过对木醋杆菌发酵产BC过程中各参数进行监测,根据相同时间内BC干重的变化趋势与菌体生长趋势相似,推测BC的生成与细胞的生长呈相关关系,BC是细胞代谢的产物,BC的发酵过程属于生长偶联型。这主要是由利用的菌种和培养条件差异所致。
2.5 发酵动力学模型构建
2.5.1 菌体生长动力学模型
Monod模型是最早应用于菌体生长的模型,但是该模型把限制性底物的浓度作为影响菌体生长过程中比生长速率的唯一因素,具有较大的局限性。Logistic模型则是一个典型的S型曲线,在符合菌体生长趋势的同时[25-26],也能够较好地反映菌体自身生长而表现出对自己的抑制作用[27]。根据实验结果显示,木糖驹形氏杆菌的生长同样呈现S型,因而选用Logistic模型来描述菌体的生长。
将X0=0.109,Xm=1.618,μm=0.791代入公式(2)得到菌体的生长动力学模型:
菌体的生长动力学模型拟合曲线如图5所示,相关系数R2=0.998,说明该方程的实验值与预测值拟合良好,可以以此描述BC生长控制的模型。
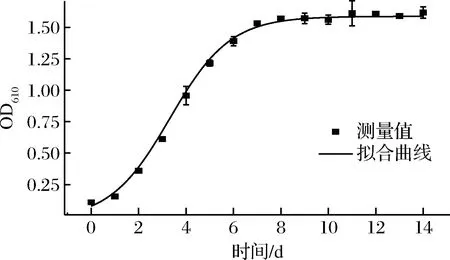
图5 菌体生长动力学模型拟合曲线Fig.5 The fitting curve of kinetic model of bacterial growth
2.5.2 产物生成模型
在分批发酵过程中,产物的生成与菌体生长的关系分为3种:生长偶联型、非生长偶联型和部分生长偶联型[28-29]。根据前述实验结果所示,BC的产量在菌体对数生长期和稳定期均持续上升,说明BC的合成与细菌的生长及其菌体浓度均具有相关性,属于部分生长偶联型。因而选取Luedeking-Piret方程[30]来描述BC的产物生成。

将X0=0.109,Xm=1.618,μm=0.791及β,α代入公式(5)得到BC产物生成的数学模型:

BC生产量的拟合曲线如图6所示,相关系数R2=0.958 9,结果表明理论值与实验值拟合良好,该方程能够较好地描述发酵过程中BC产物的生成情况。

图6 产物生成模型拟合曲线Fig.6 The fitting curve of product generation model
2.5.3 底物消耗模型
一般认为在发酵过程中,限制性底物的消耗主要分为3个部分:菌体生长、产物合成以及细胞维持正常生命活动的消耗[31]。因而底物消耗模型由产物生成及菌体生长模型结合得出。
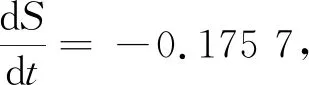
随后以S-S0-k2D(t)~C(t)作图,拟合后得到:S-S0-k2D(t)=-0.328 2C(t)-0.041 9,由此可得k1=0.328 2。将X0=0.109,Xm=1.618,μm=0.791及k1,k2代入公式(11),得到葡萄糖底物消耗的数学模型:
-0.222 12×ln(0.932 63+0.067 37e0.791t)
葡萄糖底物消耗的拟合曲线如图7所示,相关系数R2=0.962 3,说明该方程与实验测量值拟合较好,能够以此方程为参考描述发酵过程中葡萄糖底物的消耗情况。

图7 底物消耗模型拟合曲线Fig.7 The fitting curve of kinetic model of substrate consumption
3 结论
通过对红茶菌中菌种进行筛选,获得5株产BC菌株C1、C2、C3、C4、C5,随后对这5株菌进行形态学观察,初步判定为同一菌属,符合产纤维类醋酸菌细胞及形态特征。随后通过生理生化实验以及16S rDNA序列分析将BC产量较高的菌株C1鉴定为木糖驹形氏杆菌。
以筛选所得木糖驹形氏杆菌为出发菌株发酵制备BC,监测发酵过程中各指标的变化,分别构建发酵产BC的菌体生长、产物生成以及底物消耗动力学模型。结果表明木糖驹形氏杆菌发酵14 d产BC最高产量为4.26 g/L,产量良好,具有进一步的应用价值,BC的发酵合成属于部分生长偶联型。构建的3个模型相关系数R2分别为0.998、0.958 9和0.962 3,说明实验值与模型拟合良好,能可靠地描述发酵制备BC过程中各参数变化,为BC产量的提升以及进一步工业生产提供技术支持与理论指导。后续研究中可根据发酵动力学模型对BC发酵过程进行精准调控如,建立流加发酵工艺等,以进一步提高细菌菌纤维素的产量。
