黄芩苷对高脂诱导HepG2细胞脂肪沉积及SIRT1相关因子表达的影响
2021-03-31李娟张中乐吴嘉珍沈红艺
李娟,张中乐,吴嘉珍,沈红艺
(1.上海中医药大学公共健康学院,上海 201203;2.上海市第一人民医院嘉定分院,上海 201203)
非酒精性脂肪肝病(NAFLD)是指在没有大量饮酒或其他继发性脂肪肝原因下出现肝脂肪变性[1],其特征是肝脏脂肪积累的增加,涵盖了非酒精性单纯性脂肪肝(NAFL)、非酒精性脂肪肝炎(NASH)及其相关肝硬化、肝衰竭或肝癌[2]。NAFLD的发病率随肥胖的增加而增加,肝脏游离脂肪酸(FFA)的增加是NAFLD发病机制的核心[3]。
沉默信息调节因子1(SIRT1)是Sirtuins家族的一员,研究表明SIRT1可以抑制脂肪从头合成相关的转录因子碳水化合物应答元件结合蛋白(ChREBP)、胆固醇调节元件结合蛋白-1c(SREBP-1c)的表达;脂肪酸合成酶(FAS)是SREBP-1c的下游靶标,也是FFA合成的关键酶,当SREBP-1c被SIRT1抑制后,FAS的表达也会下降,从而减少新生脂肪的合成[4-6]。黄芩苷(BA)是从黄芩干燥根中提取的黄酮类化合物,现代药理学研究表明黄芩苷具有调节血脂、抗炎、抗氧化、免疫调节等作用[7-9]。本实验通过体外诱导肝脏脂肪沉积模型,探讨黄芩苷对肝脏脂肪沉积以及SIRT1相关因子表达的影响。
1 材料和方法
1.1 细胞、药物和试剂
HepG2细胞由中国科学院院上海生命科学研究院细胞库提供;黄芩苷(wkq18013013)购自四川维克奇生物科技有限公司(纯度大于98%);胎牛血清(FBS)、高糖型DMEM、胰酶、PBS购自Gibco公司;DMSO、油酸(OA)、棕榈酸(PA)、油红O购自Sigma公司;双抗(青链霉素)购自HyClone公司;细胞培养板、冻存管购自Corning公司;CCK-8试剂盒购自东仁化学科技(上海)有限公司;甘油三酯(TG)测定试剂盒购自南京建成生物工程研究所;IL-6、TNF-α酶联免疫分析试剂盒购自武汉贝莱茵生物科技有限公司;SIRT1(ab110304)、SREBP-1c(ab3259)、ChREBP(ab92809)和FAS(ab133619)抗体购自Abcam公司;β-action(NM_001101)抗体购自上海拓然生物科技有限公司;山羊抗兔(ARG65351)、山羊抗鼠(ARG65350)IgG购自Arigo公司。
1.2 细胞培养
在DMEM培养基中加入10%FBS、1%双抗于37 ℃、5%CO2的细胞培养箱中培养HepG2细胞,待细胞生长密度达80%~90%时进行传代以及后续实验。
1.3 黄芩苷对HepG2细胞的毒性测定
将7组不同浓度的黄芩苷(25、50、100、200、400、800、1 000 μmol/L)分别作用于HepG2细胞24、48、72 h,采用CCK-8法检测这3个时间点的细胞生存率。
1.4 模型建立及分组
HepG2细胞以1×106个/孔接种于6孔板中,贴壁孵育24 h后,分别加入0、0.25、0.50、0.75、1.00、1.25 mmol/L FFA继续孵育24 h,油红O染色观察细胞内脂肪沉积以及GPO-PAP法测定细胞内TG的浓度。根据不同的处理将细胞分为5组:正常对照组、模型组(0.75 mmol/L FFA)、低剂量黄芩苷组(0.75 mmol/L FFA+50 μmol/L BA)、中剂量黄芩苷组(0.75 mmol/L FFA+100 μmol/L BA)、高剂量黄芩苷组(0.75 mmol/L FFA+200 μmol/L BA)。首先取对数生长期的HepG2细胞以接种于培养皿中,贴壁孵育24 h后,在模型组和药物组中加入0.75 mmol/L FFA(OA∶PA=2∶1)工作液孵育(对照组加入等量DMEM培养基预处理)24 h后,在药物组中加入相应浓度的BA、模型组中加入等量的DMEM,孵育24 h。
1.5 HepG2细胞内TG测定
将HepG2细胞以1×106个/孔的密度接种于6孔板内,干预结束后收集细胞,制备细胞悬液,按试剂盒说明书提供的操作方法采用GPO-PAP法测定细胞内TG的浓度。
1.6 炎症因子TNF-α、IL-6检测
将HepG2细胞以1×106个/孔接种于6孔板内,按实验分组对细胞进行诱导干预,采用ELISA法检测细胞上清液中的炎症因子IL-6和TNF-α的含量。
1.7 油红O染色
将0.5 g油红O粉末溶于100 mL异丙醇,配制成浓度为0.5%的油红O存储液;HepG2细胞干预结束后,弃去细胞培养液,加入4%的多聚甲醛固定1 h后加入60%异丙醇孵育5 min;稀释油红O存储液(去离子水∶油红O存储液=2∶3,滤膜过滤,避光静置10 min),染色30 min后冲洗,加入苏木精孵育1~3 min,冲洗,拍照。
1.8 HepG2细胞蛋白表达测定
采用Western blot法检测细胞内SIRT1、SREBP-1c、ChREBP、FAS的蛋白表达水平。HepG2细胞干预后,收集细胞提取总蛋白,取各组蛋白在SDS-PAGE胶中电泳分离各蛋白。转膜、封闭,加入一抗(1∶1 000~1∶5 000稀释抗体)孵育过夜,TBST清洗3次,每次10 min,加入1∶5 000稀释后的二抗,摇床孵育1 h,TBST清洗3次后采用化学发光进行显影,拍照,采用Image J进行蛋白半定量。
1.9 统计学分析
2 结果
2.1 黄芩苷对HepG2细胞生存率的影响
CCK-8结果显示:与空白组相比,当黄芩苷浓度高于200 μmol/L时,随干预时间的增加,黄芩苷对HepG2细胞生长具有抑制作用,差异具有统计学意义(P<0.05),因此,选择50、100、200 μmol/L作为药物干预浓度。见图1。
2.2 HepG2细胞脂肪沉积模型的建立
2.2.1 不同浓度FFA对HepG2脂肪沉积的影响 如图2所示,各组细胞经油红O染色后,光镜下观察发现:正常组细胞排列较为紧密,细胞质呈现轻微染色;0.25 mmol/L FFA组染色结果与正常组相近,未发现明显脂肪空泡,随着FFA浓度的增加,0.5~1.25 mmol/L FFA组细胞内出现不同程度的红色脂滴积聚,细胞质染色明显。

注:A.空白对照;B.0.25 mmol/L FFA组;C.0.5 mmol/L FFA组;D.0.75 mmol/L FFA组;E.1 mmol/L FFA组;F.1.25 mmol/L FFA组
TG结果显示,加入不同浓度FFA溶液干预24 h后,各组细胞内TG含量均呈上升趋势,0.25 mmol/L FFA组与空白组相比,差异无统计学意义(P>0.05),0.5 mmol/L FFA组及以上浓度组与空白组相比,细胞内TG含量均显著上升(P<0.05),见图3。
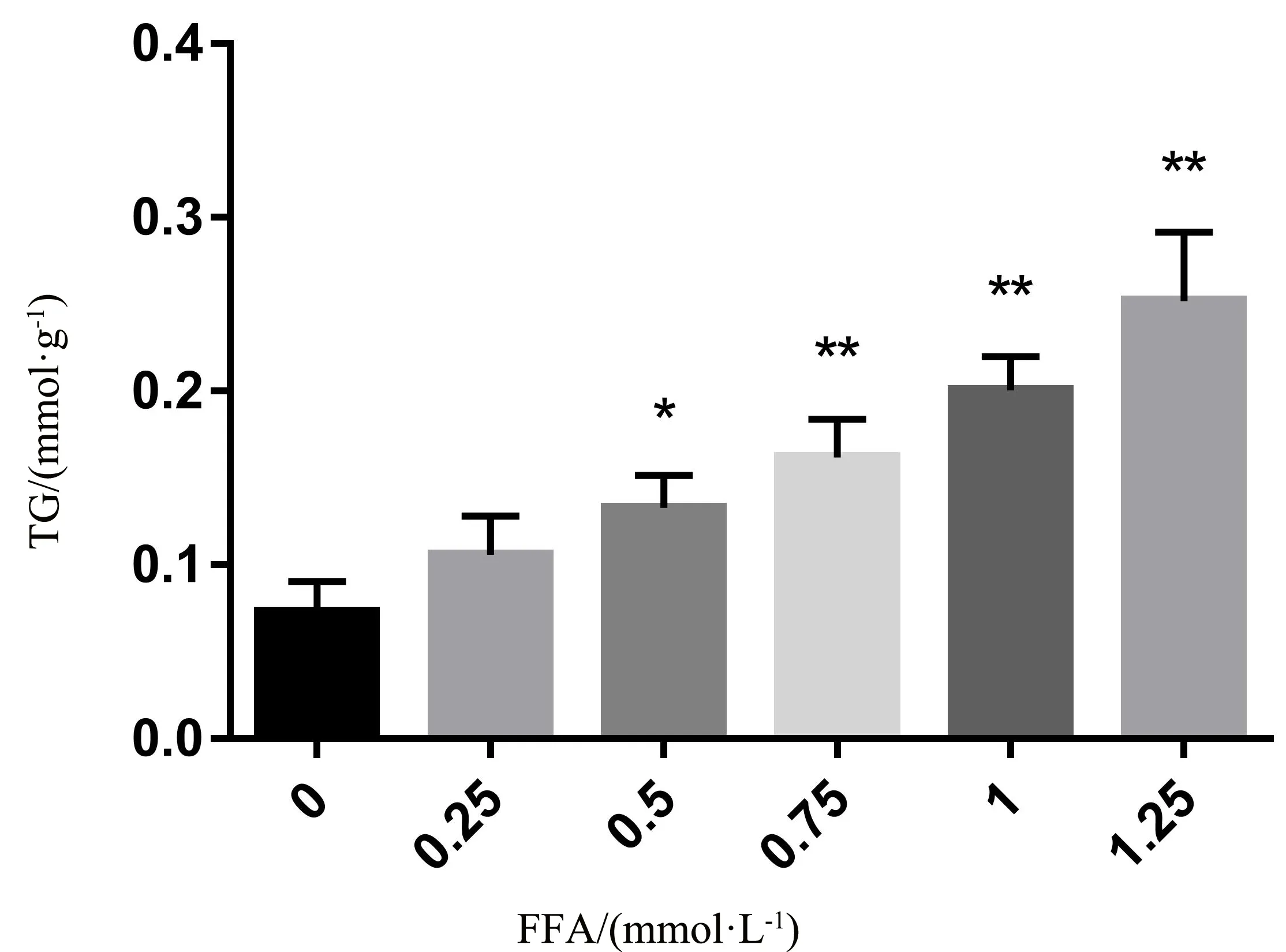
注:与空白组相比,
2.2.2 不同浓度FFA对HepG2细胞生存率的影响 CCK8结果见表1。因此选择0.75 mmol/L FFA诱导HepG2细胞建立脂肪沉积模型。

表1 不同浓度FFA诱导HepG2细胞生存率的比较
2.3 黄芩苷对FFA诱导HepG2细胞脂肪沉积的影响
如图2所示,各组细胞经油红O染色后,光镜下观察发现:正常组细胞排列紧密,细胞质呈现轻微染色;FFA干预后,模型组细胞内出现大量红色脂滴,细胞质染色明显;黄芩苷干预后,与模型组相比,细胞内红色脂滴随药物干预浓度的增加而减少,染色变浅。与正常组相比,模型组细胞内TG含量显著上升;中剂量黄芩苷组与高剂量黄芩苷组细胞内TG含量与模型组相比显著下降,差异具有统计学意义(P<0.05)。见图4~5。

A.正常组;B.模型组;C.低剂量黄芩苷;D.中剂量黄芩苷;E.高剂量黄芩苷

注:与空白组相比,△P<0.05;与模型组相比,*P<0.05。
2.4 黄芩苷对FFA诱导HepG2细胞上清液炎症因子IL-6、TNF-α水平的影响
与正常组相比,模型组细胞上清液TNF-α和IL-6水平呈上升趋势,黄芩苷干预后,随黄芩苷干预浓度的增加,细胞上清液TNF-α、IL-6的水平有所下降,各组间差异无统计学意义(P>0.05)。见表2。

表2 各组细胞上清液炎症因子IL-6、TNF-α水平的比较
2.5 黄芩苷对细胞内SIRT1、SREBP-1c、CHREBP、FAS蛋白表达的影响
SIRT1蛋白表达:与正常组相比,经FFA诱导的模型组细胞内SIRT1蛋白表达显著下降,差异具有统计学意义(P<0.05);与模型组相比,不同浓度黄芩苷(中剂量、高剂量组)干预后细胞内SIRT1蛋白表达明显上升(P<0.01)。SREBP-1c蛋白表达:与正常组相比,模型组细胞内SREBP-1c蛋白表达明显上升(P<0.05);与模型组相比,中、高剂量黄芩苷组细胞内SREBP1c蛋白表达明显下降,差异具有统计学意义(P<0.01)。ChREBP蛋白表达:与正常组相比,模型组细胞内ChREBP蛋白表达具有上升的趋势,差异不具有统计学意义(P>0.05);与模型组相比,不同浓度黄芩苷(50、100、200 μmol/L组)干预后,细胞内ChREBP蛋白表达显著下降,差异具有统计学意义(P<0.05~0.01)。FAS蛋白表达:与正常组相比,模型组细胞内FAS蛋白表达明显上升(P<0.05),与模型组相比,中、高剂量黄芩苷组细胞内FAS的蛋白表达明显下降(P<0.01),如图6所示。

注:A.正常组;B.模型组;C.低剂量黄芩苷;D.中剂量黄芩苷;E.高剂量黄芩苷。与空白组相比,△P<0.05;与模型组相比,
3 讨论
NAFLD疾病早期是由于TG在肝脏内过度积累而导致肝脏脂肪变性,非侵入性的FFA是评价NAFLD的重要指标[10]。研究表明饮食习惯、环境和遗传因素可导致胰岛素抵抗、肥胖伴脂肪细胞增殖和肠道微生物群的改变,可以引起的肝脏游离脂肪酸通量增加导致两种不同情况:TG的合成和积累以及脂肪酸、游离胆固醇和其他脂质代谢物的“有毒”水平导致线粒体氧化应激功能障碍产生活性氧(ROS)和内质网(ER)应激激活UPR,从而导致肝炎[11]。在此过程中涉及众多细胞因子的调节;乙酰辅酶A羧化酶、SREBP-1c、ChREBP是调节新生脂肪形成的关键因子;饮食中摄入的高浓度的脂肪、葡萄糖会激活肝脏中的SREBP-1c和ChREBP,继而激活下游因子FAS,FAS作为从头合成脂肪的关键酶,被激活后,会在肝脏中合成TG[12-13]。
SIRT1被誉为“人类长寿基因”,近年来对其在肝脏脂肪代谢相关领域的研究愈来愈受关注。研究表明,高脂饮食诱导会引起肝脏SIRT1蛋白表达减少,而SIRT1能够使SREBP-1c的去乙酰化增加,促使其泛素化和蛋白酶体降解,从而降低其稳定性和脂肪合成基因的比率,抑制肝脏脂肪合成[14-15]。
本研究通过FFA诱导HepG2细胞脂肪变性,建立体外肝脏脂肪沉积模型,用黄芩苷进行干预。通过油红O染色观察细胞中脂滴的状态,GPO-PAP酶法检测细胞内TG的含量,ELISA法测定细胞上清液中TNF-α、IL-6的水平以及Western blot法测定细胞中SIRT1、SREBP-1c、ChREBP和FAS的蛋白表达发现:游离脂肪酸可以显著增加细胞中TG的含量,抑制SIRT1、SREBP-1c以及FAS的表达。黄芩苷(中、高剂量组)干预后,可以减少HepG2细胞内脂滴的数量,降低TG的含量,抑制SREBP-1c、ChREBP和FAS的蛋白表达,促进SIRT1的蛋白表达,差异均具有统计学意义。说明黄芩苷具有明显的减脂作用,能有效改善肝脏脂肪沉积,其相关机制可能与黄芩苷通过促进肝脏细胞SIRT1的表达,抑制其下游因子SREBP-1c、ChREBP和FAS的激活,从而减少肝脏脂肪从头合成,减低肝脏脂肪的积累有关。而ELISA法检测细胞上清液中炎症因子TNF-α、IL-6的水平发现,各组细胞上清液中TNF-α和IL-6的水平无明显差别(P>0.05),这可能与高脂溶液诱导时间较短或者高脂溶液的浓度较低相关。
综上所述,研究发现黄芩苷能够改善FFA诱导的HepG2细胞脂肪沉积,降低细胞内TG的含量,其机制可能与上调SIRT1,下调ChREBP、SREBP-1c以及FAS有关,并且可能通过SIRT1/SREBP-1c通路发挥降脂作用。
