植物口服疫苗的研究进展
2021-03-30张俊霞王利
张俊霞 王利
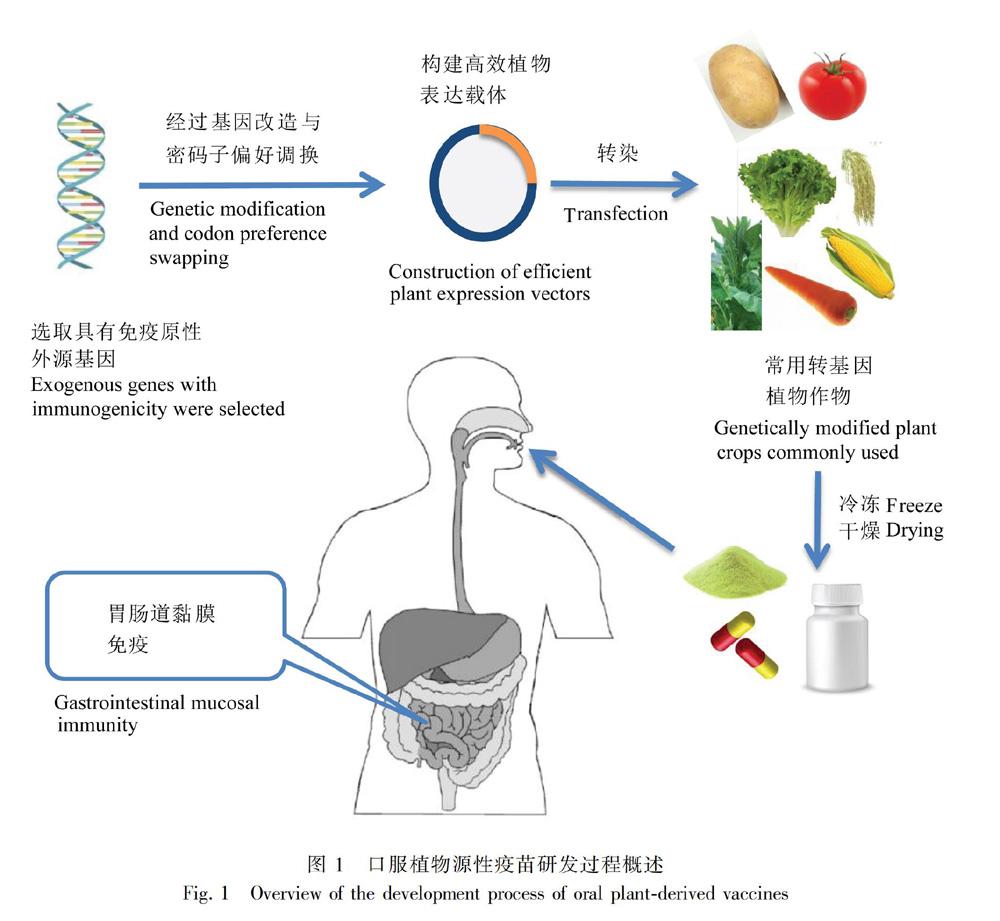
摘要:植物口服疫苗是通过转基因植物生产,通过口服的方式预防疾病的生物制品。作为一种新型疫苗,其研究开始于三十几年前。由于植物口服疫苗可以最大程度地降低传统疫苗的潜在风险,在疫苗生产中具有优势,因此拥有良好的商业生产前景。植物疫苗价格低廉,生产过程安全,可产生与注射疫苗相似效价效果,无论是在控制养殖业抗生素滥用的情况下作为替代方法,还是在某些经济发展水平不高、卫生条件较差的发展中国家用于预防和控制某些传染病,都是十分理想的。该文对植物口服疫苗生产方法、候选生物反应器、疫苗有效性、适用范围和发展前景进行了概述。此外,还着重对目前开展的植物口服疫苗在病毒、细菌、寄生虫引起的人畜共患病中的应用研究,以及其在人类肿瘤预防中所开展的应用研究进行了较为详细的综述。虽然植物疫苗的研究及应用在植物外源基因表达量、免疫剂量、免疫接种途径等方面还存在很多挑战,但依然为传统疫苗学的研发提供了一条充满希望的新途径。
关键词: 人畜共患病, 植物疫苗, 口服疫苗, 免疫
中图分类号:Q943.2
文献标识码:A
文章编号:10003142(2021)02031809
Abstract:Plant oral vaccines are biological productsproduced by genetically modified plants, and are taken orally to prevent disease. As a new kind of vaccine, its research originated about 30 years ago. Plant oral vaccines can avoid the potential risks of traditional vaccines to the greatest extent, and have advantages in vaccine production with good commercial production prospects. The price of plant vaccine is low, and the production is safety and effective. It is very ideal vaccine to prevent and control the certain infectious diseases, so as alternative to the breeding of antibiotics abuse cases, and suit for the low economic development areas, where have poor sanitation. In this review, the production methods, candidate bioreactors, vaccine effectiveness, application scope and development prospect of plant oral vaccine are summarized. In addition, the application of oral plantbased vaccines in zoonoses caused by viruses, bacteria or parasites, and the application in human tumor prevention are also reviewed in detail. Although there are challenges with plant vaccines in the amount of exogenous gene expression, immune dose, and immunization pathway and so on, plant vaccines still open up a promising new field for traditional vaccinology.
Key words: zoonosis, plant vaccines, oral vaccine, immune
人畜共患疾病日益成為公共卫生的重大威胁(Shahid et al., 2016),但针对人畜共患的病原体滥用抗生素,会造成病原体对抗生素的耐药性(Topp et al., 2016)。接种疫苗和注射抗体成为了优先选择,但家禽和水产类品种繁多,数量巨大,如何接种疫苗的难题很多(Joseph, 2018)。植物疫苗的概念涉及使用基因工程的植物细胞作为生产重组抗原的生物工厂,在理想情况下植物被作为口服疫苗输送的载体。在该概念被提出的三十年里,研究者不断尝试在各种模式植物中表达病原微生物以及肿瘤重组抗原。虽然在植物口服疫苗的研究中,由于目标的复杂性,使得植物疫苗存在一些需要攻克的缺陷,如植物生物量中抗原积累水平的提高,黏膜相关免疫系统的调控,转基因植物的稳定性等,但是植物疫苗依然为传统疫苗学开辟了一个充满希望的新领域。最近,SARSCoV2引起的肺炎以及在西非爆发的埃博拉病毒疾病使得公众的注意力集中在植物源药物上(Sack et al., 2015)。植物疫苗因其生产安全性、基础设施所需资本较少、易于扩大规模等优点而成为最佳选择(Topp et al., 2016)。植物来源的抗原无需纯化及加工,具有热稳定性、不受动物病原体或细菌外毒素污染等优点,无论是医用还是在家禽家畜养殖业作为药用,植物作为疫苗载体都十分理想(Clemente et al., 2014)。本文综述了植物口服疫苗在有效性方面的最新进展及其适用范围和发展前景。
1植物口服疫苗的有效性
近年来,随着遗传分子生物学和植物生物技术的发展,疫苗接种(如基因工程亚单位疫苗、活载体疫苗、核酸疫苗)项目正蓬勃发展,特别是利用转基因植物生产人类或动物治疗性疫苗的技术日益受到关注。植物疫苗是重组蛋白亚基疫苗。理想情况下,用于生产所选抗原的植物种类的选择应该允许口服可食用疫苗的形式。这些疫苗非常适用于有明确抗原候选的疾病和目前有些疫苗的生产或交付成本都令人望而却步的疾病。在蔬菜和水果中表达候选疫苗为生产口服疫苗开辟了新途径(Han et al., 2006)。由于一些产物聚集在可食用组织中,因此无需分离和纯化即可直接食用。到目前为止,许多转基因植物疫苗产品已经被研究和开发。
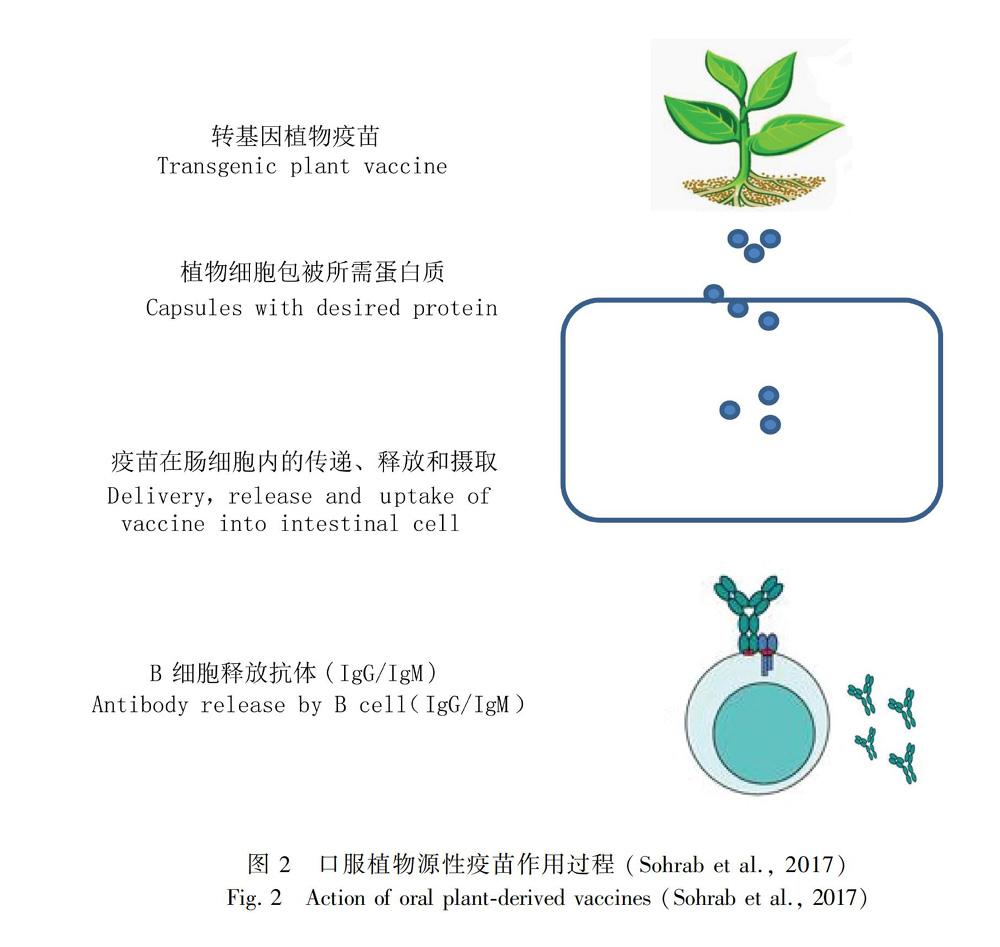
植物可以通过病毒载体的瞬时表达、叶绿体转化、靶向亚细胞结构和转录后基因沉默抑制子的使用来提高外源基因的表达(Topp et al., 2016)。植物口服疫苗因可以引起广泛的黏膜免疫而受到了许多关注,其没有注射针头的风险,也不会带来不必要的疼痛和不适,可以不经纯化或加工,直接给动物投喂或是供人类食用(Chan et al., 2015),它们对胃肠道的消化酶有一定的抵抗力(Kashima et al., 2016)。大肠杆菌不耐热肠毒素B亚单位(LTB)的表达首次证明了兽用相关抗原可在植物中产生,也首次证明了食用疫苗可通过肠道引起黏膜免疫(Rybicki, 2018; Edgar et al., 2020)。在转基因烟草或土豆中产生的LTB在特定检测中与大肠杆菌产生的蛋白在功能上相同,并具有免疫原性,用植物材料口服免疫小鼠可诱导系统和黏膜免疫产生抗体中和毒素。疫苗有效性的第一个证据是使用表达整个VP1的转基因拟南芥,在口服或非肠道接种表达VP1的转基因苜蓿提取物后,小鼠可以免受口蹄疫病毒的攻击(Macdonaild, 2018)。
多克隆动物血清抗体和鸡蛋产生的多克隆抗體具有抗体组成在批次之间变化的固有缺点,而植物可以生产特定的单克隆抗体,其结合效率、糖基化和组分等特征可以进行特殊的工程设计,以满足治疗需要。到目前为止,针对兽医病原体的各种工程抗体和抗体片段已经在植物叶片或种子中表达,包括scFv、VHHIgG、VHHIgA和分泌型IgA(Topp et al., 2016)。植物产生的蛋白质和治疗药物与真核生物中产生的重组蛋白质非常相似,以植物为基础的疫苗或治疗性蛋白可以进行翻译后修饰。可食用疫苗已被证明可以诱导粘膜和全身免疫(Sohrab et al., 2017)。携带SHBsAg的植物冻干剂作为抗乙肝病毒的口服强化疫苗效果很好(Pniewski et al., 2018)。动物研究表明,这些疫苗通过生物封装获得胃内消化酶的保护,使其不被降解,经免疫后可对病原体产生保护性免疫反应。当动物食用可食用疫苗形式的转基因种子、果实或块茎时,会产生黏膜特异性抗体和血清特异性抗体。虽然最适合食用疫苗的植物是蔬菜和水果,如土豆、西红柿、胡萝卜、玉米、香蕉、生菜、烟草、大米和大豆,但是鲜果和蔬菜的抗原量很难控制,因此可以将植物材料冻干以控制剂量(Shahid et al., 2016)。针对流感、结核病、呼吸道合胞病毒、肺炎、炭疽和哮喘的几种候选疫苗经过临床前和临床评估,取得了良好的效果。总之,植物疫苗的目的是将感兴趣的基因转化到植物中,在植物产品中表达特定的抗原,供人类或动物食用。因此,植物可以作为生产可食用疫苗的生物反应器或生物工厂(Shakoor et al., 2019)。
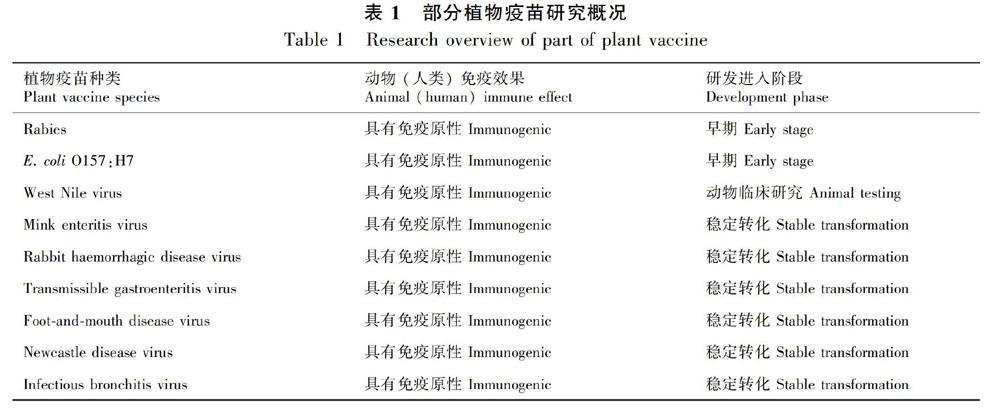
一旦选择的抗原在植物反应器中高水平表达,就可采用适当的加工技术来生产最终的疫苗。但是,必须通过适当的动物安全和有效性试验对候选疫苗进行评估(表1)。如果疫苗是用于人体,它就要进入临床试验阶段,还必须评估储存和分发期间的长期稳定性。
对于许多牲畜疾病,目前没有合适的候选疫苗,部分原因是疫苗开发的成本太高。在这些情况下,基于植物的疫苗生产是开发具有低成本效益疫苗的另一种方法。以植物为基础的可食用疫苗特别适合于给注射非常困难和费时的动物(如水生物种)接种。
2植物口服疫苗的适用范围
植物、微藻、酵母和细菌是研究的重点探索对象,在粮食作物和非粮食作物中,烟草已经成功被用于多种抗原的表达和免疫学评估。除植物以外,丝状真菌也是能够便捷产生重组蛋白的系统之一,但针对丝状真菌目前的研究仍然不多(Reyes et al., 2019)。其中,植物多糖作为佐剂和疫苗输送载体,可以通过与抗原提呈细胞(APC)表达的模式识别受体(PRRs)结合来增强体液和细胞免疫并发挥佐剂活性,因为其具有受体识别的病原相关分子模式(PAMPs),所以基于植物多糖的化合物有能力通过APC刺激随后的T细胞反应来增强抗原的处理和呈递,在对抗肠道疾病方面具有重要意义(Reyes et al., 2019)。
目前有文献记载的植物性口服疫苗有针对如下疾病的:反刍动物的志贺菌植物性口服疫苗(Miletic et al., 2015)、乙肝植物口服疫苗(Pyrski et al., 2019; Young et al., 2016)、囊虫病植物口服型疫苗(Edda et al., 2018),通过水稻表达的霍乱口服疫苗(Kashima et al., 2016)、针对家禽(主要是鸡)的坏死性肠炎疫苗(Joseph, 2018)和呼肠孤病毒疫苗(Chang & Liu, 2018)、在植物中表达的HIV抗体(Orellana et al., 2015)、对小鼠有免疫作用的抗弓形虫疫苗(Merlin et al., 2017)、可以提升鱼类免疫参数的玉米黑穗病CTB口服疫苗(Reyes et al., 2019)。已在实验室动物模型中测试的候选疫苗包括针对大肠杆菌、沙门氏菌、鼠疫耶尔森氏菌、口蹄疫病毒、兔出血症病毒、兔和犬及牛乳头瘤病、水貂肠炎和猪圆环病毒以及蓝舌病毒等(Rybicki, 2018)。
2.1 病毒性疾病
植物细胞可用作表达亚单位疫苗的宿主,该亚单位疫苗既可用作口服制剂,也可用作非肠道制剂。就安全性和接受性而言,口服制剂是最具吸引力的免疫方法。植物细胞也可以在纯化程序后用作非肠道制剂,植物制成的疫苗已经显示出很好的诱导Th1反应的潜力,这与对狂犬病病毒的免疫保护有关(RosalesMendoza, 2015)。在番茄毛状根中将蓖麻毒素B链(RGPrtxB)与狂犬病糖蛋白融合,可在粘膜内免疫后产生免疫应答。在菠菜中瞬时表达的植物性狂犬病疫苗正处于I期临床试验,9名志愿者中有5名产生了针对狂犬病病毒的中和抗体(Yusibov et al., 2002)。
甲型H1N1流感病毒会引起猪的传染性甲型H1N1流感,是畜牧业的主要负担。控制甲型H1N1流感的疫苗策略很多, 包括减毒活疫苗, 但活疫苗存在生产成本高、病毒倒置、需要低温储存等缺点,口服植物性疫苗提供了替代解决方案。口服表达甲型流感病毒蛋白的新型减毒沙门氏菌疫苗可保护小鼠免受H5N1和H1N1病毒感染(Pei et al., 2015)。
禽流感是一种高度传染性疾病。由于这种疾病通常在大型农场传播,因此需要大量接种疫苗来控制禽类和动物的疾病。以植物为基础的疫苗提供了在大型动物养殖场控制该疾病的最佳解决方案。禽流感病毒HPA1在拟南芥内质网中高效表达HA,口服免疫小鼠证实了转基因拟南芥的免疫原性,Th1反应和IgG2b的产生都很强,72%的免疫小鼠在病毒攻击后获得保护。基于H5N1瞬时表达的疫苗已经完成了第一阶段和第二阶段的临床试验(RosalesMendoza, 2015)。
寨卡病毒是一种新出现的病原体,最初发现于东非,目前传播到印度洋群岛、东南亚许多地区及美洲。目前还没有针对这种病原体的特异疫苗,探索不同抗原设计和表达方式的植物疫苗是一种有效的可行办法(Salazar et al., 2015)。
脊髓灰質炎病毒(PV)是脊髓灰质炎的病原体。PV有两种截然不同的抗原形式,即D和C,其中D形式能引起强烈的神经反应。开发一种人工合成的具有D抗原性的稳定病毒样颗粒疫苗,且不存在现有疫苗的缺点,将是最终根除脊髓灰质炎病毒的重要一步。这样的SVLP保留了原始病毒颗粒的天然抗原构象和重复结构,缺乏具有感染性的基因组物质。有研究证明,携带人类PV受体基因的小鼠在用植物制成的PV sVLP免疫时,可以保护自己免受野生型PV的侵袭(Marsian et al., 2017)。低成本、无冷链的植物制成病毒蛋白1(VP1)亚单位口服强化疫苗是目前疫苗研发的新策略。密码子优化使VP1基因在叶绿体中的表达提高了50倍,表达VP1的冻干植物细胞可在室温下储存,保持了效力,并无限期地保存了抗原折叠和组装,从而取代了目前所有疫苗所需的冷链(Chan et al, 2016)。
到目前为止,有一种植物制成的疫苗被开发出来作为候选疫苗对抗埃博拉病毒,开发其他针对埃博拉病毒的植物制成的疫苗原型,成为预防埃博拉病毒的有效策略(RosalesMendoza et al., 2017)。
2.2 细菌性疾病
炭疽病是由炭疽芽孢杆菌传播的最常见的人畜共患病,属于我国乙类传染病。目前的人和动物炭疽疫苗是从炭疽芽孢杆菌培养滤液中获得的可注射保护性抗原。这种疫苗有几个限制,包括需要加强剂(最多8个),以及培养滤液中的毒素污染(Jones et al., 2017)。用转基因植物疫苗口服后,采用炭疽芽孢杆菌致死剂量攻击,证实可以产生有效性的保护性免疫应答。口服免疫的小鼠产生IgA、IgG1、IgG2a效价,并在攻击后显示60%~80%的保护率(Shahid et al., 2016)。
鼠疫耶尔森氏菌是一种细菌性和人畜共患病的病原体,是人类传染性鼠疫的病原体。鼠疫感染可表现为淋巴腺感染(淋巴结感染)、败血症(血管感染)或肺炎(肺部感染)。动物,特别是啮齿动物是鼠疫耶尔森氏菌的主要宿主。鼠疫可在人类中造成严重感染,死亡率可达90%,目前可使用的疫苗有减毒或灭活疫苗(Rosenzweig et al., 2011)。在烟草叶绿体和口服小鼠中高水平表达的F1V具有很强的免疫原性,在鼠疫致死攻击后表现出88%的保护率;而在生菜叶绿体中表达的F1V产生的抗原水平却要低得多,但也具有免疫原性(Del Prete et al., 2009)。
结核病是一种动物和人类的细菌性人畜共患传染病。在发达国家,结核病已基本消除,但在大多数发展中国家结核病仍是一个问题。结核分枝杆菌是人类结核病的病原体,而牛则通过结核分枝杆菌感染结核病。牛分枝杆菌在人类中是一种危险的人畜共患病。卡介苗是唯一可用的结核病疫苗,但它有一些使用限制,而耐药结核病是另一个新出现的挑战。植物性疫苗可以提供潜在的解决方案。含有结核分枝杆菌fp10、esat6和dIFN的转基因修饰胡萝卜产生的抗原水平虽然低(0.035%TSP),但口服转基因胡萝卜免疫的小鼠产生了细胞和体液免疫反应(Uvarova et al., 2013)。CTB融合的ESAT6和Mtb72F在烟草和生菜叶片中的叶绿体转化可产生较高的表达水平(7.5%的TSP),冻干的植物细胞可以在环境温度下储存几个月,可以避免冷链产生的费用,这可以促进廉价疫苗的开发(Rosales et al., 2015)。此外,还有李斯特菌、氏杆菌病等植物口服疫苗的研发与应用。
2.3 寄生虫相关疾病
弓形虫寄生虫病在鸟类、人类和哺乳动物中引起先天性、神经和眼部弓形虫病,它是一种人畜共患寄生性病原体,通过受污染的食物或直接暴露于受污染的土壤传播给人类,孕妇和免疫受损个体的感染后果可能很严重。弓形虫GRA4抗原在叶绿体中表达后,经转基因叶片口服免疫小鼠后,可以产生细胞和粘膜免疫应答,感染弓形虫后小鼠脑内包囊负荷降低60%(Del et al., 2012)。在另一项研究中,将LiHSP83的热休克蛋白融合到SAG1后,提高了烟草叶绿体中SAG1的表达,也降低了口服免疫小鼠的胞囊负荷(Albarracin et al., 2015)。
疟疾是一种由恶性疟原虫传播的破坏性疾病,造成5亿人患病,每年有100万人死于疟疾。目前针对疟疾虽然没有获得许可的疫苗,但以植物为基础的疟疾疫苗正在开发中,结果令人振奋,实验中融合霍乱弧菌与疟疾疫苗抗原顶膜抗原1(AMA1)和裂殖子表面蛋白1(MSP1),他们观察到CTBAMA1和CTBMSP1在生菜和烟草叶绿体中存在高水平表达(14% TSP)(Chichester et al., 2018)。用融合的AMA1和MSP1口服免疫的小鼠产生抗原特异性抗体,并显示出抵御疟疾寄生虫和霍乱毒素攻击的保护作用(Chichester et al., 2018)。
2.4 肿瘤及肿瘤相关疾病
2.4.1 肝癌预防乙型肝炎病毒是人类最常见和最危险的病毒性疾病之一。鉴于缺乏适当的疫苗接种覆盖面,迫切需要可获得疫苗的替代来源。用植物源HBcAg进行低剂量的肠外口免疫可以引起特异性和高效的反应(Hayden, 2014)。生产HBcAg的转基因生菜被冻干并用作口服制剂,植物产生的HBcAg在细胞内的位置意味着在重组蛋白口服免疫期间在消化道可获得额外的保护(Pyrski et al., 2019)。
2.4.2 宫颈癌预防HPV是宫颈癌的病原体,宫颈癌是全球女性第二大常见的癌症。2008年,估计有529 000例新病例和274 000例死亡,接种HPV疫苗构成了一种预防和治疗方法(Jemal et al., 2011)。到目前为止,已经报道了几种植物制成的HPV疫苗,并对其进行了表征分析。最先进的模型是基于VLP的,VLP由不同植物系统中产生的结构HPV蛋白组成。其中一些候选分子的免疫原性和免疫保护作用已经在小鼠身上进行了评估。基于L1蛋白与一系列表位C端的融合,通过稳定的核转化获得了表达嵌合HPV16VLP的番茄植株可介导T细胞对HPV的杀伤活性。这些植物制成的cVLP在腹腔内诱导了显著的体液反应(Massa et al., 2019)。
此外,植物口服疫苗在胃癌的预防、戈谢病患者的治疗等方面有重要作用(Wong et al., 2017)。肠外制剂将是抗癌治疗的主要方法之一,这意味着疫苗需要进行纯化。虽然纯化增加了疫苗生产成本,但与其他技术相比,植物原料的低成本、获得蛋白质的高质量以及缺乏哺乳动物病原体也是非常具有吸引力的优势。植物蛋白疗法和生物制品在产品安全性和潜在成本效益方面的主要好处将进一步促进发达国家和发展中国家的公共卫生发展。综上所述,植物疫苗为肿瘤防治提供了一种独特的抗癌新技术。
3植物性口服疫苗的研发前景
不断增长的世界人口和不断出现的疾病促使人们开发出针对一系列疾病的更有效的新疫苗。虽然传统疫苗在世界上被广泛使用,但是它们的生产需要更高的成本、更多的时间和更好的基础设施。基于植物的可食用疫苗技术,显示出对许多疾病具有強有力和有效保护的结果。目前,作为可食用疫苗的许多药物蛋白已在不同的植物表达系统中被开发出来,并对其在各种危及生命的疾病进行了评估,其中一些已进入临床试验并显示出良好的效果(Sayed al., 2017)。使用植物生产直接口服生物药物的主要限制之一可能是商业化的监管障碍(Merlin et al., 2017)。以植物为基础的系统可以用来生产其他亚单位疫苗,每剂成本很低,有利于人类或动物的健康。尽管针对传染病的传统疫苗已经使用了多年,但基于植物的口服疫苗的发现有可能在未来完全取代它们。人类和动物将不再依赖于局部或系统性的疫苗注射,而会将疫苗作为日常食物。
植物疫苗开发平台基于冷冻干燥植物生物量的方式具有非常低的生产成本和较低的物流成本。其易于应用且不需要净化、冷链、无菌设备或受过培训的人员来指导,这些特点使得疫苗更稳定且更容易操作。此外,纳米技术时代的新进展推动了药物和植物疫苗安全纳米输送载体的开发(Rosales et al., 2016)。
动物和人类之间的共同疾病称为人畜共患病,在人畜之间传播传染病。人畜共患病不仅是畜牧业的主要负担,而且还威胁人类健康,约75%的人类新发传染病源自人畜共患病原体(Naila & Henry, 2016 )。植物为动物疾病疫苗提供了一个有吸引力和负担得起的平台。植物的疫苗是理想的增强疫苗,可以消除减毒细菌或病毒的多重增强剂,但对佐剂的注射要求是目前的限制。因此,需要采用口服疫苗这一方法来克服这一挑战。
在过去的三十多年里,植物分子领域对可食用疫苗的应用研发一直在不断探索中。高效高产地生产生物制品所需的技术都已经到位,一些符合GMP标准的设施已经很好地制定了下游加工方式,针对各种病原体的许多候选疫苗已经过测试,用于兽医的治疗性生物制品现在是可行的,部分医用疫苗已进入实验阶段(Rybicki, 2018)。使用植物制成的产品,优势在于较短的监管路径,对纯化产品要求不高,以及良好的实用性和疗法,对于产品开发人员具有很大的吸引力。
植物是生产重组抗体的新兴系统。尽管植物可以作为抗体表达系统提供所具有的优点,但到目前为止,很少有抗体进入到临床试验(Juarez et al., 2016)。然而,植物表达系统在不断改进,并发现它们与其他已建立的表达系统是互补的。因此,植物口服疫苗的研制对于负担不起某些传染病的昂贵治疗或预防的发展中国家来说,这将是一种有利的选择。
植物性可食用疫苗的技术发展迅速,将抗原表达量提高到有效的实际口服剂量水平的关键技术已取得重大进展。从临床前期动物试验和临床试验提供的疗效数据来看,植物疫苗不存在安全问题。新型致病性病毒毒株不断出现,对全球健康构成持续威胁,新冠病毒COVID19就是最新的例子。在抗击由SARSCoV2病毒引起的COVID19,基于植物的疫苗是一项已被证明具有可行性的技术(Sergio et al., 2020)。虽然植物疫苗的研究与应用还存在很多挑战,但植物疫苗依然为传统疫苗学的研发提供了一条充满希望的新途径。
參考文献:
ALBARRACN RM, BECHER ML, FARRAN I, et al., 2015. The fusion of Toxoplasma gondii SAG1 vaccine candidate to Leishmania infantum heat shock protein 83kDa improves expression levels in tobacco chloroplasts [J]. Biotechnol J, 10(5): 748-759.
CHAN HT, DANIELL H, 2015.Plantmade oral vaccines against human infectious diseases-Are we there yet? [J]. Plant Biotechnol J, 13(8): 1056-1070.
CHAN HT, XIAO Y, WELDON WC, et al.,2016. Cold chain and virusfree chloroplastmade booster vaccine to confer immunity against different poliovirus serotypes [J]. Plant Biotechnol J, 14(11): 2190-2200.
CHANG CC, LIU HJ, 2018. Plantmade vaccines against avian reovirus[M]//Prospects of PlantBased Vaccines in Veterinary Medicine: Springer International Publishing: 209-223.
CHICHESTER JA, GREEN BJ, JONES RM, et al., 2018. Safety and immunogenicity of a plantproduced Pfs25 viruslike particle as a transmission blocking vaccine against malaria: a Phase 1 doseescalation study in healthy adults [J]. Vaccine, 36(39): 5865-5871.
CLEMENTE M, 2014. Plantbased vaccines against toxoplasmosis [M]//Genetically engineered plants as a source of vaccines against wide spread diseases. New York, NY: Springer New York: 215-242.
DEL PRETE G, SANTI L, ANDRIANAIVOARIMANANA V, et al., 2009. Plantderived recombinant F1, V, and F1V fusion antigens of Yersinia pestis activate human cells of the innate and adaptive immune system [J]. Int J Immunopathol Pharmacol, 22(1): 133-143.
DEL L YCONO M, FARRAN I, BECHER ML, et al., 2012. A chloroplastderived Toxoplasma gondii GRA4 antigen used as an oral vaccine protects against toxoplasmosis in mice \[J\]. Plant Biotechnol J, 10(9): 1136-1144.
EDDA S, MARISELA H, JACQUELYNNE CT, et al., 2018. Toward the optimization a plantbased oral vaccine against cysticercosis[J]. Prospects of PlantBased Vaccines in Veterinary Med, Springer International Publishing: 227-237.
EDGAR T, SERGIO R.M, CARLOS A, 2020. A multiepitope plantmade chimeric protein (LTBentero) targeting common enteric pathogens is immunogenic in mice[J]. Plant Mol Biol, 102(2):159-169.
HAN M, SU T, ZU YG, et al.,2006.Research advances on transgenic plant vaccines [J]. Yi Chuan Xue Bao, 33(4): 285-293.
HAYDEN CA, 2014. An oral vaccine for hepatitis B: challenges, setbacks, and breakthroughs [M]//Commercial PlantProduced Recombinant Protein Products. Berlin, Heidelberg:Springer Berlin Heidelberg: 197-228.
JEMAL A, BRAY F, CENTER MM, et al., 2011. Global cancer statistics \[J\]. Ca Cancer J Clin, 61(2): 69-90.
JOSEPH GH,2018. A Plant based vaccine for necrotic enteritis in chickens[D]. Arizona State University.
JONES RM, BURKE M, DUBOSE D, et al., 2017. Stability and preformulation development of a plantproduced anthrax vaccine candidate \[J\]. Vaccine, 35(41): 5463-5470.
JUAREZ P, VIRDI V, DEPICKER A, et al., 2016.Biomanufacturing of protective antibodies and other therapeutics in edible plant tissues for oral applications [J]. Plant Biotechnol J, 14(9): 1791-1799.
KASHIMA K, YUKI Y, MEJIMA M, et al., 2016.Good manufacturing practices production of a purificationfree oral cholera vaccine expressed in transgenic rice plants [J]. Plant Cell Rep, 35(3): 667-679.
MACDONALD J, 2018.Prospects of plantbased vaccines in veterinary medicine [EB/OL].
MARSIAN J, FOX H, BAHAR MW, et al., 2017.Plantmade polio type 3 stabilized VLPsa candidate synthetic polio vaccine [J]. Nat Comm, 8(1): 245.
MASSA S, PAOLINI F, MARINO C, et al., 2019. Bioproduction of a therapeutic vaccine against human papillomavirus in tomato hairy root cultures [J]. Front Plant Sci, 10: 452.
MERLIN M, PEZZOTTI M, AVESANI L, 2017. Edible plants for oral delivery of biopharmaceuticals [J]. Br J Clin Pharmacol, 83(1): 71-81.
MILETIC, SEAN,2015. A plantmade vaccine candidate to protect ruminants against shiga toxinproducing Escherichia coli[D]. University of Western Ontari.
MONREALESCALANTE E, GOVEAALONSO DO, HERNNDEZ M, et al., 2016. Towards the development of an oral vaccine against porcine cysticercosis:Expression of the protective HP6/TSOL18 antigen in transgenic carrots cells [J]. Planta, 243(3): 675-685.
NAILA S, HENRY D, 2016. Plantbased oral vaccines against zoonotic and nonzoonotic diseases [J]. Plant Biotechnol J,14(11):2079-2099.
ORELLANAESCOBEDO L, ROSALESMENDOZA S, ROMEROMALDONADO A, et al., 2015. An envderived multiepitope HIV chimeric protein produced in the moss Physcomitrella patens is immunogenic in mice [J]. Plant Cell Rep, 34(3): 425-433.
PEI Z, JIANG X, YANG Z, et al., 2015.Oral delivery of a novel attenuated Salmonella vaccine expressing influenza A virus proteins protects mice against H5N1 and H1N1 viral infection [J]. PLoS ONE, 10(6): e0129276.
PNIEWSKI T, MILCZAREK M, WOJASTUREK J, et al., 2018. Plant lyophilisate carrying SHBsAg as an oral booster vaccine against HBV [J]. Vaccine, 36(41): 6070-6076.
PYRSKI M, MIELOCH AA, PLEWISKI A, et al., 2019. Parenteraloral immunization with plantderived HBcAg as a potential therapeutic vaccine against chronic hepatitis B [J]. Vaccines, 7(4): 211.
REYESBECERRIL M, ROSALESMENDOZA S, GULUARTE C, et al., 2019. Efficacy of the corn smutmade CTB oral vaccine on mucosal immune parameters in Pacific red snapper (Lutjanus peru) [J]. Aquaculture, 503: 403-411.
ROSALESMENDOZA S, 2015. Current developments and future prospects for plantmade biopharmaceuticals against rabies [J]. Mol Biotechnol, 57(10): 869-879.
ROSALESMENDOZA S, ANGULO C, MEZA B,
2016. Foodgrade organisms as vaccine biofactories and oral delivery vehicles [J]. Trends Biotechnol, 34(2): 124-136.
ROSALESMENDOZA S, NIETOGMEZ R, ANGULO C, 2017.A perspective on the development of plantmade vaccines in the fight against Ebola virus [J]. Front Immunol, 8: 252.
ROSALESMENDOZA S, ROSHUERTA R, ANGULO C, 2015.An overview of tuberculosis plantderived vaccines [J]. Expert Rev Vaccines, 14(6): 877-889.
ROSALESMENDOZA S, SALAZARGONZLEZ JA, DECKER EL, et al., 2016.Implications of plant glycans in the development of innovative vaccines [J].Expert Rev Vaccines, 15(7): 915-925.
ROSENZWEIG JA, JEJELOWO O, SHA J, et al., 2011. Progress on plague vaccine development \[J\]. Appl Microbiol Biotechnol, 91(2): 265-286.
RYBICKI E, 2018. History and promise of plantmade vaccines for animals[M]//Prospects of PlantBased Vaccines in Veterinary Medicine Springer International Publishing: 1-22.
SACK M, HOFBAUER A, FISCHER R, et al., 2015.The increasing value of plantmade proteins [J].Curr Opin Biotechnol, 32: 163-170.
SALAZARGONZLEZ JA, ANGULO C, ROSALESMENDOZA S, 2015.Chikungunya virus vaccines: Current strategies and prospects for developing plantmade vaccines [J].Vaccine, 33(31): 3650-3658.
SERGIO RM, VERóNICA A , OMAR GO, et al., 2020. What does plantbased vaccine technology offer to the fight against COVID19?[J]. Vaccines (Basel) ,8(2):183.
SHAHID N, DANIELL H, 2016.Plantbased oral vaccines against zoonotic and nonzoonotic diseases [J].Plant Biotechnol J, 14(11): 2079-2099.
SHAKOOR S, RAO AQ, SHAHID N, et al., 2019. Role of oral vaccines as an edible tool to prevent infectious diseases [J]. Acta Virol, 63(3): 245-252.
SOHRAB SS, SUHAIL M, KAMAL MA, et al., 2017. Recent development and future prospects of plantbased vaccines [J]. Curr Drug Metab, 18(9): 831-841.
TOPP E, IRWIN R, MCALLISTER T, et al., 2016. The case for plantmade veterinary immunotherapeutics [J]. Biotechnol Adv, 34(5): 597-604.
UVAROVA EA, BELAVIN PA, PERMYAKOVA NV, et al., 2013. Oral Immunogenicity of plantmade Mycobacterium tuberculosis ESAT6 and CFP10 \[J\]. Biomed Res Int: 316304.
Wong AA, González OO, Rosales MS, 2017. PlantMade Vaccines in the Fight Against Cancer \[J\]. Trends in biotechnology, 35(3): 241-256.
YOUNG HJ, SE HP, KI BM,2016. The last ten years of advancements in plantderived recombinant vaccines against hepatitis B[J]. Int J Mol Sci, 17(10): 1715.
YUSIBOV V, HOOPER DC, SPITSIN SV, et al., 2002. Expression in plants and immunogenicity of plant virusbased experimental rabies vaccine \[J\]. Vaccine, 20(25-26): 3155-3164.
(責任编辑蒋巧媛)
