基于ISSR分子标记的叶子花亲缘关系分析和指纹图谱构建
2021-03-30孙利娜李进华甘四明唐庆李冰刘雁玲马坚炜廖美兰黄欣林茂
孙利娜 李进华 甘四明 唐庆 李冰 刘雁玲 马坚炜 廖美兰 黄欣 林茂

摘要:為分析品种遗传多样性和遗传距离并构建品种聚类图和指纹图谱,该研究从DNA模板浓度、引物浓度、退火温度和循环次数等方面优化了叶子花ISSRPCR反应体系和反应程序,利用11个ISSR引物对131个叶子花品种进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测。结果表明:优化的ISSRPCR反应体系中DNA模板浓度为0.5 ng·μL1,引物浓度为0.5 μmol·L1,引物UBC813、UBC814、UBC815、UBC823、UBC824、UBC835、UBC840、UBC841、UBC843、UBC844和UBC876的最佳退火温度分别为52.3、55.9、54.3、54.3、53.6、56.2、56.2、51.9、54.4、54、50 ℃,循环次数为32。用11个ISSR引物对131个叶子花品种扩增出161条带,其中多态性条带156条,多态性比率为96.89%。单个引物的等位基因数、有效等位基因数、Neis基因多样性指数和Shannons信息指数分别为1.86~2.00、1.33~1.68、0.21~0.39和0.34~0.57,平均值分别为1.969、1.478、0.294和0.447。引物UBC841的鉴别率最高(80.92%),可有效鉴别106个品种,与引物UBC876结合可将131个叶子花品种完全鉴别开,建立了各品种的指纹图谱。叶子花品种的遗传距离范围为0.00~0.60,平均值为0.365,遗传多样性较低,在遗传距离0.58处,131个品种分为6大类群,聚类分析显示同一个种的品种大多聚在一类,但同一个种仍有品种未聚在一类或亚类、也有多个种的品种聚在一类。该研究较为准确地揭示了叶子花种质资源的遗传多样性,建立的指纹图谱为叶子花品种登记、知识产权保护以及品种鉴定提供了可靠技术和有效手段。
关键词: 叶子花, ISSR标记, 遗传多样性, 亲缘关系, 指纹图谱
中图分类号:Q943
文献标识码:A
文章编号:10003142(2021)02025115
Abstract:In this study, ISSRPCR reaction system was optimized from DNA template concentration, primer concentration, annealing temperature and cycle times, a total of 11 ISSR markers were used to amplify DNA samples of the 131 Bougainvillea cultivars, and the ISSR amplicons were detected based on a agarose gel electrophoresis method. Cultivars genetic diversity was analysed, their genetic distances were calculated, and the clustering analysis and fingerprint construction were performed for all the cultivars. The results were as follows: DNA template concentration was 0.5 ng·μL1, primer concentration was 0.5 μmol·L1, and the optimal annealing temperature of primers UBC813, UBC814, UBC815, UBC823, UBC824, UBC835, UBC840, UBC841, UBC843, UBC844 and UBC876 were 52.3, 55.9, 54.3, 54.3, 53.6, 56.2, 51.9, 54.4, 54, 50 ℃, respectively, the number of rings was 32. A total of161 bands were generated collectively by the 11 ISSR primers, and the 156 bands were polymorphic, and the polymorphic ratio was 96.89%. Allele number, effective allele number, Neis gene diversity index and Shannons information index ranged from 1.86 to 2.00, 1.33 to 1.68, 0.21 to 0.39 and 0.34 to 0.57, with an average of 1.969, 1.478, 0.294 and 0.447 per primer, respectively. Primer UBC841 had the highest identification rate(80.92%), by which 106 cultivars were identified. A total of 131 cultivars were completely identified and their molecular fingerprints were constructed based on combination of UBC841 and UBC876. The genetic distance between 131 cultivars ranged from 0.00 to 0.60, with an average value of 0.365, and genetic diversity of 131 Bougainvillea cultivars was low, which were divided into six groups at 0.58 genetic distance. Clustering analysis indicates that majority of the cultivars within a species tend to fall in the same cluster, but some cultivars of the same species were grouped in different clusters or subclusters and certain cultivars from different species grouped in the same cluster. Genetic diversity of Bougainvillea germplasm resources was revealed accurately, the ISSRbased fingerprints of Bougainvillea cultivar provide reliable technique for cultivar registration and intellectual property protection as well as cultivar clarification in production practices.
Key words: Bougainvillea, ISSR marker, genitic diversity, genetic relationship, fingerprints
葉子花(Bougainvillea spectabilis)属于瑞香目(Thymelaeceae)紫茉莉科(Nyctaginaceae)叶子花属(Bougainvillea)植物,在热带和亚热带地区常用于园林绿化,在我国的栽培历史有100多年。叶子花品种繁多,芽变类型丰富,我国引种选育的大约有200个品种,但它们的遗传关系不明确,并且存在同物异名和同名异物现象。目前,关于叶子花的研究多集中在繁殖栽培(周群,2008;Moneruzzaman et al.,2010;孙利娜等,2017a)和理化研究方面(赵家昱等,2014;Figueroa et al.,2014;Marana et al.,2015;Chauhan et al.,2016),关于遗传多样性方面的研究不多,尤其是基于内部简单重复序列(InterSimple Sequence Repeats, ISSR)分子标记技术分析叶子花种质资源亲缘关系的研究,目前研究较少,并且分析的品种数量较少(李房英等,2011)。利用ISSR分子标记鉴定大批量叶子花品种、构建叶子花品种指纹图谱的研究还未见报道。
ISSR分子标记技术是在简单重复序列(simple sequence repeats, SSR)标记基础上建立起来的,在简单重复序列的一端加1~4个碱基设计引物,检测两个距离较近、方向相反的SSR之间的DNA序列多态性,原理与SSR相似(周兰英,2014;邵珠田,2017)。ISSR标记引物设计简单,多态性高于随机扩增多态性DNA标记(random amplified polymorphic DNA, RAPD)和限制性内切酶片段长度多态性(restriction fragment length polymorphism, RFLP),易操作,所需DNA少,稳定性强,重复性好,成本低且安全性高(谭华强,2014)。目前,ISSR标记已广泛应用到亲缘关系分析(李国帅,2014)、遗传多样性分析(王琳,2015;梁颖,2018)、指纹图谱构建(王璐静,2016)、品种鉴别(Ali,2015;孙利娜等,2017b;Jedrzejczyk et al.,2018)、纯度鉴定(管洁等,2013)、遗传稳定性分析(Reza et al.,2018)等领域。本研究以131个叶子花品种为研究对象,利用ISSR标记分析它们的遗传多样性,确定它们的亲缘关系,并进行品种鉴定和指纹图谱构建,从而为叶子花种质资源保存、知识产权保护以及品种鉴定提供了可靠技术和有效手段。
1材料与方法
1.1 材料
1.1.1 植物材料参试的131个叶子花品种见表1,其中18个品种(序号1-18)保存于广西壮族自治区林业科学研究院园林花卉所,113个品种(序号19-131)采自中国热带农业科学院热带作物品质资源研究所。从生长健壮、无病虫害的植株上采集幼嫩叶片,迅速提取DNA,冷冻于-80 ℃冰箱备用。
1.1.2 引物的合成与筛选引物序列来自加拿大哥伦比亚大学公布的100个ISSR引物,由苏州金唯智生物科技有限公司合成,从中筛选出多态性高,稳定性强,重复性好的引物用于叶子花品种的亲缘关系分析和指纹图谱构建。
1.2 方法
1.2.1 叶子花基因组DNA提取与检测采用快捷型植物基因组DNA提取试剂盒(北京艾德莱生物科技有限公司)提取幼嫩叶片的DNA,用1.2%琼脂糖凝胶电泳与紫外分光光度计检测DNA浓度。
1.2.2 叶子花ISSRPCR反应体系的优化参考李房英等(2010),将该实验的原初扩增反应体系定为20 μL,包括:2× Drem Taq mix 10 μL、ISSR Primer(10 umol·L1)1 μL、RNasefree water 8 μL、20~30 ng Template g DNA 1 μL。然后,对影响DNA扩增的重要因素如模板DNA浓度(模板DNA为橙红品种(Bougainvillea spectabilis ‘Auratus)和所用引物浓度设置梯度,模板DNA设400、200、50、20、10、5、0.2 ng·μL1共7个浓度,引物设40、20、15、10、4、2 pmol·μL1 共6个浓度,利用初筛获得的扩增效果较好的引物UBC815进行最优条件的筛选,以期获得最佳反应体系。
PCR扩增反应在深圳珠海黑马公司生产的HeMa9600基因扩增仪上进行,PCR最初扩增程序:94℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸2 min,38个循环后4 ℃保存。在此基础上,对筛选出的11个引物设置退火温度试验、对循环数进行梯度设置(20个循环、23个循环、26个循环、29个循环、32个循环、35个循环、38个循环、42个循环)。
PCR产物使用1.5%琼脂糖胶检测,Goldview 染色,在电压不超过5 V·cm1 的电场强度下,1×TAE 缓冲液中电泳90 min,JS1075凝胶成像系统上观察成像。
1.2.3 ISSRPCR反应体系验证以供试的其中任意18个叶子花品种的DNA为模版,用筛选出的多态性好的ISSR引物在最佳反应体系及扩增程序下进行PCR扩增,检验反应体系的稳定性。
1.2.4 叶子花种质资源ISSR扩增数据处理与分析对扩增产物进行人工读带,以片段大小为5 000 bp的Marker为标准,统计重复性好、清晰明亮的条带,有条带出现的位点记为 “1”,无条带出现或模糊不清的位点记为“0”。将读取的条带信息转化为0、1数据矩阵,利用PopGene32软件对供试材料的多态性位点百分率(percentage of polymorphic loci, PPL)、观测等位基因数(observation of allele number, Na)、有效等位基因数(number of effective alleles, Ne)、Neis基因多样性指数(gene diversity index, H)、Shannons信息指数(Shannons information index, I)、遗传距离(genetic distance, GD)及遗传相似系数(coefficient of genetic similarity, GS)等遗传参数进行分析,并基于遗传距离和遗传相似系数在软件NTSYSpc 2.1(Rohlf et al., 2000)中采用非加权分组算术平均(unweighted pair group method with Arithmetic Mean,UPGMA)法对品种聚类分析,建立叶子花品种的DNA数字指纹图谱。
2结果与分析
2.1 基因组DNA提取与检测
利用快捷型植物基因组DNA提取试剂盒提取的叶子花基因组DNA经琼脂糖凝胶电泳检测,条带清晰、明亮、无拖尾、样孔内无杂质。图1显示了20个样品DNA的电泳检测结果。利用紫外分光光度计测定所提DNA样品的OD260/OD280值,结果OD260/OD280值都在1.8~2.0之间,浓度在200~400 ng·μL1。以上结果说明本研究采用的DNA提取法提取的叶子花DNA效果好,可用于后续试验。
2.2 叶子花ISSRPCR反应体系的优化
2.2.1 DNA模板对PCR反应的影响DNA模板浓度和质量是影响ISSRPCR扩增效果的重要因素,本实验利用引物UBC815扩增DNA模板,扩增产物(图2)表明:模板浓度在0.01~50 ng· μL1 范围内均能扩增出条带,但在0.01 ng· μL1、0.05 ng· μL1、10 ng· μL1、50 ng·μL1浓度下扩增的效果较差,0.1~2 ng·μL1浓度范围内差异不明显。经多次重复试验,在0.5 ng·μL1浓度时条带较清晰、稳定。
2.2.2 引物浓度对PCR反应的影响引物浓度在0.1~2.0 μmol·L1范围内均能扩增出条带,但在0.1 μmol·L1、0.2 μmol·L1和2.0 μmol·L1浓度下扩增的条带较少、亮度低,浓度在0.5~1.0 μmol·L1时扩增效果较好,经反复试验,最终确定后续试验所用引物浓度为0.5 μmol·L1,如图3所示。
2.2.3 退火温度对PCR反应的影响本研究在最佳反应体系基础上对筛选出的11个引物进行退火试验,确定了每个引物的最佳退火温度,引物UBC813、UBC814、UBC815、UBC823、UBC824、UBC835、UBC840、UBC841、UBC843、UBC844和UBC876的最佳退火温度分别为52.3、55.9、54.3、54.3、53.6、56.2、56.2、51.9、54.4、54、50 ℃。部分引物筛选退火温度电泳图如图4、图5和图6所示。
2.2.4 循环次数对PCR反应的影响增加循环数在一定程度上能够提高产物量,但反应时间过长会使非特异扩增产物增加,而且会受到各反应成分的用量限制,如:随着酶的扩增能力下降,合成目标片段的能力也随之下降,因此,适宜的循环次数对于扩增效果至关重要。
不同循环次数下的 ISSRPCR扩增结果如图7所示,模板在20~26个循环时均未扩增出条带,29~41个循环时均能扩增出条带,但在32个循环时可获得明亮清晰的条带,效果最好,如果再增加循环次数,条带变化不大,但从节约时间和成本考虑,以32个循环为宜。
2.3 ISSRPCR体系稳定性检测
从毛叶叶子花(Bougainvillea spectabilis)品种、光叶叶子花(B. glabra)品种、巴特叶子花(Bougainvillea × buttiana)品种、秘鲁叶子花(B. peruviana)品种和拉丁名不详的品种(Bougainvillea sp.)中选出18个样品用于检测优化的ISSRPCR反应体系,用引物UBC824对其进行扩增(图8),扩增结果显示本研究优化的叶子花ISSRPCR反应体系稳定性好,条带清晰、重复性和多态性高,有丰富的特异性,可用于后续研究。
2.4 ISSR引物筛选
本文对100个ISSR引物进行初筛、复筛,并确定最终筛选出的引物最佳退火温度,共筛选出11个扩增条带多、条带清晰、重复性好的ISSR引物,部分引物筛选结果如图9、图10所示。
2.5 叶子花种质资源ISSR分析
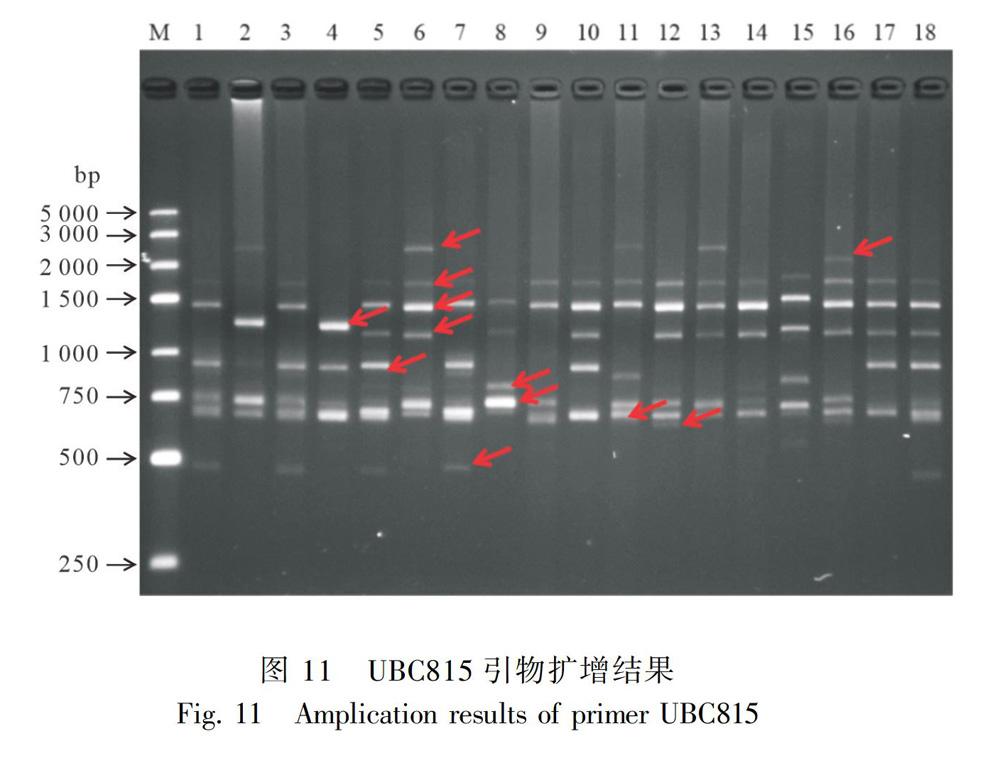
2.5.1 ISSR引物多态性分析从100个ISSR引物中筛选出11个扩增条带多、条带清晰、多态性高和重复性好的引物,对131个叶子花品种进行分析,结果见表3。11个引物共扩增161条带,平均每个引物扩增14.6条,其中有156条带具有多态性,多态性比率为96.89%。11个引物的扩增条带数在12~20之间,扩增条带数最多的是UBC841(20条),UBC814、UBC815和UBC843扩增的条带最少,均为12条。除引物UBC823、UBC835和UBC840之外,其余引物产生的多态性比例都达到100%,说明这11条引物在供试材料中的多态性较好。引物UBC815對部分样品扩增的电泳图如图11所示。
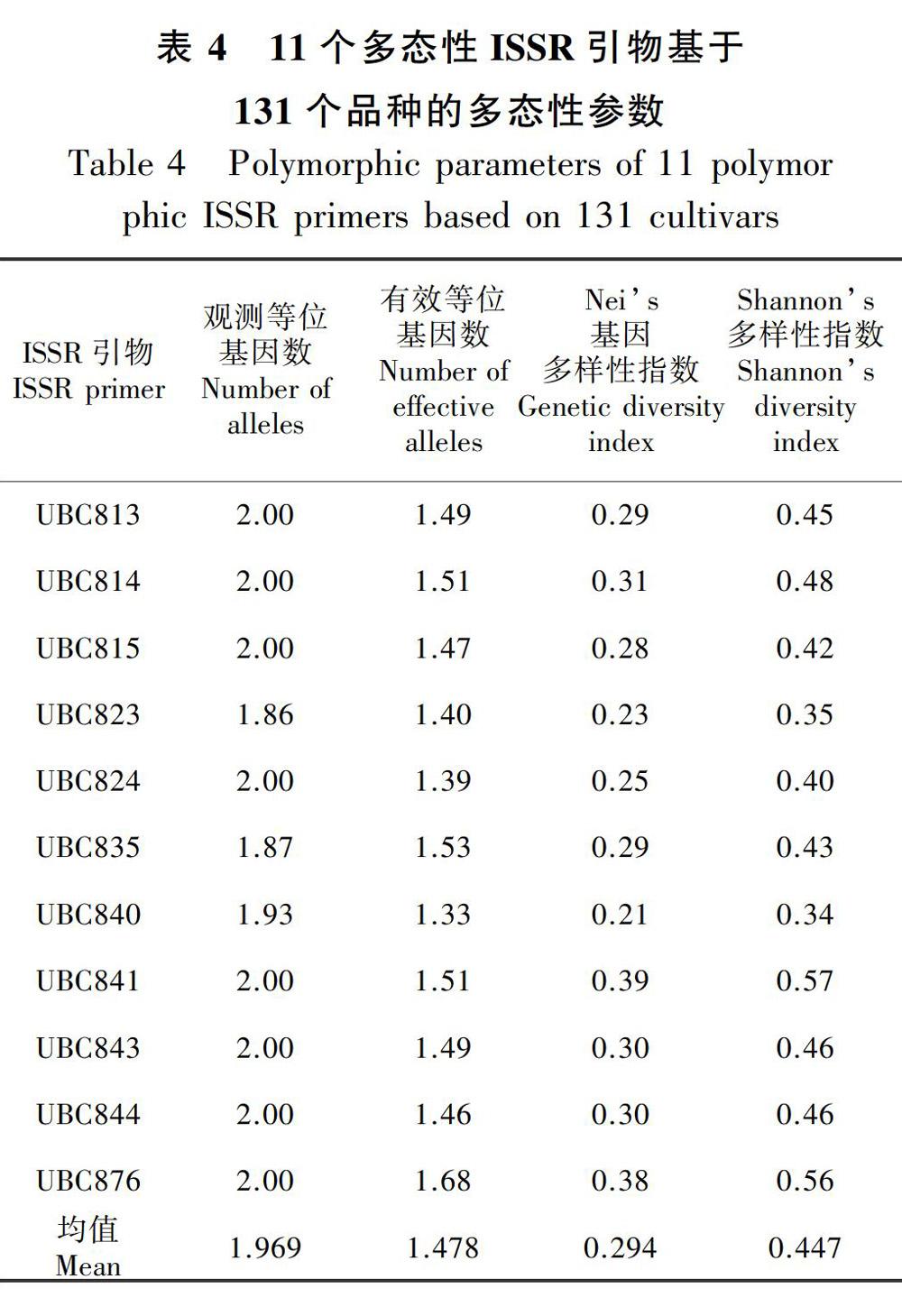
2.5.2 叶子花种质资源的遗传多样性分析将读取的数据转化为0、1矩阵,利用Popgene32软件分析相关遗传参数,分析结果见表4。单个引物的等位基因数为1.86~2.00,平均等位基因数1.969;有效等位基因数为1.33(UBC840)~1.68(UBC876),平均有效等位基因数为1.478;Neis基因多样性指数为0.21(UBC840)~0.39(UBC841),平均值为0.294;Shannons信息指数为0.34(UBC823、UBC840)~0.57(UBC841),平均值为0.447。从4个遗传参数看,引物UBC841和UBC876的各项值均较其他引物高,引物UBC840的有效等位基因数、Neis基因多样性指数和Shannons信息指数均为最低。由以上结果可知,叶子花的遗传多样性不够丰富。
2.5.3 叶子花种质资源的UPGMA聚类分析基于11个ISSR引物计算的叶子花131个品种间的遗传距离范围为0.00~0.60,平均值为0.365,利用UPGMA法对131个叶子花品种聚类分析,建立聚类分析树状图(图12),从聚类图可以看出,在遗传距离0.58处,131个品种分为6大类群,即类群1、类群2、类群3、类群4、类群5和类群6。
类群1包含4个种的25个品种,其中13个光叶叶子花、4个毛叶叶子花、1个巴特叶子花、1个秘鲁叶子花、6个拉丁名不详的品种。在遗传距离0.54处,类群1可再分为3个亚群,分别为亚群1-Ⅰ、亚群1-Ⅱ和亚群1-Ⅲ。亚群1-Ⅰ包括8个光叶叶子花品种(1号、3号、7号、19号、20号、21号、38号和39号)、2个毛叶叶子花品种(9号和11号)、3个拉丁名不详的品种(126号、101号和127号);亚群1-Ⅱ包括3个光叶叶子花品种(37号、40号和41号)、2个毛叶叶子花品种(40号和84号)、1个巴特叶子花品种(51号)、1个秘鲁叶子花品种(76号)、3个拉丁名不详的品种(92号、130号和131号);亚群1-Ⅲ仅包括2个光叶叶子花品种(2号和4号)。
类群2共包含9个品种,其中5个光叶叶子花品种(25号、26号、27号、29号和28号)、1个巴特叶子花品种(45号)、3个拉丁名不详的品种(110号、112号和111号)。类群3共包含86个品种,其中6个光叶叶子花品种、29个巴特叶子花品种、6个毛叶叶子花品种、9个秘鲁叶子花品种、2个光叶×毛叶杂交种(B. × spectoglabra)和33个拉丁名不详的品种。在遗传距离0.56处,类群3可再分为4个亚群,分别为亚群3Ⅰ、亚群3Ⅱ、亚群3Ⅲ和亚群3Ⅳ。亚群3Ⅰ包括2个光叶叶子花品种(5号和6号)、5个巴特叶子花品种(18号、17号、14号、15号和16号)、2个毛叶叶子花品种(8号和10号)、2个光叶×毛叶杂交种(13号和12号)。亚群3Ⅱ仅有1个拉丁名不详的品种(86号)。在遗传距离0.53处,亚群3Ⅲ又可分为3ⅢA、3ⅢB、3ⅢC、3ⅢD、3ⅢE、3ⅢF和3ⅢG七个小类,其中:3ⅢA小类包括1个光叶叶子花品种(31号)、2个毛叶叶子花品种(81号和80号)、1个巴特叶子花品种(56号)、8个拉丁名不详的品种(97号、118号、119号、120号、116号、96号、95号和115号);3ⅢB小类包括1个光叶叶子花品种(36号)、1个毛叶叶子花品种(82号)、4个巴特叶子花品种(58号、59号、60号和53号)、3个秘鲁叶子花品种(71号、72号和75号)、5个拉丁名不详的品种(98号、99号、125号、113号和122号);3ⅢC小类包括1个光叶叶子花品种(23号)、10个巴特叶子花品种(47号、49号、50号、42号、43号、48号、55号、57号、44号和46号)、3个秘鲁叶子花品种(74号、69号和70号)、10个拉丁名不详的品种(104号、102号、106号、85号、88号、114号、121号、91号、108号和107号);3ⅢD小类包括7个巴特叶子花品种(61号、62号、63号、67号、64号、65号和66号)、1个秘鲁叶子花品种(77号)、3个拉丁名不详的品种(128号、129号和109号);3ⅢE小类包括1个秘鲁叶子花品种(73号)和1个毛叶叶子花品种(78号);3ⅢF小类包括2个拉丁名不详的品种(89号和90号);3ⅢG小类包括1个巴特叶子花品种(54号)和3个拉丁2个拉丁名不详的品种(87号和105号)。
根据聚类分析结果,131个品种均被聚类分开,说明供试品种之间具有一定的遗传差异,ISSR标记在叶子花种质资源分析和品种鉴定研究方面具有较好的效果。
2.5.4 叶子花种质资源的指纹图谱构建利用筛选出的11个ISSR引物对131个叶子花品种扩增,可将131个样品完全区分开,对电泳条带进行统计,在同一位点处,有条带出现的标记为“1”,无条带出现的标记为“0”,用0/1数据矩阵构建131个叶子花品种的指纹图谱(表5),11个引物中引物UBC841的鉴别率最高(80.92%),可有效鉴别106个品种,再与引物UBC876结合可将131个叶子花品种完全鉴别开。引物UBC841共扩增出20个多态性位点,分别是2 500、2 200、2 000、1 600、1 500、1 450、1 100、1 000、950、850、750、700、650、550、450、400、350、150、250、2 900 bp。引物UBC876共扩增出15个多态性位点,分别是2 800、2 500、2 000、1 800、1 500、1 350、1 150、1 050、900、850、750、650、550、3 100、500 bp。
3讨论与结论
3.1 ISSR体系优化
DNA模板量对PCR扩增起着关键作用,本研究DNA模板浓度在0.01~50 ng·μL1范围内均能扩增出条带,但浓度过高或过低扩增的条带不清晰、弥散(王渭霞等,2010),经反复试验,确定0.5 ng·μL1为最佳浓度,此浓度下扩增的条带最清晰、稳定。引物浓度直接影响PCR扩增结果,过高会增加错配和非特异性扩增的几率,且易使引物之间形成二聚体,浓度过低易导致扩增产物不足,影响扩增效果(刘昕,2014)。PCR特异性亦受退火温度的影响,而碱基组成及其浓度、引物长度和靶基序列长度都影响退火温度,因此不同的引物其退火温度不一样(张茹,2014),本研究通过梯度试验,筛选出每个引物的最适退火温度。循环次数对PCR扩增具有决定性的影响,循环次数越多,产生非特异性产物的量也越多,一般控制在30~40次之间(冯富娟等,2004),本研究在32个循环时可获得明亮清晰的条带,效果最好。
3.2 ISSR标记分析叶子花种质资源遗传多样性与亲缘关系
本研究在优化的ISSRPCR反应体系的基础上,基于11个多态性高、重复性好和穩定性强的ISSR引物对131个叶子花品种进行扩增,共扩增出161条带,其中有156条谱带具有多态性,多态性比率为96.7%,较RAPD(多态性比率67.4%)(Richa et al.,2009)和同工酶(多态性比率75.5%)具有更为丰富的多态性(尹俊梅等,2001)。供试的叶子花Neis基因多样性指数(均值0.29)和Shannons信息指数(均值0.45)都较低,并且遗传相似系数高(0.64~0.95),这些数据均表明供试品种的遗传多样性不高,这一结果同黄彦晶(2010)(68份叶子花的遗传相似系数为0.50~0.97)和Richa et al.(2009)(30份叶子花的遗传相似系数为0.51~0.94)的研究结果相一致。叶子花遗传多样性不高的原因可能是叶子花特殊的花器官构造以及花粉活力低使其杂交育种受到限制,导致无性繁殖成其主要繁殖方式,而长期的无性繁殖使得叶子花的基因池变窄,遗传相似性较高,亲缘关系较近(黄彦晶,2010)。
供试叶子花品种间的遗传距离为0.00~0.60,平均0.365,聚类分析中131个叶子花品种均可有效鉴定,表明ISSR对叶子花品种鉴定具有较高的可靠性。通过聚类,在遗传距离0.58处,将所有叶子花品种聚为6大类,说明供试品种间存在差异,并且聚类呈现一定规律,如:每个种的大部分品种聚在一类,如光叶叶子花30个品种中18个(60.0%)聚在类群1和类群2(类群1和类群2属于一大类,二者在遗传距离0.56处被分成两个类群),巴特叶子花31个品种中29个(93.5%)聚在类群3,秘鲁叶子花11个品种中9个(81.8%)聚在类群3,2个杂交种12号和13号聚在亚群3Ⅰ。但是,同一个种仍有品种未聚在一类或亚类,如光叶叶子花品种绿叶浅紫和雪紫分别聚在类群4和类群5,白雪公主、小叶紫、新加坡白和新加坡粉聚在类群6,与其主要聚类的类群1和类群2分开聚类;1个巴特叶子花品种(金边叶重粉)聚在了类群1,而巴特叶子花是光叶叶子花和秘鲁叶子花的杂交种,该品种在扩增中表现出光叶叶子花品种的特征,所以和光叶叶子花品种聚在一起。此外,也有多个种的品种聚在一类,如类群3包含了所有的种和杂种,可能原因是这些品种长期生活在相似的环境下使其很多习性、性状乃至控制表型的基因逐渐趋于一致。
与李房英等(2011)基于ISSR的68个品种的聚类结果比较,品种名相同的16个品种聚类关系相似,如光叶斑叶紫花、大花深紫、黄金叶和胭脂红聚在亚群1Ⅰ(李房英等的品种依次为光叶斑叶紫花、黄金叶、小叶紫花和青叶白,聚为A类),皱叶深红、樱花、水红、塔紫、金心和斑叶塔紫聚在亚群3Ⅰ(李房英等的品种依次为皱叶深红、塔橙、重瓣白里透红、塔紫、金心宝巾和斑叶塔紫,聚为B类)。但是,基于ISSR分子标记的聚类结果与传统的依据形态分类的结果并不严格一致,如30号绿叶浅紫属于光叶叶子花,79号毛叶属于毛叶叶子花,二者形态差异明显,并且分别属于不同的种,而在此聚类中二者却被聚为一类,表明分子标记检测结果与传统的表型分类仍存在一定差别。
通过本研究,一方面确定了叶子花品种间的亲缘关系,另一方面成功地建立了叶子花的分子指纹,为今后叶子花种质资源保存和品种鉴定提供了有用的信息。
参考文献:
ALI QS, 2015. Identification and diversity analysis of Wintersweet (Chimonanthus praecox) crossing progenies using SSR molecular markers [D]. Wuhan: Huazhong Agricultural University.[ALI QS, 2015. 蜡梅的杂交F1代真实性鉴定及遗传多样性分析 [D]. 武汉: 华中农业大学.]
FENG FJ, WANG FY, LIU T, 2004. The influence factors of the ISSRPCR experiment system on Pinus koraiensis Sieb. et Zucc [J]. Chin Bull Bot, 21(3): 326-331.[冯富娟, 王凤友, 刘彤, 2004. 红松ISSRPCR实验系统影响因素 [J]. 植物学通报, 21(3): 326-331.]
GUAN J, JIAO XH, WU JX, et al., 2013. Identification of Asian lily hybrid F1 by using ISSR [J]. Mol Plant Breed, 11(3): 415-420.[管洁, 焦雪辉, 吴锦娣, 等, 2013. 用ISSR分子标记鉴定亚洲百合杂种F1代 [J]. 分子植物育种, 11(3): 415-420.]
HUANG YJ, 2010. ISSR analysis of germplasm resources of Bougainvillea brasiliensis Raeusch [D]. Fuzhou: Fujian Agriculture & Forestry University.[黄彦晶, 2010. 三角梅(Bougainvillea brasiliensis Raeusch.)种质资源的ISSR分析 [D]. 福州: 福建农林大学.]
JEDRZEJCZYK I, REWERS M, 2018. Genome size and ISSR markers for Mentha L. (Lamiaceae) genetic diversity assessment and species identification [J]. Ind Crop Prod, 120: 171-179.
LI FY, HUANG YJ, WU SH, et al., 2011.ISSR analysis of germplasm resources of Bougainvillea spectabilis Willd [J]. Chin J Trop Crops, 32(9): 1692-1696. [李房英, 黄彦晶, 吴少华, 等, 2011. 三角梅种质资源的ISSR分析 [J]. 热带作物学报, 32(9): 1692-1696.]
LI GS, 2014. The research of ISSR on relationship of 5 species of wild Camellia of genus Camellia and fingerprint construction [D]. Changsha: Central South University of Forestry & Tecthology.[李国帅, 2014. 5种山茶属野生油茶ISSR亲缘关系研究及指纹图谱的构建 [D]. 长沙: 中南林业科技大学.]
LIANG Y, 2018. Genetic diversity analysis of Caragana Fabr. in Inner Mongolia desert area [D]. Huhehaote: Inner Mongolia University.[梁颖, 2018. 内蒙古荒漠区锦鸡儿遗传多样性分析 [D]. 呼和浩特: 内蒙古大学.]
LIU X, 2014. Genetic diversity analysis of ISSR and fingerprint preliminary construction of the genus Hemerocallis [D]. Changchun:Jilin Agricultural University. [劉昕,2014. 萱草属植物遗传多样性的ISSR分析及指纹图谱的初步构建 [D]. 长春: 吉林农业大学.]
MONERUZZAMAN KM, HOSSAIN ABMS, NORMANIZA O, et al., 2010. Effects of removal of young leaves and kinetin on inflorescence development and bract enlargement of Bougainvillea glabra var. “Elizabeth Angus” [J].Aust J Crop Sci, 4(7): 467-473.
REZA RAJIMR, LOTFI M, TOHIDFAR M, et al., 2018. Somatic embryogenesis of muskmelon (Cucumis melo L.) and genetic stability assessment of regenerants using flow cytometry and ISSR markers [J]. Protoplasma, 255(3): 873-883.
RICHA S, SUDHIR S, ARVIND S, et al., 2009. RAPDbased genetic relationships in different Bougainvillea cultivars [J]. Crop Breed Appl Biot, 9: 154-163.
ROHLF FJ, 2000. NTSYSPc: numerical taxonomy and multivariate analysis system version 2.1 [M]. New York: Applied Biostatistics Inc.
SHAO ZT, 2017.Studies on genetic relationship of culinary Rhubarb and official Rheum based on ISSR and SRAP markers [D]. Xinxiang: Henan Institute of Science and Technology.[邵珠田, 2017. 利用ISSR及SRAP分子标记研究菜用大黄与药用大黄的亲缘关系 [D]. 新乡: 河南科技学院.]
SUN LN, LIN M, LI JH, et al., 2017a. Callus induction of Bougainvillea spectabilis cultivars [J]. J W Chin For Sci, 46(2): 157-160.[孙利娜, 林茂, 李进华, 等, 2017a. 不同品种叶子花愈伤组织的诱导 [J]. 西部林业科学, 46(2): 157-160.]
SUN LN, LIN M, WANG HX, et al., 2017b. Identification of Bougainvillea spectabilis radiation mutant based on ISSR markers [J]. Guangxi For Sci, 46(3): 276-279. [孙利娜, 林茂, 王华新, 等, 2017b. 运用ISSR标记鉴定叶子花辐射突变体 [J]. 广西林业科学, 46(3): 276-279.]
SUN LN, WANG HX, GONG JY, et al., 2013.Cutting propagation of Bougainvillea glabra and its effecting factors [J]. Guangxi For Sci, 42(2): 183-185. [孙利娜, 王华新, 龚建英, 等, 2013. 叶子花扦插育苗影响因素分析 [J]. 广西林业科学, 42(2): 183-185.]
TAN HQ, 2014. Genetic diversity analysis and varietal idengtification among 68 Chinese asparagus bean (Vigna unguiculata ssp. sesquipedialis) cultivars based on RAPD, ISSR and morphological markers [D]. Yaan: Sichuan Agricultural University.[譚华强, 2014. 利用形态学和RAPD、ISSR分子标记分析68个豇豆品种的亲缘关系 [D]. 雅安: 四川农业大学.]
WANG L, 2015. Analysis on genetic diversity of Forsythia suspensa by ISSR marker [D]. Taiyuan: Shanxi Agricultural University.[王琳, 2015. 基于ISSR的连翘遗传多样性研究 [D]. 太原: 山西农业大学.]
WANG LJ, 2016. A study on the genetic diversity and the identification of DNA barcoding of medicinal plants Rosa L.[D]. Zhengzhou: Henan Agricultural University.[王璐静, 2016. 蔷薇属(Rosa L.)药用植物的遗传多样性及DNA条形码鉴定研究 [D]. 郑州: 河南农业大学.]
WANG WX, LAI FX, HONG LY, et al., 2010.Effects of DNA concentrations and storage conditions on PCR detection of transgenic rice[J]. J Agric Biotechnol, 18(5): 846-852.[王渭霞, 赖凤香, 洪利英, 等, 2010. 转基因水稻DNA样品浓度以及存放条件对PCR定性检测的影响 [J]. 农业生物技术学报, 18(5): 846-852.]
YIN JM, OU WJ, ZHANG X, 2001.Protein analysis of genetic relationship of Bougainvillea cultivars [J]. Chin J Trop Crops, 22(4): 61-66.[尹俊梅, 欧文军, 张欣, 2001. 三角梅品种间亲缘关系的蛋白质分析 [J]. 热带作物学报, 22(4): 61-66.]
ZHANG R, 2014. Analysis on genetic diversity of Radix Astragali by ISSR marker[D]. Taiyuan: Shanxi Agricultural University.[张茹, 2014. 药用黄芪ISSR遗传多样性分析 [D]. 太原: 山西农业大学.]
ZHOU LY, 2014. ISSR analysis on the diversityof oiltea Camellia germplasm [D]. Changsha: Hunan Normal University.[周兰英, 2014. 油茶种质资源多样性的分析 [D]. 长沙: 湖南师范大学.]
ZHOU Q, 2008.Research on germplasm resource and propagational technique of Bougainvillea L. in China[J].Chin Agric Sci Bull, 24(12): 321-324.[周群, 2008. 中国叶子花属植物种质资源及其繁殖技术研究 [J]. 中国农学通报, 24(12): 321-324.]
(责任编辑李莉)
