贵州地区57例遗传性持续性胎儿血红蛋白增高症遗传因素分析*
2021-03-30熊永红姜敏敏黄盛文
熊永红,李 頔,胡 莉,姜敏敏,黄盛文△
1.贵州省人民医院产前诊断中心,贵州贵阳 550000;2.四川省广安市广安区人民医院检验科,四川广安 638000
由于各种遗传因素导致血红蛋白F(HbF)在成人期持续性表达增加,被称为遗传性持续性胎儿血红蛋白增高症(HPFH)[1]。HPFH一般无明显临床症状,血液学检查相对正常,或者仅表现为轻微的小细胞低色素贫血,但当HPFH复合β珠蛋白生成障碍性贫血(简称地贫)时,可导致轻、中间或者重型地贫[2]。HPFH根据基因缺陷的不同分为缺失型HPFH和非缺失型HPFH(nd-HPFH)两大类,前者主要是β珠蛋白基因簇的大段缺失所致,该类型基因也是造成临床较常见的中间型地贫的主要病理缺陷之一[3];nd-HPFH主要是γ珠蛋白基因启动子区域或其他修饰基因点突变或小片段的缺失,影响了反式作用因子与启动子的结合,或珠蛋白基因表达调控异常而导致γ珠蛋白基因的持续表达。
人群中HbF水平具有数量遗传的特性,除珠蛋白基因的遗传缺陷导致HPFH外,通过全基因组关联分析(GWAS)发现了与HbF水平升高相关的多个基因的单核苷酸多态性(SNP)位点,包括HBS1L-MYB基因间区域、BCL11A、ANTXR1、KLF1基因等[4-6]。本研究应用PCR扩增技术及Sanger测序技术,检测HPFH中珠蛋白基因遗传缺陷及与HbF水平相关的多个SNP位点的基因型,分析贵州地区HPFH相关的遗传因素。现报道如下。
1 资料与方法
1.1一般资料 选取2016年7月至2019年4月于贵州省人民医院行血红蛋白电泳检测的患者,纳入标准为符合以下两条标准之一:(1)年龄≥2岁,血红蛋白A2(HbA2)<3.5%,HbF>5%;(2)年龄≥2岁,HbA2≥3.5%,HbF>10%。排除标准:影响HbF水平的疾病,如地贫、血液系统肿瘤、范可尼贫血等。共收集57份HPFH患者的标本,其中男18例,女39例;年龄3~62岁。另选取同期贵州省人民医院体检健康者血样50份作为对照标本,血常规和血红蛋白电泳检测各指标均在正常范围内。对照组中男21例,女29例;年龄18~70岁。本研究临床标本获取已通过贵州省人民医院伦理委员会批准。
1.2仪器与试剂 核酸提取仪(NP968,西安天隆科技有限公司);PCR仪(Veriti 96孔温度梯度PCR仪,美国Applied Biosystem公司);DNA提取试剂盒(西安天隆科技有限公司);寡核苷酸引物(生工生物工程上海股份有限公司);2×Taq PCR Master Mix(天根生化科技有限公司);α/β地贫基因检测试剂盒(深圳益生堂生物企业有限公司)。
1.3方法
1.3.1DNA提取及地贫基因检测 乙二胺四乙酸(EDTA)抗凝静脉血2 mL,核酸提取仪磁珠法提取全血基因组DNA,完善地贫基因检测,具体操作按α地贫基因检测试剂盒(Gap-PCR法)说明书和β地贫基因检测试剂盒(PCR探针法)说明书进行。
1.3.2缺失型HPFH基因检测 从国际生物基因数据库(NCBI数据库)查找β珠蛋白基因序列,根据Gap-PCR跨越断裂点的技术原理,运用Primer premier 5.0软件分别在东南亚型HPFH(SEA-HPFH)及中国型Gγ+(Aγδβ)0-地贫缺失区域两侧翼及缺失区域内,设计扩增缺失截短片段与正常内对照片段的Gap-PCR引物。SEA-HPFH:缺失上游引物5′-ATTGTTGAGTTGCAGGATCG-3′,正常内对照上游引物5′-TGGTATCTGCAGCAGTTGCC-3′,共同下游引物5′-AGCCTCATGGTAGCAGAATC-3′。中国型Gγ+(Aγδβ)0-地贫:缺失上游引物5′-AGAAATTGCCTCATGTCTCT-3′,正常内对照上游引物5′-TGCAGGTAGTTGTTCCCCTTCA-3′,共同下游引物5′-GCTGGACACATATAAAATGCTGC-3′。引物由上海生物工程技术有限公司合成。
PCR反应体系如下,PCR混合液:12.5 μL,引物各1.0 μL,DNA模板2.0 μL,加水补充至25.0 μL。循环参数:94 ℃预变性5 min,94 ℃变性60 s,58/60 ℃退火30 s,72 ℃延伸2 min,共45个循环;72 ℃终末延伸5 min。取PCR产物5 μL进行琼脂糖凝胶电泳观察目的条带的大小和特异性。
1.3.3HbF水平相关SNP位点多态性检测 从NCBI数据库查找XmnI-HBG2(rs7482144),ANTXR1(rs4527238),BCL11A(rs4671393),HBS1L-MYB(rs28384513、rs9399137),KLF1(rs3817621、rs2072597、rs117351327),HBG1-HBD(rs10128556)的基因序列,针对各SNP位点用Primer premier 5.0软件设计引物,送上海生工生物工程技术有限公司合成,引物扩增序列见表1。PCR反应体系如下,PCR混合液:12.5 μL,上下游引物各1.0 μL,DNA模板2.0 μL,加水补充至25.0 μL。循环参数:95 ℃预变性5 min,95 ℃变性30 s,按退火温度退火30 s,72 ℃延伸45 s,共45个循环;72 ℃终末延伸5 min。取PCR产物5.0 μL进行琼脂糖凝胶电泳观察目的条带的大小和特异性,将PCR产物送上海生工生物工程技术有限公司Sanger测序。测序结果与GeneBank中的参考序列进行比对,对各SNP位点进行基因分型。
1.4统计学处理 用SPSS20.0软件进行数据处理及统计分析,计数数据以频数或百分率表示,组间比较采用χ2检验,并采用χ2检验判断各SNP位点基因型和等位基因频率分布是否符合Hardy-Weinberg平衡。以P<0.05为差异有统计学意义。
2 结 果
2.1缺失型HPFH检测结果 57份标本中,检出2份SEA-HPFH杂合突变复合β地贫(SEA-HPFH/CD17)。未检出中国型Gγ+(Aγδβ)0-地贫。电泳结果见图1。其中1例患者表现为轻度贫血[Hb:108 g/L,平均红细胞体积(MCV):75 fL,平均红细胞血红蛋白量(MCH):22.7 pg],另1例为中度贫血(Hb:88 g/L,MCV:64.2 fL,MCH:20 pg)。
2.2Sanger测序结果 检出55份nd-HPFH标本和50份对照标本各SNP位点基因型及等位基因频率分布见表2。根据Hardy-Weinberg平衡原理,对照组各SNP位点基因型频率分布的观察值和期望值比较,差异无统计学意义(P>0.05),表明入选人群各SNP位点的基因型和等位基因频率分布符合Hardy-Weinberg平衡。
BCL11A基因rs4671393和KLF1基因rs3817621位点基因型与等位基因频率分布在nd-HPFH标本与对照标本之间比较,差异有统计学意义(P<0.05),其余SNP位点基因型分布在nd-HPFH标本和对照标本之间比较,差异无统计学意义(P>0.05)。见表2。

表1 各SNP位点引物序列、扩增片段长度及退火温度
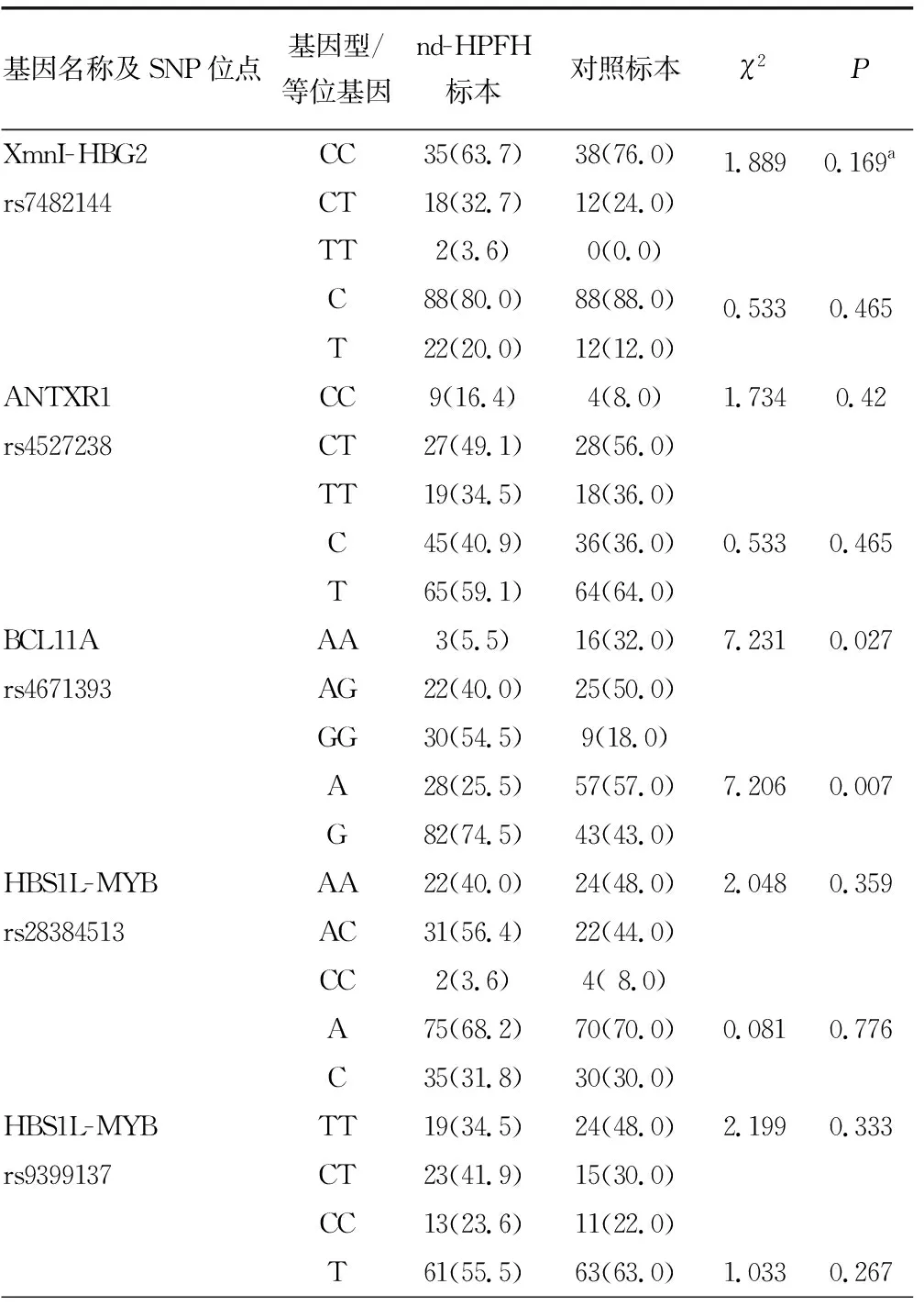
表2 各SNP位点基因型和等位基因频率比较[n(%)]
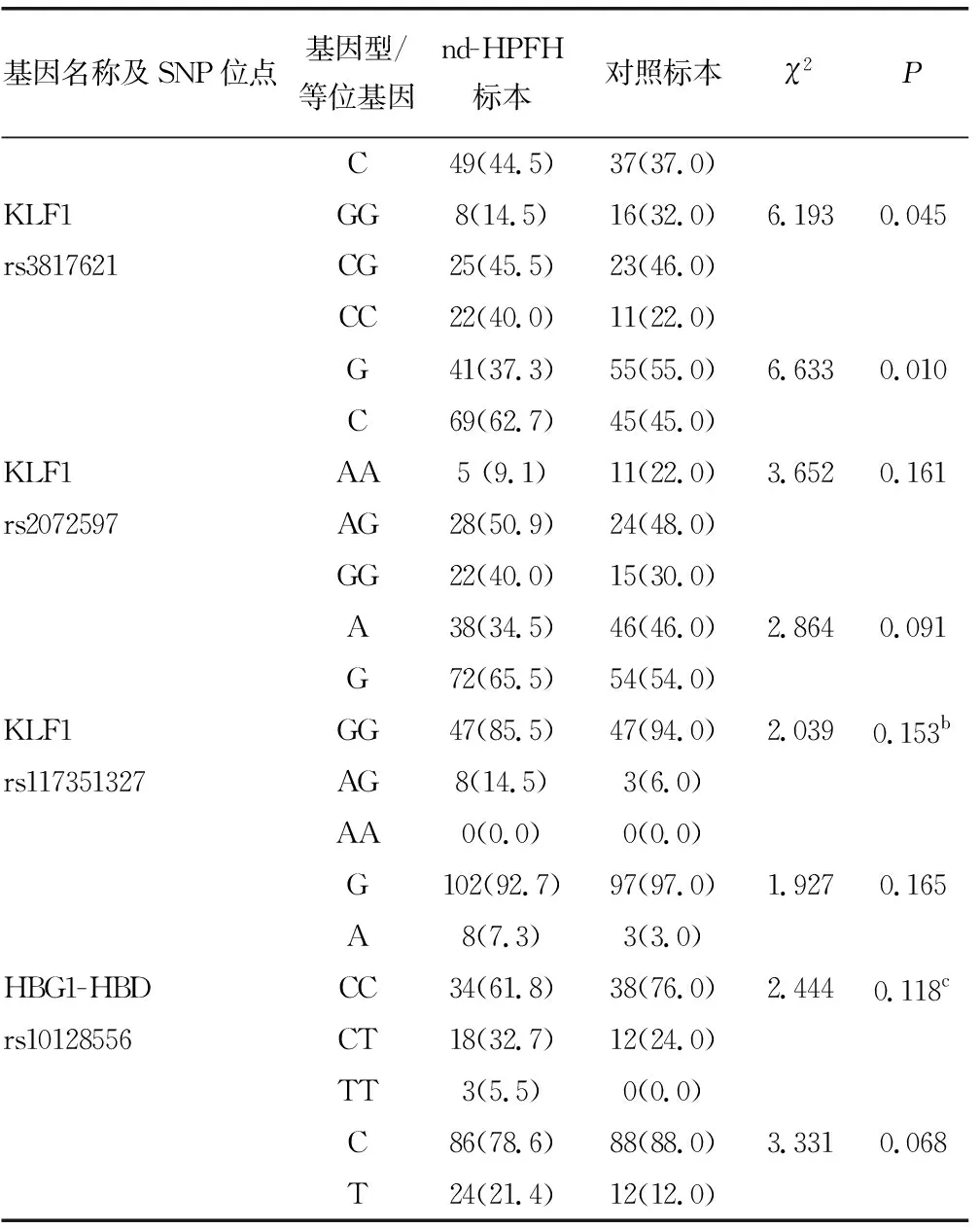
续表2 各SNP位点基因型和等位基因频率比较[n(%)]
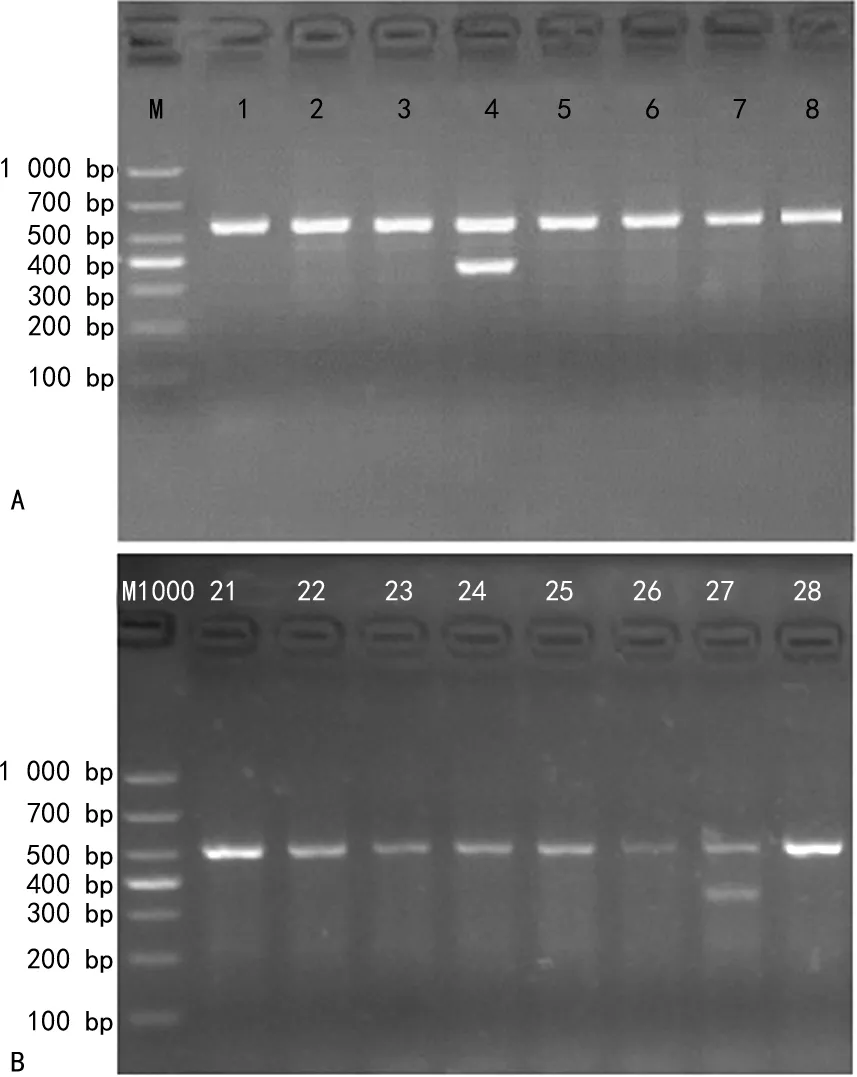
注:图A、B为SEA-HPFH电泳图,M为DL1000 DNA Marker;1~3、5~8、21~26、28为正常标本,4、27为阳性标本,565 bp为正常对照条带,376 bp为缺失截断片段。
3 讨 论
HPFH是一种具有高度遗传异质性的血红蛋白病,以成人期HbF持续性高水平为主要临床特征,HPFH遗传缺陷主要为β珠蛋白基因簇的大片段缺失及γ珠蛋白基因启动子区点突变。近年来,研究发现其他染色体上多个修饰基因的SNP位点与HbF水平相关,这些数量性状位点异常也可导致HPFH的发生[5,7-8]。
缺失型HPFH的分子机制主要涉及β珠蛋白基因簇上的δ、β及Aγ珠蛋白基因的缺失,在我国以中国型Gγ+(Aγδβ)0-地贫和SEA-HPFH最为常见[9-11]。本研究共检测到2例缺失型HPFH,基因型均为SEA-HPFH复合β地贫CD17杂合突变。这2例患者HbF水平高达96.5%。有文献报道,在SEA-HPFH复合β地贫CD41-42杂合突变时,其HbF水平同样高达96.5%,但临床仅表现为轻度贫血[12]。HPFH和β地贫的双重杂合子与单纯HPFH相比,具有较低的Hb水平及MCV、MCHC,本研究结果与文献报道一致[13]。HPFH基因携带者与β地贫基因携带者婚配后,存在生育HPFH和β地贫复合杂合子的子女的风险,子女临床可表现为重型或者中间型地贫。因此,诊断为β地贫的患者,如表型与基因型不符合,需要进一步检测是否同时为中国型Gγ+(Aγδβ)0-地贫或SEA-HPFH等缺失型HPFH。
nd-HPFH主要形成机制是γ珠蛋白基因启动子区的点突变或小片段缺失,影响转录调节因子与启动子区的结合,从而增强γ珠蛋白基因的表达,使HbF水平升高[14]。本研究扩增Gγ珠蛋白基因启动子区全长后直接测序,检出Gγ-158(C→T)具有SNP,即XmnI-HBG2 (rs7482144)的突变频率为20%。文献报道不同人群中rs7482144的基因突变频率为10%~30%[15]。TEPAKHAN等[16]的研究显示XmnI-HBG2(rs7482144)的突变频率为11.7%,低于本研究人群中该位点的突变频率。Gγ-158(C→T)基因多态性与HbF水平相关,在携带Gγ-158位点T等位基因的重、中度地贫及镰刀细胞贫血患者中HbF水平明显升高[17-18]。目前,关于在HPFH患者中Gγ-158(C→T)多态性与高水平HbF的相关性研究鲜见报道。本研究中,Gγ-158(C→T)基因型在nd-HPFH标本和对照标本中的分布差异无统计学意义(P>0.05),考虑该位点的基因型只有在某些特殊的病理状态及红细胞造血压力下才能提高γ珠蛋白基因的表达[19-20]。Gγ-158位点的等位基因T并不一定都表现为高水平HbF,而高水平HbF也不一定都存在Gγ-158位点的T碱基的变异。因此,仅Gγ-158(C→T)突变尚不足以使HbF水平明显升高,从而导致HPFH,推测可能该位点与其他基因中的SNP共同作用于γ珠蛋白基因,从而使HbF水平升高。
GWAS发现了与HbF水平升高相关的多个SNP位点,包括ANTXR1(rs4527238),BCL11A(rs4671393),HBS1L-MYB(rs28384513、rs9399137),KLF1(rs3817621、rs2072597、rs117351327)和HBG1-HBD(rs10128556)。本研究中BCL11A基因rs4671393位点和KLF1基因rs3817621位点基因型在nd-HPFH标本和对照标本中的分布差异有统计学意义(P<0.05),提示其在HPFH的发生中具有重要作用。BCL11A基因能够编码特异性造血转录因子,抑制γ珠蛋白表达,沉默BCL11A基因可增强γ珠蛋白基因表达。有关于BCL11A基因的实验研究表明,BCL11A基因作为转录抑制因子,对HbF水平起直接负调控的作用[21]。rs3817621位于KLF1基因启动子区,KLF1是红细胞生成发育过程中关键的细胞因子,对HbF水平的调节具有双重作用:一方面KLF1基因编码产物可直接与γ珠蛋白基因启动子结合,直接激活γ珠蛋白链的表达;另一方面KLF1作为红系特异性转录因子可与BCL11A基因启动子区结合,促进BCL11A基因表达,从而抑制γ珠蛋白基因表达[22]。ANTXR1(rs4527238),HBS1L-MYB(rs28384513、rs9399137),KLF1(rs2072597、rs117351327)和HBG1-HBD (rs10128556)位点基因型与等位基因频率在nd-HPFH标本和对照标本中的分布差异无统计学意义(P>0.05),推测这些基因的单个SNP位点对HbF水平的影响较小,不排除在部分HPFH中HbF水平升高是多个SNP位点共同作用的结果。
本研究发现贵州地区存在缺失型HPFH,并且BCL11A基因rs4671393和KLF1基因rs3817621位点多态性可能是导致nd-HPFH发生的遗传因素之一。
