基于尿酸酶-钯纳米粒子的比色分析定量检测血清尿酸的方法建立及初步应用评价*
2021-03-30邹瑟音凌连生黄文秀闫俊平
邹瑟音,雷 达,凌连生,黄文秀,闫俊平
1.广东省第二人民医院检验医学部,广东广州 510000;2.中山大学化学工程学院,广东广州 510000
尿酸(UA)是由黄嘌呤氧化酶作用于DNA和RNA降解产生的嘌呤代谢产物,越来越多的试验数据表明UA对人体有着非常重要的影响[1-2],因此,实时监测体内UA水平,掌握其水平变化显得尤为重要。不同的技术已被应用到体内外血清UA水平的检测,包括电化学方法、荧光检测技术、酶化学法、磷钨酸比色法、干化学法和质谱法等[3-5]。纳米技术的出现为UA的检测方法研究拓宽了新的方向,越来越多的研究者致力于UA检测新技术的研究[6-9],然而将研究成果用于临床常规检测则比较少见。笔者在前期研究中发现嵌于三聚氰胺氰尿酸盐中的钯纳米粒子(MCA-Pd NPs)具有较强的过氧化物酶活性[10-11],因此建立了基于尿酸酶-MCA-Pd NPs的UA检测体系,并对该检测体系进行专一性试验、线性范围确定、重复性试验、回收试验、与常规检测方法比较等方法学评价,为将其应用于临床血清UA检测奠定基础。现报道如下。
1 材料与方法
1.1材料来源 40份血清标本来源于广东省第二人民医院门诊及住院患者,其中UA检测水平为低值为(108.0~195.0 μmol/L)13例、中值者(250.0~398.0 μmol/L)13例、高值者(450.0~820.0 μmol/L)14例。
1.2仪器与试剂 三聚氰胺、三聚氰酸(比利时Acros Organics公司);无水柠檬酸、无水乙酸钠、UA、醋酸[阿拉丁试剂(上海)有限公司];氯化钯、2,2′-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS2-)[生工生物工程(上海)有限公司];浓盐酸(广州化学试剂厂);尿酸酶(上海瓦兰生物科技有限公司);所有试验过程中所用的水皆为超纯水,且所用试剂均为分析纯。UV-2550紫外-可见分光光度计(日本岛津公司);日立7600生化分析仪;B-260恒温水浴锅(上海亚荣生化仪器厂);85-2型恒温磁力搅拌器(巩义市予华仪器有限责任公司)。
1.3方法
1.3.1MCA-Pd NPs的合成 根据试验室前期研究成果合成性质稳定、具有高过氧化物酶活性的MCA-Pd NPs[12],室温贮存备用。
1.3.2分析条件 以ABTS2-为显色底物,10 μL待测UA样品+50 μL 1.6 g/L尿酸酶+100 μL 0.105 mg/mL MCA-Pd NPs+50 μL 90 mmol/L ABTS2-,反应温度为37 ℃,反应时间为20 min。
1.3.3比色分析 所有标本的比色分析均使用UV-2550紫外-可见分光光度计在420 nm处进行吸光度值检测。
1.3.4UA标准溶液的制备及线性范围的确定 准确称取适量的UA标准品,用超纯水充分溶解,此溶液为5 mmol/L UA标准储备液,于4 ℃保存;临用前,将储备液用超纯水稀释至2 mmol/L UA,此为UA标准应用液,再稀释成系列浓度的溶液(10.0、20.0、50.0、100.0、200.0、400.0、600.0、800.0 μmol/L,以及1.0、1.1、1.2、1.4、1.6 mmol/L)。通过测定这一系列浓度UA标准品的吸光度值,获得浓度与吸光度的关系曲线。
1.3.5检测UA的专一性 为研究该方法检测UA的专一性,笔者将UA分别替换成超纯水、葡萄糖、胆固醇、高密度脂蛋白和低密度脂蛋白,进行比色分析。
1.3.6重复性试验 用空白基质配制89.0、297.0和714.0 μmol/L UA质控品,分4个批次检测,每批次重复测定5次,计算批内变异系数(CV)和批间CV。
1.3.7回收试验 制备基础样品及分析标本1、2、3,分别用本研究建立的检测体系检测其UA浓度,每份样品作双份检测。
1.3.8临床标本检测 40份临床血清标本分别用本研究建立的检测体系和日立7600生化分析仪进行UA水平检测,严格按试剂盒说明书操作。
1.4统计学处理 所有数据用Microsoft Excel2003和SPSS17.0进行处理和统计分析,不同试验组间的结果差异采用单因素方差分析,方法之间的相关性采用线性回归分析。P<0.05表示差异有统计学意义。
2 结 果
2.1检测UA的专一性 加有UA的f管液体由无色转变为绿色,而a、b、c、d和e 5管液体仍表现为无色,在420 nm波长处,f管的吸光度值均比另外5管高,差异有统计学意义(P<0.05),说明尿酸酶-MCA-Pd NPs检测体系只对UA有反应,具有较高的选择性。见图1。

注:a为超纯水;b为葡萄糖;c为胆固醇;d为高密度脂蛋白;e为低密度脂蛋白;f为UA;与f管比较,*P<0.001。
2.2线性范围的确定 浓度与吸光度值呈线性相关的浓度范围为50.0~1 000.0 μmol/L,其线性回归方程为Y=0.000 1X+0.063 3,r=0.994 3。见图2。
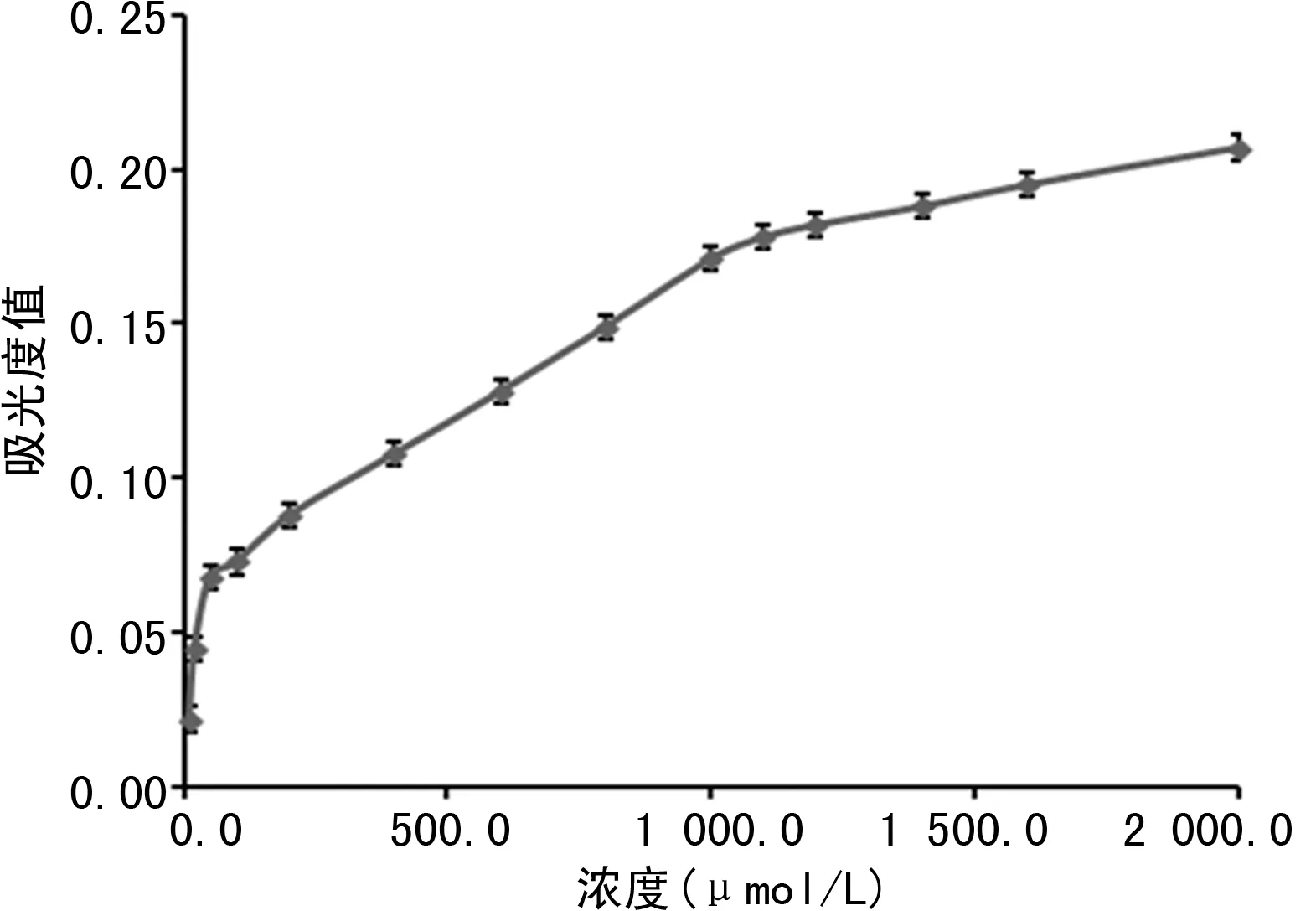
图2 线性范围的确定
2.3重复性试验 3种浓度的批内CV分别为:3.51%、2.86%、3.05%,批间CV分别为7.63%、5.12%、7.25%。见表1。
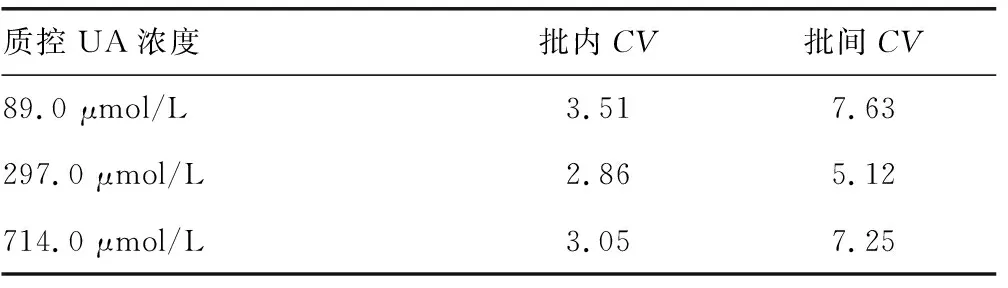
表1 尿酸酶-MCA-Pd NPs检测体系的精密度(%)
2.4回收试验 UA回收率为97.0%~104.0%,见表2。

表2 UA回收试验结果
2.6新建方法与生化分析仪检测结果比对 经线性回归分析,回归方程为Y生化分析仪=0.996 4X新建方法-0.475 4,r=0.995 8。见图3。
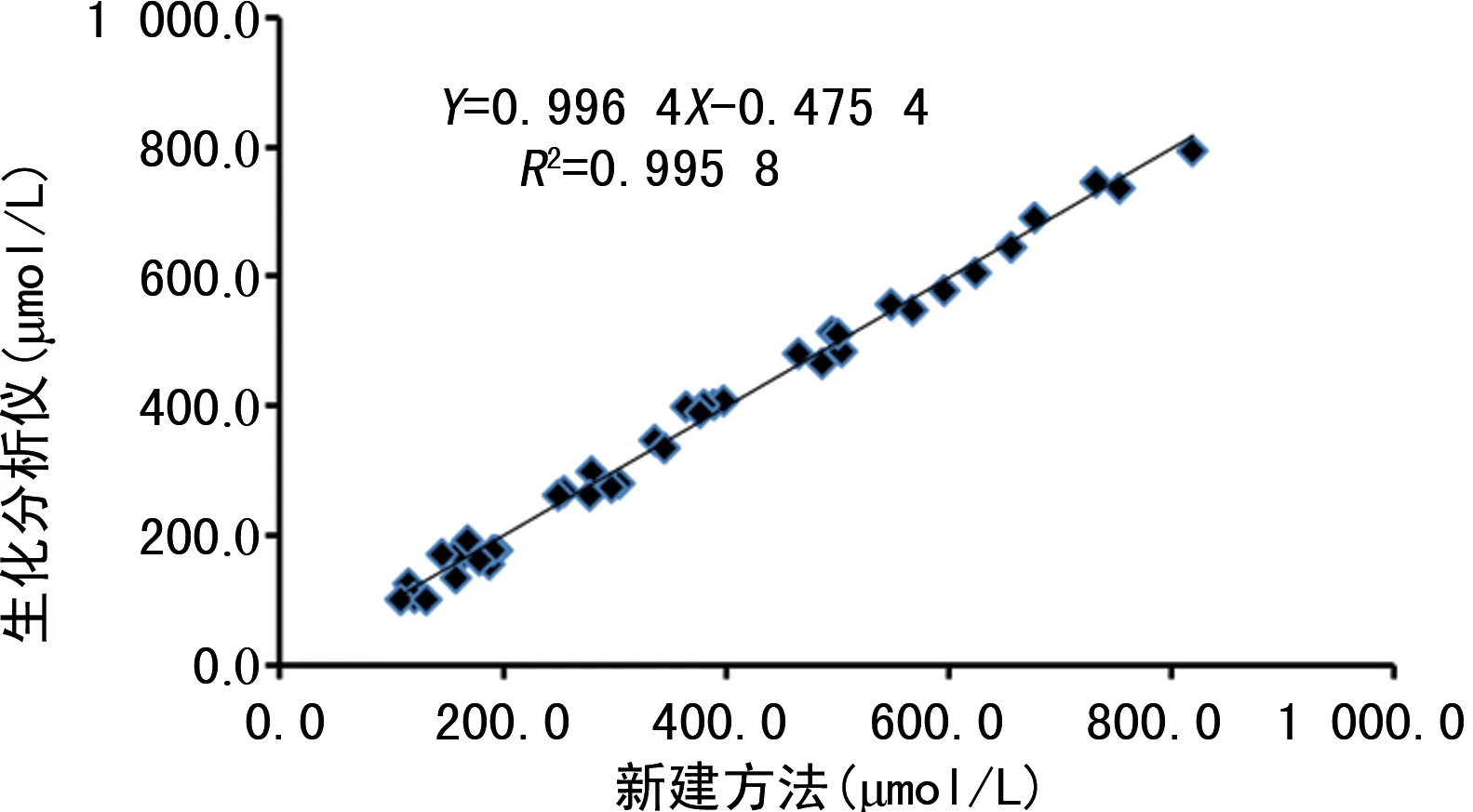
图3 新建方法与生化分析仪检测结果比对
3 讨 论
纳米材料模拟酶与天然酶具有一定的相似性,而与天然酶相比,其具有可通过化学手段批量合成、制备工艺简单、稳定性好、便于运输和长期储存、适合进行化学修饰和改性等优点。因此,纳米材料模拟酶的研究受到越来越多的关注,如四氧化三铁磁性纳米粒子(Fe3O4MNPs)、贵金属纳米粒子、碳基纳米材料等被发现具有过氧化物酶活性[11],并被应用到生物传感、免疫分析、癌症诊断与治疗、神经保护、环境治理等领域。该检测体系是基于尿酸酶-MCA-Pd NPs建立起来的,MCA-Pd NPs具有强的过氧化物酶活性,促进体系中产生的过氧化氢分解成羟基自由基,再进一步将底物ABTS2-氧化为显绿色的自由基ABTS·-,液体由无色转变成绿色,在420 nm处有最大的吸收峰,MCA-Pd NPs在检测体系中发挥着促进信号产生及传递的作用,而尿酸酶对它的底物有严格的选择性,专一催化UA发生化学反应[12],因此,在专一性试验时,将临床常规检测中与UA采用相同检测原理的葡萄糖和胆固醇类物质作为对照,结果得到的吸光度值都很低,说明该方法用于UA检测几乎不受这类物质的干扰,确保了体系检测UA的高选择性。
FANG等[13]和LONG等[14]应用同样具有过氧化物酶活性的双掺NaYF4纳米粒子进行尿酸酶催化比色法检测,检测限分别低至5.79、6.7 μmol/L,而本研究所建立检测方法的测定下限只有50.0 μmol/L,与前者相比有一定差距,但是在实际临床检验中,大部分的标本检测结果是正常或者高值,低值尤其是<60.0 μmol/L的标本较少见,对低值的检测临床意义不大,而UA高值对临床诊断痛风、高尿酸血症等疾病及治疗效果监测更有临床意义,因此50.0 μmol/L的检测下限也能满足临床的需要。
目前,临床实验室的大型生化分析仪普遍使用的是尿酸酶-过氧化物酶偶联法进行血清UA的常规检测,该方法采用的过氧化物酶为天然的植物酶,具有性质不稳定、在生物体水平较低、提纯及储存较困难等缺点,限制了它的实际应用。本研究建立的检测体系与临床大型生化分析仪有良好的可比性,而该检测体系应用的纳米材料模拟酶MCA-Pd NPs通过简单的化学合成即可大量获取,性质稳定,易于储存,比天然酶更具有应用前景。此外,除UA外,目前临床中还有许多常规检验项目如血糖、5′-核苷酶、总胆固醇、三酰甘油、高密度胆固醇和低密度胆固醇等都会用到过氧化物酶参与的检测原理,只需将检测体系中的尿酸酶换成其他特异酶如葡萄糖氧化酶等,即可对特定物质进行检测,因此,该检测体系具有灵活、简便、检测成本低、应用广泛等实用价值。
本研究应用具有过氧化物酶活性的MCA-Pd NPs,建立基于尿酸酶-MCA-Pd NPs的血清UA浓度定量检测方法,检测选择性高,线性范围宽,重复性好,准确度高,能够满足临床分析要求,与临床常规测定血清UA水平的结果具有较好的可比性。
