子宫腺肌病原代内膜间质细胞培养及功能学鉴定
2021-03-24徐小云刘发英万磊
徐小云 刘发英 万磊

[摘要] 目的 分離提纯培养子宫腺肌病(AM)内膜间质细胞(ESc),检测其细胞功能的差异,为进一步的细胞及分子水平研究奠定基础。 方法 选取2013年1月至2016年12月份在本院治疗的正常子宫内膜和子宫腺肌病手术病例,在严格无菌条件下,收集临床确诊的AM患者在位子宫内膜组织12例、异位子宫内膜组织41例及正常对照内膜组织13例,分别分离培养ESc,并通过免疫组织化学法对分离提纯培养的细胞进行鉴定。分别检测三种细胞的增殖、迁移、侵袭和凋亡等细胞功能。 结果 正常人ESc 13例,AM患者在位12例、异位ESc原代分离41例均成功,成功率为100.00%。与正常在位ESc相比,在位、异位ESc在普通光镜下,形态观察无明显差异,但是细胞功能方面,在位ESc生长曲线显示增殖率明显升高;异位ESc的迁移、侵袭率水平升高,差异有统计学意义(P<0.01),三种细胞凋亡无明显差异。 结论 采用间质细胞原代培养方法可以成功培养AM ESc,并保持较高的细胞培养成功率。在位ESc增殖率最高,异位ESc的迁移、侵袭率水平升高,细胞凋亡均无明显差异。
[关键词] 子宫腺肌病;原代细胞;细胞培养;细胞功能
[中图分类号] R711.7 [文献标识码] A [文章编号] 1673-9701(2021)03-0032-06
Culture and functional identification of primary mesenchymal cells in adenomyosis
XU Xiaoyun1 LIU Faying2 WAN Lei1
1.Department of Quality Control, Jiangxi Maternal and Child Health Hospital, Nanchang 330006, China; 2.Central Laboratory, Jiangxi Maternal and Child Health Hospital, Nanchang 330006, China
[Abstract] Objective To isolate, purify and culture endometrial stromal cells (ESc) of adenomyosis (AM), and to detect the difference of cell function, so as to lay a foundation for further research at the cellular and molecular levels. Methods The normal endometrial and adenomyosis surgical cases treated in our hospital from January 2013 to December 2016 were selected. Under strict aseptic conditions,12 cases of eutopic endometrial tissues,41 cases of ectopic endometrial tissues and 13 cases of normal control endometrial tissues of clinically diagnosed patients with AM were collected.ESc were isolated and cultured, and the isolated and purified cells were identified by immunohistochemistry. The proliferation, migration, invasion and apoptosis of the three types of cells were detected. Results 13 cases of normal human ESc, 12 cases of patients with eutopic AM and 41 cases of ectopic ESc were successfully isolated, with a success rate of 100.00%. Compared with normal eutopic ESc, the morphology of eutopic and ectopic ESc was not significantly different under ordinary optical microscope, but the proliferation rate of eutopic ESc was significantly increased in terms of cell function. The migration and invasion rates of ectopic ESc were significantly increased(P<0.01), and there was no significant difference among the three types of apoptosis. Conclusion AM ESc can be successfully cultured by using the primary culture method of mesenchymal cells, and a high success rate of cell culture can be maintained. The proliferation rate of eutopic ESc is the highest, the migration and invasion rate of ectopic ESc increases, and there is no significant difference in apoptosis.
[Key words] Adenomyosis; Primary cells; Cell culture; Cell function
子宫腺肌病(Adenomyosis,AM)是子宫内膜中的腺体和间质细胞侵入子宫肌层,并在其中弥漫或局限性生长的一种良性疾病,多发于育龄期女性,经产妇多见,可能与剖宫产、人工流产等宫腔操作手术量的增加有关。AM的主要临床表现为经期延长、淋漓不尽、经量增多、进行性加重的痛经和生育能力降低,从而大大降低了这类女性的生活质量,特别是有生育要求的妇女。近年来,AM发病率呈明显的上升趋势,且发病年龄年轻化,临床对该病的重视程度也日益增加。AM的发病机制涉及面很广,也尚未完全明朗,现广泛认为其发生发展受多种因素影响和控制[1]。目前常见和研究较多的方向主要为子宫基底内膜缺陷、局部免疫因素、血管生成能力、生长因子的作用、细胞凋亡功能的改变和甾体激素水平的变化[2-5]等。AM虽然表现为一种良性疾病,但却具有恶性肿瘤的生长特点,有研究指出,与正常子宫内膜细胞相比,AM异位内膜细胞的增殖能力较强,而细胞凋亡减弱,这种细胞增殖能力与凋亡水平的失衡可能就是这种疾病的发病机制之一[6-7]。本课题旨在研究在AM患者在位、异位子宫内膜组织中提取、分离出子宫内膜间质细胞(Endometrial stromal cells,ESc);找出AM异位ESc与正常ESc在细胞功能学上的差异,以求从分子水平找到子宫腺肌病的发病机制,现报道如下。
1 材料与方法
1.1 实验材料
1.1.1 标本采集 选取2013年1月至2016年12月在本院治疗的正常子宫内膜和手术后经病理证实的子宫腺肌病患者在位内膜和异位内膜组织,按照课题设计的纳入标准入选。
1.1.2 主要仪器 倒置显微镜(Nikon有限公司)、荧光倒置显微镜(日本Olympus公司)、二氧化碳培养箱(美国SHEL LAB公司)、酶标仪(美国Bio-RAD公司)、96孔板(Costar 公司)、Transwell小室(美国BD公司)、800台式低速离心机(上海医疗器械有限公司)、低温离心机(美国Thermo Scientific公司)、LT电子天平(美国Mettler公司)、微量移液器(德国Eppendorf公司)、超低温箱(-80℃,日本Sanyo公司)、液氮罐(四川亚西橡胶机器有限公司)、数显恒温水浴锅(上海浦光仪器厂)、SW-CJ-2FD型超净化工作台(苏州净化设备有限公司)、立式高压蒸汽灭菌器(上海博迅实业有限公司)。
1.1.3 主要试剂 DMEM/F-12培养基(Hyclone公司)、胰蛋白酶消化液、RIPA液(Solarbio公司)、胎牛血清(Fetal bovine serum,FBS,Hyclone公司)、磷酸缓冲盐溶液(Phosphate buffer saline,PBS,索莱宝公司)、青霉素、链霉素混合液(Biopopped公司)、SDS(美国Sigma公司)、溴酚蓝(美国Sigma公司)、Tris-base(Tocris Bioscience公司)、DAB显色试剂盒(中杉金桥公司)、波形蛋白、角蛋白、山羊抗兔抗体(中杉金桥公司)、BD Pharmingen 556547Annexin V FITC APOPTOSIS Detection KIT Ⅰ(美国BD公司)、结晶紫、BD Matrigel(美国BD公司)。
1.2 实验方法
1.2.1 入选及分组标准 本研究选择的子宫腺肌病组为2013年1月至2016年12月在江西省妇幼保健院行手术治疗,术后病理诊断为子宫腺肌病患者,入选41例;患者平均年龄(40.75±2.95)岁,取月经增殖期在位子宫内膜组织12例及子宫腺肌病病灶组织41例。正常对照组为同期的卵巢良性肿瘤(经病理检查证实属单纯囊肿,畸胎瘤等)的患者,入选13例;患者平均年龄(45.55±3.52)岁,取月经增殖期在位子宫内膜组织。入选的所有患者均已排除了各类肿瘤、内分泌疾病、结核、近半年甾体类激素治疗等病史,且未处于哺乳期。所有标本采集申请经本院医学伦理委员会审核通过,并经患者知情同意。
1.2.2 取材方法 新鲜的子宫内膜离体后,无菌存放,迅速以冰盒转运,组织经无菌PBS液冲洗干净后,用无菌组织剪剪碎后分两部分处理:①分装至冻存管,经液氮预处理,随后保存于-80℃冰箱中;②进行一下步的分离ESc。
1.2.3 子宫内膜间质原代细胞分离培养 在取得新鲜AM在位、异位及正常人子宫内膜组织时需严格遵循无菌要求,立体后即刻放入冰盒转运至实验室(此过程需在30 min之内完成)。在文献[8]中提供的EMs原代细胞培养方法的基础上,不断实践及改良,摸索出AM ESc原代分离的方法。具体分离操作:①将新鲜离体的子宫内膜组织放入超净台,PBS冲洗干净后用灭菌组织剪剪碎至大小为0.5~1.0 mm3的组织碎片;②将组织碎片加入以9∶1的比例配置DMEM/F-12和稀释的Ⅳ型胶原酶的混合培养液;③上述混合物混匀后转移至10 mL离心管,再置入恒温水浴锅(37℃,2~3 h)消化,间隔15~20 min混匀一次;④消化后的组织悬液分别过80目和300目灭菌筛网(注:过80目和200目筛网,200目筛网上的未滤过组织离心可获得原代腺上皮细胞,因原AM代上皮細胞无法传代,细胞数量无法达到功能学检测的要求,故未赘述);⑤过滤液离心(1000 r/min、6~8 min)2次,其间以PBS液吹匀;⑥离心完毕后组织加入含10% FBS DMEM/F-12培养液重悬,移入培养瓶,孵箱培养(37℃,5% CO2,3~4 h);⑦24 h内即可观察到细胞贴壁,更换培养液得到ESc,一般原代培养ESc 5~7 d可长满。
1.2.4 子宫内膜间质细胞性质鉴定 通过免疫组织化学方法检测ESc中波形蛋白、角蛋白的表达,具体步骤为:①培养:将细胞接种至六孔板培养,划分为三组:波形蛋白组、角蛋白组、空白对照组,细胞生长至80%时进行操作;②固定:4%多聚甲醛固定,4℃条件下避光处理30 min;③封闭:3% H2O2封闭内源性过氧化物酶,室温下静置10 min后PBS轻柔清洗;④孵育抗体:一抗:在三个组分别加入波形蛋白稀释液(1∶70)、角蛋白稀释液(1∶100)、PBS,量以铺满细胞为宜,孵箱孵育1 h;二抗:PBS冲洗后,加山羊抗兔(1∶500)孵箱孵育30 min;⑤显色:DAB显色10 min;⑥苏木素复染0.5 min,自来水返蓝后在荧光显微镜下观察。
1.2.5 细胞功能检测
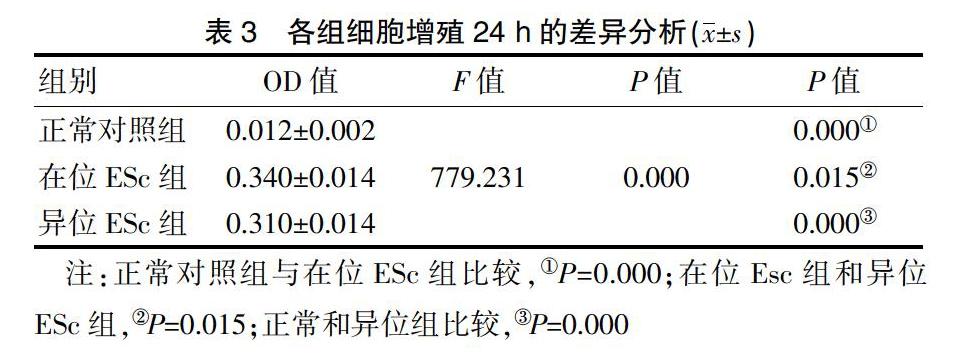
1.2.5.1 CCK8法检测细胞增殖功能 备制单细胞悬液,细胞计数后,将细胞密度调整为1×104个/mL接种于96孔板内,每种细胞接种5个复孔,并设置一调零孔,只加100 μL培养基,周围用PBS填充,共接种4块96孔板,孵箱孵育(37℃,5% CO2);分别于12、24、48、72 h取出一块96孔板,观察细胞贴壁情况,每孔加入CCK8溶液10 μL后孵育4 h;酶标仪检测以上各孔吸光率,即OD值(波长:450 nm)。共选择正常、在位、异位细胞各10例进行重复试验。
1.2.5.2 Transwell法检测细胞的迁移和侵袭功能 迁移功能的检测使用Transwell chambers,将细胞消化后用无血清的DMEM培养基重悬,细胞悬液进行细胞计数。每个迁移试验小室的下部以含20%胎牛血清的500 μL DMEM填充,每个小室的上部接种约1×105个细胞。孵箱孵育22 h后,用100%甲醇固定(室温,10~30 min),0.5%结晶紫染15~30 min,在显微镜下观察Transwell膜底部的细胞数量,每个小室随机选择9个视野,取平均值进行统计。侵袭功能也是通过这种方式进行,不同的是Transwell上室底部以Matrigel覆盖,余步骤相同。共选择正常、在位、异位细胞各10例进行重复试验。
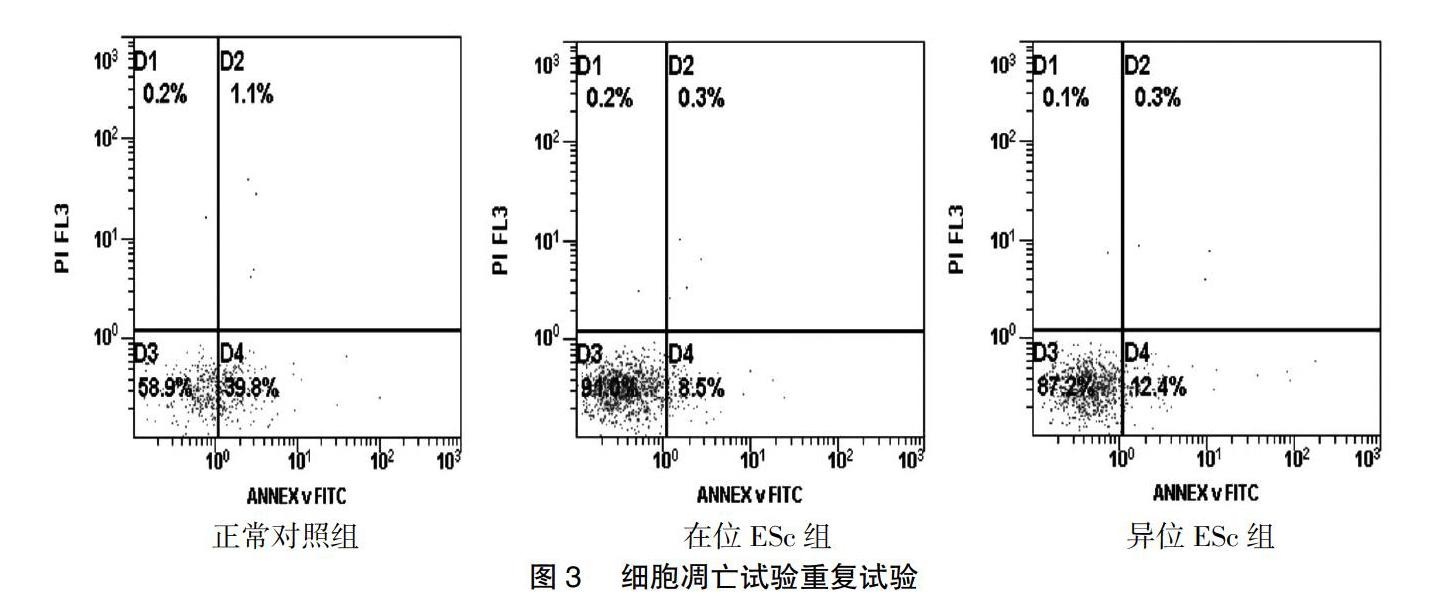
1.2.5.3 Annexin V-PI双染色法检测细胞凋亡 取105个细胞,离心(1000 r/min,5 min),每管加入100 μL Binding Buffer,重悬,按分组分别加入以下试剂:①空白对照:无染料加入;②对照a:加入5 μL Annexin V-FITC;③对照b:加入5 μL PI;④样本管:加入5 μL Annexin V-FITC和5 μL PI。室温下避光孵育15 min,分别加入400 μL的Binding Buffer,吹打混匀后在1 h内上机,流式细胞仪检测细胞凋亡率。共选择正常、在位、异位细胞各10例进行重复试验。
1.3 统计学方法
采用SPSS 21.0统计学软件处理数据。采用方差分析后多重比较来分析各类间质细胞数量,计量资料用均数±标准差(x±s)表示,采用F检验,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 AM子宫内膜间质原代细胞分离培养
收集培养的三组组织均分离培养成功,成功率可达100.00%。在普通光学显微镜下观察可见ESc贴壁生长,形态呈长梭形,细胞核圆形,基本居中。
2.2 AM子宫内膜间质原代细胞波形蛋白鉴定
分离的每株细胞均进行细胞鉴定,分别用波形蛋白抗体、角蛋白抗體、空白对照液体对ESc进行鉴定,DAB显色。细胞鉴定结果(封三图1)显示:波形蛋白抗体组AM细胞的胞质呈棕黄色改变(封三图1a),角蛋白抗体组(封三图1b)和空白对照组(封三图1c)的AM细胞胞质不显色。
2.3 AM异位ESCs和正常对照ESCs细胞功能学的差异
2.3.1 细胞增殖检测 CCK8法以细胞生长时间及对应的OD值做细胞生长曲线,在各组细胞试验中,除1次出现细胞污染,其余组别均试验成功,先取其中一次结果显示(表1,封三图2),在位ESc组>异位ESc组>正常对照。将获取的各组细胞在五个不同时间点的OD值,采用单因素方差分析,进行组内比较后在进行多重比较,探讨其统计学意义,结果显示,三组细胞在5个时间点两两比较,差异均有统计学意义(P<0.05)。见表2~6。
2.3.2 细胞迁移检测 10组细胞的Transwell重复试验结果一致,均显示间质细胞的迁移能力:子宫腺肌病异位ESc组>子宫腺肌病在位ESc组>正常对照组(封三图3,其中a为正常对照组,b为子宫腺肌症在位Esc组,c为子宫腺肌病异位ESc组),三组比较差异有统计学意义(P<0.05)。见图1,表7。
2.3.3 细胞侵袭检测 10组细胞的Transwell重复试验结果一致,显示间质细胞的侵袭能力:异位ESc组>在位ESc组>正常对照组,经统计差异有统计学意义(P<0.05)。见封三图4,图2,表8。
2.3.4 细胞凋亡的检测 10组细胞凋亡试验重复试验结果一致,流式细胞仪检测细胞凋亡结果比较,差异无统计学意义(图3)。
3 讨论
子宫肌腺病是由于子宫内膜中的成分入侵子宫肌层,弥漫性或局限性生长而导致的。此病在育龄期妇女较为常见,保守治疗效果不佳且发病率逐年升高,日渐引起了人们的关注。既往研究认为AM在疾病发生、发展上与子宫内膜异位症(Endometriosis,EMs)有很多相似之处[9],但是随着对这两种疾病研究的不断深入,研究发现AM与EMs除了发病部位外,还有很多的不同,所以现在AM已经渐渐的与EMs区分开来,进行单独的研究。AM的发病机制涉及因素较多,研究并不深入,目前可查阅的国内外文献报道中主要涉及以下因素:①子宫内膜的侵入学说;②甾体激素,尤其是雌激素的影响最为深入也研究的最多[4,10];③细胞功能的改变:如增殖和凋亡调控的失常;④整体和局部的免疫异常;⑤基质金属蛋白酶(Matrix metalloproteinase,MMPs)的表达异常[11];⑥腺苷酸依赖的蛋白激酶(Adenylate dependent protein kinase,AMPK)的高表达[13]。
子宮腺肌症因既往归类于子宫内膜异位症,其单独的细胞功能学研究可查阅的资料有限。近年来,研究已证实MMPs在AM中起着非常重要的作用,MMPs是细胞外基质降解和重建过程中最关键的一组蛋白酶,在它的作用下初期向子宫肌层侵润的细胞是子宫内膜间质细胞,继而是内膜腺细胞侵润。郭凤羽等[12]发现,不论是mRNA水平还是蛋白水平,孕激素受体的表达在腺肌症小鼠子宫中低于正常小鼠,雌激素受体和MMP-2的表达高于正常小鼠,这些结果与腺肌症形成中对雌激素敏感,对孕激素耐受,侵袭性增加密切相关,可能是腺肌症发病机制的分子基础。黄毓菲等[14]研究发现在AM的在位内膜中,M2型丙酮酸激酶(M2 Pyruvate kinase,PKM2)的蛋白和mRNA水平均高于正常的子宫内膜组织。这种高表达的AMPK蛋白水平可能导致AM在位内膜组织糖酵解水平增高,为异位内膜组织提供能量,易于其细胞的增殖和黏附,从而促进了疾病的发生发展,这也有可能是腺肌症致病的一个途径。在中医药领域,某些中药与抗肿瘤药物的结构相似,也能够辅助机体产生抗肿瘤免疫反应。莪术醇为新的抗肿瘤中药单体之一,主要通过诱导细胞凋亡、减少细胞增殖来发挥作用,对子宫颈癌、胃癌、肝胆管癌RBE细胞、人胶质瘤U87细胞、人脑胶质瘤U251细胞和鼻咽癌等肿瘤细胞的增殖有抑制作用[15]。赵静等[16]用不同质量浓度莪术醇作用于AM异位内膜细胞,结果显示,与对照组比较,各种浓度的莪术醇药物干预组24、48 h后,AM异位细胞增殖率、迁移率均降低,凋亡率均升高,差异有统计学意义(P<0.05)。这也提示莪术醇可能对子宫腺肌症有一定的治疗作用。
在前期准备工作的基础上,本实验通过改良AM原代细胞培养方法培养子宫内膜间质细胞,取得了比较好的分离培养的效果。在此基础上总结出了AM原代细胞分离培养困难的关键点:①取材:离体组织的新鲜程度是成功的关键,在尽量短的时间内进行冰盒转运、分离培养;全程无菌操作是成功的保证。②分离:剪碎组织的过程要快速、剪成糊状最好,这样可以缩短消化时间,同时也能减少各类因素对细胞的破坏。③培养:培养基内可加入双抗(青霉素、链霉素混合液)以减少细胞污染率。本实验在以往子宫内膜原代细胞的分离、培养方法上进行研究改进.摸索出一种高效的AM原代细胞培养方法。其优点在于:①本实验细胞传代消化采用10:9的比例配置0.25%的Ⅳ型胶原酶-胰蛋白酶-EDTA与PBS的混合液作为消化液混合液作为细胞消化液,这个比例可以快速消化细胞,并且不损伤细胞传代后生长的能力,提高了组织消化后的细胞存活效率。②经分离提纯的原代AM间质细胞科稳定传代6~10代,并且能保持较高分离培养成功率,为后期的实验提供实验基础。本课题研究发现:①AM异位ESc的增殖能力远高于在位Esc和正常人子宫内膜ESc;②AM异位ESc的细胞迁移和侵袭水平均高于AM在位和正常人子宫内膜的ESc,且具有有统计学意义;③细胞凋亡水平未见明显差异,后期会再提高细胞数量,严格控制实验点在细胞对数期范围内再次进行验证。此一系列结果为后期从分子水平上对AM相关发病机制的研究提供了前期的基础和实验的平台。
[参考文献]
[1] Lacheta J.Uterine adenomyosis:Pathogenesis,diagnostics,symptomatology and treatment[J].Ceska Gynekol,2019, 84(3):240-246.
[2] Harmsen MJ,Wong CFC,Mijatovic V,et al.Role of angiogenesis in adenomyosis-associated abnormal uterine bleeding and subfertility:Asystematic review[J].Hum Reprod Update,2019,25(5):647-671.
[3] Emmanuel I,Ochigbo A,Philip A,et al.Adenomyosis:A clinico-pathological study[J].West Afr J Med,2019,36(1):88-92.
[4] Artymuk N,Zotova O,Gulyaeva L,et al.Adenomyosis:Genetics of estrogen metabolism[J].Horm Mol Biol Clin Investig,2019,37(2):15.
[5] De Wilde RL,Wallwiener M,Di Spiezio Sardo A,et al.Adenomyosis and myomata: Risks,problems,and complications in diagnosis and therapy of adenomyosis and myomata[J].Biomed Res Int,2018,5:952,460.
[6] Chen L,Li C,Guo J,et al.Eutopic/ectopic endometrial apoptosis initiated by bilateral uterine artery occlusion:A new therapeutic mechanism for uterus-sparing surgery in adenomyosis[J].PLoS One,2017,12(4):e0175 511.
[7] Zeng YY,Li KY.Effects of Jiawei Shaoyao-Gancao decoction and its drug-containing serum on proliferation,apoptosis,and iltrastructure of human adenomyosis foci cells[J].Evid Based Complement Alternat Med,2017,17:7 821 095.
[8] Brosens JJ.Progesterone receptor regulates decidual prolactin expression in differentiating human endometrial stromal cells[J].Endocrinology,1999,140(10):4809-4820.
[9] Leyendecker G,Bilgicyildirim A,Inacker M,et al.Adenomyosis and endometriosis.Re-visiting their association and further insights into the mechanisms of auto-traumatisation an MRI study[J].Arch Gynecol Obstet,2015,291(4):917-932.
[10] 高阳.子宫腺肌病恶变的研究进展[J].国际妇产科学杂志,2018,45(2):171-174.
[11] Zayratyants OV,Adamyan LV,Manukyan LM,et al.The expression of moesin,p21-activated kinase 4(PAK 4),matrix metalloproteinases (MMP2,MMP9),and CD34 in the eutopic and ectopic endometrium in adenomyosis[J].Arkh Patol,2018,80(6):14-21.
[12] 郭凤羽,王宁.FKBP52、PR、MMP-2和ER在小鼠腺肌症子中的表达和意义[J].中国计划生育学杂志,2018,6(26):434-438.
[13] Jin L,Chun J,Pan C,et al.Phosphorylation mediated activation of LDHA promotes cancer cell invasion and tumor metastasis[J].Oncogene,2017,36(27):3797-3806.
[14] 黃毓菲,杨阳,邵倩倩,等.腺苷酸依赖的蛋白激酶在子宫腺肌症中的表达及其作用[J].山东大学学报 (医学版),2019,57(2):93-98.
[15] 郭平,梁广,杨树林.莪术醇的医药研究进展[J].中国医药,2016,11(5):768-772.
[16] 赵静,周江妍,万腊根.莪术醇对子宫腺肌症异位子宫内膜间质细胞增殖、凋亡及迁移的影响[J].南昌大学学报(医学版),2019,59(4):12-16.
(收稿日期:2020-09-09)
