ACC处理对不同基因型玉米幼苗响应氮素供给的调控效应
2021-03-18吴冰卉王桂萍王玉斌李召虎张明才
吴冰卉 王桂萍 王玉斌 李召虎 张明才
植物生长调节剂教育部工程研究中心 / 中国农业大学农学院, 北京100193
玉米是重要的粮饲作物和工业原料, 目前已位列我国三大粮食作物的首位, 因此玉米丰产高效栽培对我国粮食安全具有重要的现实意义[1]。氮素在玉米生长发育中作用十分重要, 大量研究表明, 氮肥运筹可以提高玉米的产量和氮肥利用率[2-4]。因此,研究玉米高效利用氮肥机制, 提高氮素的利用效率具有重要意义。玉米中氮素的利用效率受玉米生长发育过程中氮素的吸收、同化和再分配过程等的控制, 是许多生理生化反应过程相互作用的结果[5-6]。不同基因型玉米品种的氮素吸收与转移效率上存在着较大差异, 其中绿熟品种的氮素转移效率较低,氮素利用效率较低[7-8]。乙烯作为一种常见的植物激素, 在植物生长发育及应对胁迫防御反应中起重要调控作用, 且在植物吸收氮素过程中也发挥重要作用[9]。在玉米生产中, 乙烯可调控玉米根系建成与株型, 有效解决了由高密、不合理氮肥施用以及品种特性等导致群体质量下降引起倒伏、产量降低等问题[10-11]。植株响应不同氮素水平供给过程中乙烯信号也受到了调节[9]。研究表明, 外源添加ACC抑制了油菜根系伸长与氮素吸收, 且在油菜生长后期可调控植株氮素再利用能力[12-14]。在氮素充足的条件下, 乙烯利可以提高芥菜的氮素利用效率[15]。此外,乙烯利处理降低了夏玉米氮素吸收量和氮素吸收效率, 但提高了氮素利用效率和氮农学效率, 并且乙烯利与氮肥在氮吸收量、氮吸收效率和氮农学效率上有显著的互作效应[16]。但是, 玉米植株响应氮素供给过程中, 乙烯调控植株生长与氮素吸收机制缺乏研究。基于玉米在幼苗期对环境胁迫反应敏感[17],本研究通过比较研究不同氮素水平下不同基因型玉米幼苗间氮素积累差异, 分析乙烯信号表达与氮素吸收的关系, 结合外源添加乙烯合成前体 1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid,ACC), 分析乙烯对不同基因型玉米氮素吸收的调控效应。研究结果将揭示乙烯对玉米氮素吸收的调控机制, 为乙烯在玉米生产中氮素高效利用中应用提供依据。
1 材料与方法
1.1 试验材料
试验选用郑单958、瑞福尔1号和德美亚3号3个玉米品种作为试验材料。RNA快速提取试剂盒购买于艾德莱生物科技有限公司; 反转录使用TaKaRa公司反转录试剂盒; 荧光定量染料为 TaKaRa公司TB Green Reagerts。试验中使用的其他试剂是进口或国产的分析纯试剂。
1.2 试验设计
试验在中国农业大学光照培养室内进行, 采用液体培养法。挑选大小均匀一致的玉米种子, 在室温下用10%过氧化氢灭菌20 min, 用去离子水冲洗5遍后均匀播种在干净湿润的石英沙中。当玉米幼苗长至一叶一心时, 挑选长势一致的幼苗, 去掉胚乳后转移至半营养液中进行培养。营养液采用改良的 Hoagland营养液。以 KNO3为氮源, 氮素水平设置低氮0.05 mmol L-1NO3-(low nitrogen level, LN)和正常氮2 mmol L-1NO3-(sufficient nitrogen level,SN)处理。在移苗2 d后进行ACC处理。ACC处理的浓度为1 μmol L-1, 氮素处理的同时添加ACC。完全随机排列, 每个处理4个重复。营养液每2 d更换一次, 培养温度为 28℃/22℃, 光照时间为 16 h, 湿度控制在大约70%~80%。
1.3 测定内容与方法
1.3.1 干物质积累量 在氮素处理以及 ACC处理后的第 7天, 在处理的每个组合中随机挑选 8株幼苗, 用去离子水洗净表面杂质以及残留的营养液后吸干表面水分, 用剪刀将单株分为地上部和地下部。地上地下部分别装入牛皮纸袋中, 放入105℃烘箱杀青20 min, 之后放入65℃烘箱烘干至恒重, 称量记干重(g)。
1.3.2 全氮含量 将 1.3.1中烘干称重完毕的样品研磨粉碎过45目筛。样品按照凯氏定氮法进行全氮测定, 具体方法参考Bremner和Mulvaney[18]。样品全氮含量(mg) = 样品氮浓度(mg g-1)×样品干重(g)。
1.3.3 叶绿素含量 取氮素处理 5 d后的叶片,剪碎后混匀, 用天平准确称取 0.2 g后放入液氮中,然后用提前预冷的 95%乙醇研磨, 用滤纸过滤到50 mL离心管, 定容至25 mL。取过滤后的溶液用紫外/可见光分光光度计双波长(665 nm和 649 nm)测量模式进行测定。根据测量的吸光值计算叶绿素a和叶绿素b的浓度。Ca= 13.95A665-6.88A649;Cb=24.96A649-7.32A665;CT=Ca+Cb。
1.3.4 可溶性蛋白含量 取玉米幼苗氮素处理3 d后的新叶和胚根, 用去离子水冲洗后用吸水纸擦干, 用剪刀剪碎, 每个样品取0.2 g, 每个处理取3个重复。采用考马斯亮蓝G-250法进行可溶性蛋白测量。
1.3.5 乙烯释放速率 在ACC处理6 d后对玉米幼苗进行取样, 分别取不同处理下的玉米幼苗地上部和地下部分, 立即将其放入 8 mL青霉素小瓶中,然后在小瓶中放入去离子水浸泡过的滤纸保持湿润,盖上盖子并用封口膜封住, 密闭室温黑暗下放置2 h。然后取已抽真空的12 mL真空集气瓶, 用排水法将青霉素小瓶中气体全部收集。取出样品并称取鲜重。用Shimadzu GC-2010气相色谱仪测定乙烯含量。乙烯释放速率(nmol h-1g-1FW) =A×a×V÷T÷M, 其中,A为乙烯峰面积;a为乙烯标准曲线斜率, 值为0.0236 nmol mL-1;V为容器体积(mL);T为密闭孵育时间(h);M为样品鲜重(g)。
1.3.6 基因表达量测定 取玉米幼苗氮素与ACC处理 12 h后的根尖, 将样品立即置于液氮中,后保存在-80℃冰箱中。采用艾德莱生物科技有限公司植物RNA快速提取试剂盒进行玉米总RNA的提取, 置于-80℃冰箱中保存。采用TaKaRa公司反转录试剂盒反转录成cDNA。反转录后的产物稀释10倍作为模板 cDNA。使用 TaKaRa公司 TB Green Reagerts荧光染料, 采用ABI-7500 fast PCR仪进行Real-time PCR反应。以ZmUbiquitin为内参, 测定相关基因的表达量(表1)。反应体系为15 μL, 含TB Green 7.5 μL, 正向和反向引物各 0.3 μL, ddH2O 5.1 μL, ROX Reference Dye II 0.3 μL, cDNA模板 1.5 μL。采用两步法PCR反应程序。根据样品的特定荧光阈值下的 Ct值, 利用 2-ΔΔCt计算方法计算得到不同样品的基因相对表达量。
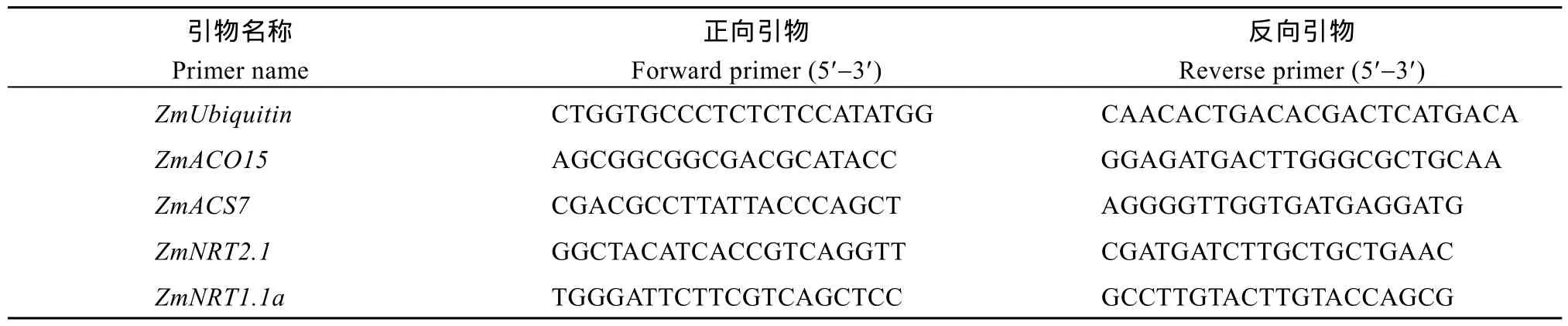
表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequences
1.4 统计分析
采用Microsoft Excel 2016进行数据处理与图表制作, 处理后的数据采用R x64 3.6.2进行统计分析,图中不同小写字母表示不同品种不同处理间差异达到显著性水平(P≤ 0.05)。
2 结果与分析
2.1 ACC处理对不同基因型玉米植株干物质积累和根冠比的调控
LN处理抑制不同基因型玉米植株地下部和地上部干物质的积累(图1-A, B), 但郑单 958无论在LN或SN条件下植株地上部和地下部生物量均高于德美亚3号和瑞福尔1号。而且, ACC处理抑制LN和 SN培养条件下不同基因型玉米植株地上与地下部干物质积累。此外, 与SN比较, LN处理显著增加了不同基因型玉米植株根冠比(图1-C)。ACC处理均提高了LN或SN条件下不同基因型玉米植株根冠比。
2.2 ACC处理对不同基因型玉米植株氮素积累的调控
LN处理显著降低不同基因型玉米植株地上和地下部氮素的积累, 而且德美亚 3号和瑞福尔 1号植株在LN和SN条件下的氮素积累量均显著低于郑单958 (图2)。ACC处理显著降低了LN和SN条件下不同基因型植株地上和地下部的氮素积累。
2.3 ACC处理对不同基因型玉米叶片可溶性蛋白和叶绿素含量的调控
与SN比较, LN处理显著降低了不同基因型玉米植株叶片可溶性蛋白和叶绿素含量(图3), 其中郑单 958叶片中可溶性蛋白和叶绿素含量均显著高于其他2个品种, 而且德美亚3号在LN条件下叶片叶绿素含量下降最大, 表明其比其他2个品种对氮素更为敏感。在SN条件下, ACC处理显著促进了各基因型叶片可溶性蛋白和叶绿素积累。与其相反, 在LN条件下, ACC处理显著降低了各基因型叶片可溶性蛋白和叶绿素积累, 其中福尔 1号和德美亚 3号叶片可溶性蛋白和叶绿素含量降低幅度大于郑单958。
2.4 ACC对不同基因型玉米植株乙烯释放速率调控
与SN比较, LN处理显著降低了不同基因型玉米植株叶片乙烯释放量速率(图4)。ACC处理显著促进LN和SN条件下不同基因型植株叶片乙烯释速率,并且德美亚3号和瑞福尔1号植株受ACC处理调控影响较大。
2.5 ACC对不同基因型玉米植株乙烯合成限速酶表达的调控
与SN比较, LN处理显著抑制不同基因型玉米植株根系中ZmACO15与ZmACS7的表达(图5)。同时, 在LN条件下, ACC处理促进了不同基因型玉米植株根系中ZmACO15与ZmACS7的表达, 相反, 在SN条件下, ACC处理抑制不同基因型玉米根中ZmACO15与ZmACS7的表达。另外, 在 LN或 SN条件下, 瑞福尔1号和德美亚3号与郑单958相比,根中ZmACO15与ZmACS7的表达较低。
2.6 ACC对不同基因型玉米植株硝酸盐转运蛋白表达的调控
LN处理显著影响硝酸盐转运蛋白的表达, 其中LN处理显著诱导ZmNRT2.1在不同基因型玉米根中的表达, 但对ZmNRT1.1a表达影响较小(图6)。与郑单 958相比, 瑞福尔 1号和德美亚 3号根中ZmNRT2.1的表达受硝酸盐诱导较小。在 LN条件下, ACC促进不同基因型玉米根中ZmNRT2.1的表达, 相反, 在 SN条件下, ACC抑制其根中ZmNRT2.1的表达。与ZmNRT2.1不同, 硝酸盐与ACC处理对ZmNRT1.1a在不同基因型玉米根中的表达影响较小。
3 讨论
3.1 ACC对不同基因型玉米幼苗响应氮素供给过程中形态建成的调控
3个玉米品种在LN条件下第7天地上部和地下部干重明显降低, 但根冠比增加。前人研究表明, 玉米植株响应氮胁迫的典型反应是通过增加根部表面积和减少地上部的生长方式来提高同化物从地上部到地下部的转运, 从而显著增加根冠比[19]。ACC处理显著降低 3个品种地上部和地下部的干重, 乙烯可以降低玉米株高, 这与表型是相符合的。与郑单958相比, ACC处理7 d后, 瑞福尔1号和德美亚3号在 LN条件下叶片先出现黄化早衰表型。这一结果表明郑单958较瑞福尔1号和德美亚3号耐低氮胁迫, 瑞福尔1号和德美亚3号在LN条件下对乙烯更敏感。
3.2 乙烯对不同基因型玉米品种响应低氮胁迫过程中氮素积累与生理生化指标调控
外源添加ACC处理会显著提高3个玉米品种在LN和SN下的叶片乙烯释放量, 乙烯可以加速叶片衰老, 这与表型也是相一致的。叶绿素降解和蛋白质含量的降低是植物衰老的典型特征。LN处理会显著降低玉米幼苗地上部和地下部的氮素积累量、叶片叶绿素含量和可溶性蛋白含量。叶绿素的合成与氮的再利用和氮的同化相关, 而且处在营养生长阶段的植物, 在氮胁迫的条件下会将营养物质和代谢产物由老叶向新叶转移[20-21], 因此老叶叶片中的叶绿素含量在 LN条件下会降低。与瑞福尔1号和德美亚3号相比, 郑单958在LN条件下, 叶片叶绿素含量较高, 耐低氮胁迫, 这与表型相一致。外源添加ACC处理通过降低 LN下叶片叶绿素含量, 加速玉米叶片的衰老。但是在SN条件下添加ACC处理提高叶片中叶绿素含量, ACC处理抑制玉米生长, 提高单位叶面积内叶绿素的含量。通过测定叶片可溶性蛋白含量发现, LN处理显著降低3个品种叶片可溶性蛋白的含量, 植物通过大量减少体内最丰富的蛋白质来减少氮的消耗[20]。在LN条件下, 郑单958叶片可溶性蛋白含量显著高于瑞福尔1号和德美亚3号, 这与郑单958较其他2个品种耐低氮的表型相一致。外源添加ACC处理通过降低叶片中可溶性蛋白含量加快玉米叶片的衰老。ACC处理显著升高3个品种地上部氮浓度, 但会降低地上部和地下部的全氮含量, 氮浓度升高但含量降低, 这与ACC处理显著降低植株干重有关。
3.3 乙烯对不同基因型玉米品种响应氮素胁迫过程乙烯合成关键基因及硝酸盐转运蛋白基因表达调控
高等植物中存在 2种硝酸盐转运系统, 即高亲和转运系统(high affinity transport system, HATS)和低亲和转运系统(low affinity transport system,LATS)[22-23]。NRT2.1是 NRT2家族中负责高亲和硝酸盐吸收最重要的转运体, 在大多数情况下发挥吸收NO3-的功能。AtNRT2.1缺失突变体atnrt2.1中, 高亲和硝酸盐吸收活性显著降低[24]。小麦TaNRT2.1和黄瓜CrNRT2.1同样具有硝酸盐转运功能[25-26]。ZmNRT2.1与玉米表皮吸收和转运高亲和力硝酸盐这一过程有关[27]。乙烯通过调控AtNRT1.1或AtNRT2.1的表达影响根系发育与氮素吸收, 如乙烯信号突变体etr1-3和ein2-1中AtNRT1和AtNRT2.1的表达对氮素敏感性降低, 且乙烯负调控AtNRT2.1的表达, 减少高亲和 NO3-吸收[28-29]。ACO 和 ACS作为乙烯合成过程中的关键限速酶, 其基因表达量影响着植物产生乙烯水平。乙烯的合成主要由ACS调控, 同时ACO对乙烯的合成也起着调控作用, 乙烯处理导致乙烯合成增加[30]。前人研究发现植物在遇到环境胁迫时会下调或上调 ACS基因的表达[31],当在一些植物中添加乙烯合成前体 ACC, 也可以观察到乙烯的产生明显增加[32]。我们研究发现, LN处理显著抑制 3个玉米品种根中ZmACS7和ZmACO15的表达, 抑制根系乙烯的释放, 外源添加ACC处理促进LN条件下3个品种根中ZmACS7和ZmACO15的表达, 促进乙烯的释放。因此我们推测, ACC处理是否也可以通过调控玉米硝酸盐ZmNRT2.1和ZmNRT1.1的表达影响根系氮素吸收?通过测定玉米硝酸盐转运蛋白的表达发现,LN处理显著抑制3个玉米品种根中ZmNRT2.1的表达, 郑单958根中ZmNRT2.1表达显著高于瑞福尔1号和德美亚3号, 这一结果与低氮下郑单958较瑞福尔 1号和德美亚 3号耐低氮胁迫表型相一致。ACC处理促进LN下3个品种根中ZmNRT2.1的表达, 而且, 与瑞福尔 1号和德美亚 3号相比,ACC处理对LN条件下郑单958根中ZmNRT2.1诱导较高, 这一结果与外源添加ACC促进LN下瑞福尔1号和德美亚3号叶片早衰结果相一致。在LN下, 乙烯可能通过反馈调节ZmNRT2.1的表达, 促进根系硝酸盐的吸收, 延缓玉米叶片的衰老。与NRT2.1不同,NRT1.1在拟南芥中为双亲和转运蛋白。玉米中与AtNRT1.1同源的基因有 4个,ZmNRT1.1a具有吸收硝酸盐功能, 且表达不受硝酸盐的调控[28]。我们研究发现, 硝酸盐与 ACC处理对ZmNRT1.1a在 3个品种玉米根中的表达影响较小。以上结果表明, LN处理可能通过抑制乙烯合成,乙烯通过调控ZmNRT2.1表达影响不同基因型玉米品种响应氮素过程中叶片的衰老。
4 结论
在LN条件下, 与郑单958相比, 瑞福尔1号和德美亚 3号对氮素胁迫反应更迅速, 早衰表型更明显。外源添加ACC处理通过降低LN条件下叶片全氮含量、叶绿素含量以及可溶性蛋白含量加快瑞福尔1号和德美亚3号早衰表型。LN处理显著抑制玉米根系乙烯合成关键酶ZmACS7和ZmACO15表达,降低乙烯含量, 外源添加 ACC处理促进 LN下ZmACS7和ZmACO15表达, 促进乙烯合成。乙烯参与调控ZmNRT2.1的表达影响氮素吸收, LN条件下,郑单958根系中ZmNRT2.1的表达量显著高于瑞福尔1号和德美亚3号, 从而促进氮素吸收, 延缓叶片衰老。LN条件下, ACC处理加速玉米叶片的衰老并调节了乙烯合成, 进而调控ZmNRT2.1的表达调控氮素吸收。
