赤泥改良过程中微生物群落及酶活性恢复研究
2021-03-17董梦阳董远鹏徐子文邵翼飞刘喜娟胡欣欣刘爱菊山东理工大学农业工程与食品科学学院山东淄博5509山东理工大学资源与环境工程学院山东淄博5509
董梦阳,董远鹏,徐子文,邵翼飞,刘喜娟,胡欣欣,刘爱菊* (.山东理工大学农业工程与食品科学学院,山东 淄博 5509;.山东理工大学资源与环境工程学院,山东 淄博 5509)
赤泥是氧化铝工业提炼过程中产生的副产品,2018 年全球堆积铝土矿残渣库存达到约4.60×109t,年产量约为2.00×108t,成为有色金属冶炼行业最主要的固体废弃物[1-2].我国作为氧化铝生产大国,有远超于7000 万t 的赤泥需要处理,且大量赤泥处置主要以堆存方式为主[3].这种处置方式除占用大量土地外,赤泥因团聚性差、颗粒小、盐碱性强,易造成扬尘、游离碱及重金属渗漏等环境问题[2],进而极易引发土壤、空气和地下水污染及安全事故,对周边生态环境及居民生产生活产生严重的威胁[4-5].国内外研究学者在赤泥减量化、土壤化、资源化等方面做了大量卓有成效的工作,但赤泥的规模化批量处理与处置仍是一个挑战[6],对其处置区域的现场和场外造成潜在的环境风险越来越受到人们的关注.近年来,将其转化为生态工程土壤进行原位恢复和发展可持续的植被生态系统被认为是实现赤泥堆场环境安全管理的最有效方式[7-8].目前赤泥土壤化的改良主要是掺拌糖蜜酒精废液[9]、氟石膏、磷石膏[10]、糠醛渣[11]、污泥[12]、泥炭土、蛭石[13]等改良剂的方式进行;同时研究表明这些改良剂可通过酸碱中和作用、沉淀作用或抑制作用显著降低赤泥碱性,并可增加基质中有机质含量及有效持水能力;但同时也显著增加了赤泥的重金属或表层盐碱含量[14].其中,有机质不仅在促进赤泥基质颗粒团聚方面的作用优于其他基质改良材料,同时显著提升了微生物群落的代谢能力及其胞外酶活性,且随着培养时间的增加其质地组成逐渐趋于参照土壤[15].
土壤酶参与土壤中绝大多数营养元素的生物循环、腐殖质的分解与合成以及有机化合物的转化,在赤泥这种不利于土壤微生物增殖的基质中,也起非常重要的作用[16].土壤酶活性不仅反映土壤中生物化学过程的强度和方向,也是评价土壤肥力状况的指标[17],并广泛用作指示土壤生态系统的健康和可持续性,是反映土壤质量变化的生物活性指标[18-19].土壤微生物群落结构是表征土壤生态系统稳定性的重要参数.此外,土壤微生物也是反映土壤微环境变化的敏感性指标[20],其数量、组成及多样性的变化对土壤功能和生态循环具有决定性作用,是评价土壤质量的重要指标[21].土壤微生物与土壤酶紧密联系,在土壤生态系统服务传递过程中扮演重要的角色[22],两者参与有机物质分解和合成,以及无机物的氧化与还原的过程,因此是土壤生态系统代谢的重要动力.然而,对于赤泥的土壤化修复,通常主要选择化学和矿物学性质来评估其进展和土壤形成轨迹,对微生物群落发育的考虑不够充分[23].因此,通过对赤泥基质酶活性、微生物群落结构组成和丰度及其功能多样性恢复过程的监测,可更为全面地评价其土壤化修复效果.
为此,本研究本着“以废治废”的原则,选用粉煤灰、蛭石为主要基质改良材料,以园林落叶为有机质来源.采用室外培养方法,通过研究分析不同培育时间改良基质的pH 值、EC、CEC 等理化指标、氮素(-N)以及关键土壤酶、微生物群落多样性和群落结构组成等生物指标的动态变化,来评估赤泥土壤化修复效果,以期为赤泥的无害化土壤化修复与治理提供依据.
1 材料与方法
1.1 供试材料
供试拜耳法赤泥由山东铝业公司提供,其化学成分如表1 所示.现场提取样品,经自然风干后过2mm 样筛备用.经XRD 衍射分析,赤泥的主要矿物组成为赤铁矿、铝针铁矿、石英、三水铝石、方钠石、锐钛矿;粉煤灰的主要矿物组成为莫来石、磁铁矿、赤铁矿、石英、方解石等;蛭石的主要矿物组成:辉石、方解石、变体云母、磷灰石、石英、蛇纹石等.

表1 试验材料化学成分(%)Table 1 Chemical composition of the used materials (%)
1.2 试验设计
本试验共设置3 个不同处理:纯赤泥(RM)、赤泥+粉煤灰(F-RM)、赤泥+蛭石(V-RM),其中,粉煤灰和蛭石的添加量分别为10%和2%.将各处理按10%比例添加有机质,混合均匀后装盆、编号,放置于室外自然条件下培养,定期浇水,保持使其含水率在70%田间持水量左右,每个处理设置3 个平行.在培养后第30,180,540d 取样进行分析测定,将采集的赤泥样品过2mm 筛后,一部分自然风干用于土壤理化性质的测定; 另一部分放入4℃冰箱保存,用于土壤酶活性、微生物群落功能多样性以及微生物高通量测序的分析与测定.
1.3 主要测试指标及测试方法
1.3.1 改良基质的基本理化特性分析 采用环刀法测定各处理样品的容重(ρb),采用比重瓶法测定其颗粒密度(ρs)[24],并通过二者计算各样品的孔隙度.将各处理样品按1:5 固液比浸提后,采用pH 计( 801型)测定其pH 值,采用6061 型电导率测试仪测定其EC 值[25].阳离子交换量的测定:采用醋酸铵提取、电感耦合等离子体光谱仪(ICP-AES,Optima 5300DV,美国Perkin Elmer公司生产)测定浸出液中的阳离子浓度,以各阳离子的总量作样品的阳离子交换量[24],以Na+占阳离子交换量的百分比作各样品的盐碱度.采用紫外分光光度法测定各处理样品中NO3--N 含量,具体试验步骤见土壤NO3--N 测试盒(购自苏州科铭生物技术有限公司)说明书.
1.3.2 土壤酶活性测定 采用土壤酶试剂盒(购自苏州科铭生物技术有限公司)分析各改良处理培养过程中脱氢酶、脲酶、碱性磷酸酶等关键酶活性的恢复过程.其中,脲酶活性采用苯酚钠—次氯酸钠比色法测定,脱氢酶活性采用TTC 分光光度法测定,碱性磷酸酶活性采用磷酸苯二钠比色法测定[16].
1.3.3 Biolog-Ecoplate 分析 采用Biolog Ecoplate (BIOLOGTM, USA)分析各改良处理微生物群落及其代谢功能的恢复过程[26]:称取相当于5g 干重的新鲜样品于100mL 三角瓶中,加入45mL 0.05mol/L的灭菌磷酸缓冲液,200r/min振荡30min混匀.静置30min,取上清液,按倍数稀释法依次用0.05mol/L 的灭菌磷酸缓冲液稀释1000 倍作样品的微生物接种液.在无菌环境条件下,用八通道移液枪移取150μL的接种液移至BiologTMEco-plate 微孔中,之后置于(25±1)℃恒温条件下避光培养7d,每隔12h 用酶标仪(infinite F200Pro)读取其在590nm 处吸光值[27].
1.3.4 微生物高通量测序 使用OMEGA 提取试剂盒( E.Z.N.ATM Mag-Bind Soil DNA Kit)按说明书提供的步骤对赤泥土壤样品进行细菌和真菌的DNA 提取.之后对细菌16S rDNA 中的V3—V4 高变区进行 PCR 扩增, 引物序列为 341F(5'-CCTACGGGNGGCWGCAG-3')和805R(5'-GACTACHVGGGTATCTAATCC-3');对真菌的ITS1 区基因进行 PCR 扩增,引物为 fITS7(5'-GTGARTCATCGAATCTTTG-3')和 ITS4(5'-TCCTCCGCTTATTGATATGC-3').将扩增所得的PCR 产物纯化回收处理后,利用Qubit® 2.0DNA 试剂盒对所得DNA 准确定量,并将样品按测序量比例混合后,利用Illumina Hiseq/Miseq PE300 序列平台(由杭州联川生物技术股份有限公司提供)进行测序分析.测序数据经拼接、过滤、剔除嵌合体,舍弃低质量序列等得到精准分析的优质序列,优质序列用于可操作分类单元(OTU)分类与多样性指数计算及物种丰度分析.
1.4 数据处理
实验数据采用Microsoft Excel 2010 和SPSS version 19.0 处理.赤泥样品数据均采用单因素方差分析 (ANOVA)和方差齐性检验.所有图表均通过Origin 8.0 绘制.利用Mothur 软件对每个样品OTUs做 α-多样性指数(Observed species、Chao1、Goods_coverage、Shannon、Simpson)分析.
其中,土壤微生物群落整体代谢活性用孔颜色平均变化率(AWCD)表征,用Shannon 和Simpson 多样性指数来描述土壤微生物种群的丰富度和最常见物种的优势度.计算公式如下:

式中:Ci为每孔在590nm 下的吸光值;R 为对照孔吸光值;pi为第i 孔相对吸光值与整板相对吸光值总和之比.
2 结果与分析
2.1 改良赤泥基质的基本理化性质
碱性强、盐分含量高、物理结构差、抗侵蚀能力弱等是赤泥土壤化及资源化利用的关键限制因素[1].而赤泥土壤pH 值、EC 以及盐碱度是评价赤泥基质盐碱性改良的重要指标,能够较好地指示土壤盐害、碱害的风险和盐碱度的强弱[28].故本研究定期分析测定各处理组的容重、孔隙度等物理结构改良指标的同时,重点监测了其pH 值、EC、ESP 等指标在不同培养时间的变化,以分析蛭石和粉煤灰对赤泥基质理化性质的改良效果(表2).
孔隙度是土壤具有良好保水、透气性的重要指标,当其达到50%~60%时,即可为生物生长营造出良好的孔隙状态.由表1 可知,粉煤灰和蛭石的添加并未显著降低赤泥基质容重,但却显著增加了其孔隙度,经粉煤灰改良后,赤泥基质孔隙度增长到58.15%,达到有效范围.这与Zhu 等[29]研究结果一致,可能由于赤泥基质中含有的大量可交换性Na+降低了有机质和矿物组分之间的共价作用,从而导致基质中团聚体及黏粒的崩解和分散.而添加粉煤灰后,其含有的大量可交换Ca2+减少了土壤分散性黏粒的数量,促进团聚体的形成和稳定,从而改善了赤泥土壤的环境,有利于微生物的生存及植物的定植[30].
相比之下,不同处理组的盐碱性指标(pH 值、EC、ESP)均存在显著性差异(P<0.05).培养30d 时,与对照组(RM)相比:V-RM 组pH 值由11.25 降低至10.57,ESP 由79.40%降至75.21%,EC 无明显变化;F-RM 组pH 值由11.25 降低至10.70,ESP 由79.40%降至66.23%,EC 由1.05mS/cm 降低至0.82mS/cm.随着培养时间的延长,V-RM 和F-RM 组pH 值、EC、ESP 均降低.培养540d 后,V-RM 和F-RM 组的pH值分别降至9.85 和9.44, ESP 分别降至19.10%和8.02%,EC 降至0.27 和0.35mS/cm,均显著低于对照处理(RM)的相应指标值(表2).这是因为,粉煤灰的矿物相中含有石膏,其含有的Ca2+能与空气中的CO2以及赤泥中OH-等碱性阴离子发生沉淀反应,起到一定的中和作用;同时Ca2+还能与赤泥基质中的Na+发生置换反应,故通过添加粉煤灰可降低赤泥基质的盐碱性[14].且相比之下,粉煤灰添加对赤泥基质的理化环境的改良效果优于蛭石处理.通过一段时间的改良修复,赤泥基质的理化性质能基本恢复到对照土壤的正常水平,改良效果较为显著.

表2 各处理样品的理化指标变化Table 2 Changes of physical and chemical indexes of samples treated
2.2 改良赤泥基质的肥力变化
氮是植物生长不可或缺的营养元素,因此赤泥土壤中氮的含量会在很大程度上决定植物的生长情况和发育状态.由图1(a)可知,本研究对不同培养时间的改性赤泥的氮素含量进行测定,发现通过添加粉煤灰和蛭石改良后赤泥基质的硝态氮含量有所增加,并且随着培养时间延长,增长更为显著.培养540d 时,V-RM 和F-RM 组的NO3--N 含量均高于RM 组,分别增加3.41 和28.27mg/kg,F-RM 组改良效果更为显著.
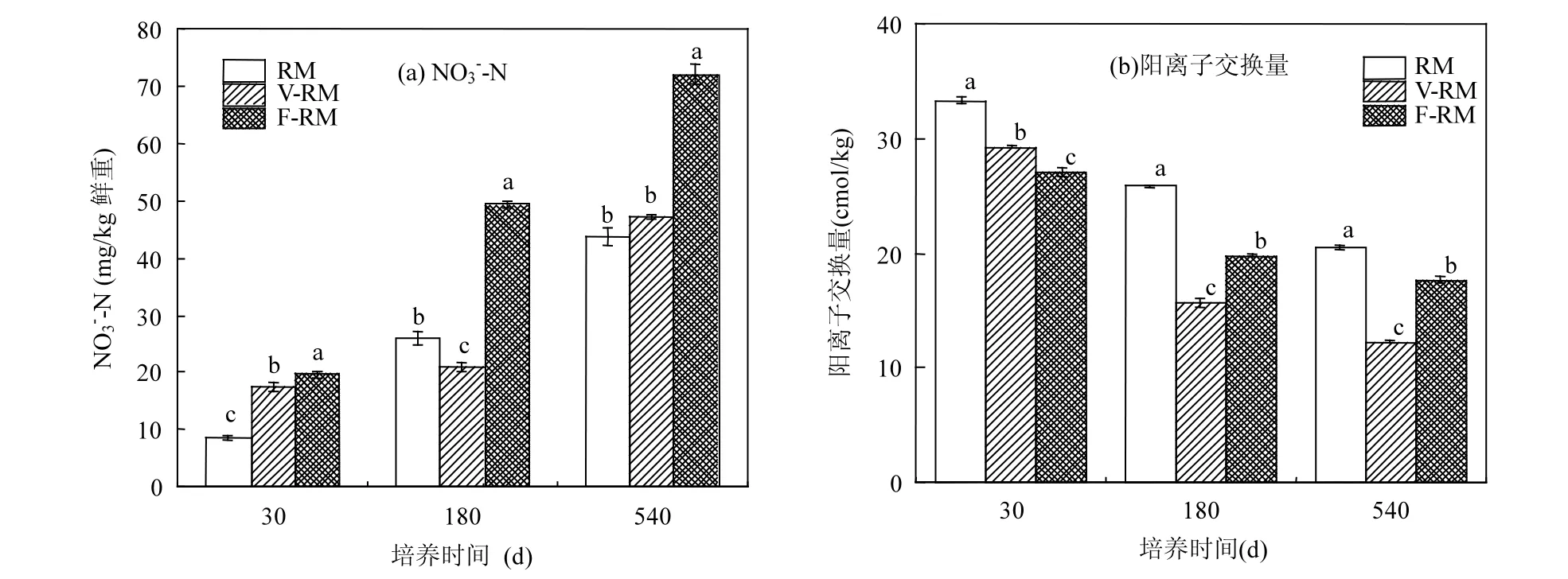
图1 不同改良处理对硝态氮及阳离子交换量的影响Fig.1 Effects of different improved treatments on nitrate nitrogen and cation exchange capacity
阳离子交换作用是土壤最重要的化学性质之一,是土壤缓冲性能的主要来源,直接反映了土壤保存、供应和缓冲阳离子养分的能力,是土壤中普遍存在的现象,也是改良土壤、合理施肥的重要依据.由图1(b)可知,不同改良处理组的交换性阳离子变化趋势基本一致,随着培养时间的增加而逐渐降低,且V-RM 组中阳离子交换量下降最为显著;在培养540d 后,各处理组中交换性阳离子含量由高到低依次为:RM 组>F-RM 组>V-RM 组.分析其原因,可能是由于粉煤灰或蛭石添加提升了基质的孔隙度,进而增加赤泥基质中Na+离子的淋洗效果(表2);而且,F-RM 组中阳离子交换量高于V-RM 处理组可能与粉煤灰提供的Ca2+的补给作用相关.这进一步表明粉煤灰对赤泥基质的改良效果优于蛭石的改良作用.
2.3 改良赤泥基质的土壤酶活性的变化
土壤酶活性是近年来土壤质量及生态功能评价中不可缺少的内容[21].本研究主要选取了土壤脱氢酶、土壤脲酶和土壤碱性磷酸酶来评价赤泥土壤化修复过程中酶活性的动态变化,以反映赤泥基质中的物质循环及转化动态[31].其中土壤中脲酶促进酰胺键的断裂,参与氮的循环[32],磷酸酶参与土壤中磷的循环,促进土壤中有效磷的含量和腐殖质的合成.脱氢酶的活性与土壤中生物体的绝大多数氧化还原反应息息相关[31].
由图2 可知,RM 组3 种土壤酶活性在自然生长状况下总体增长较为平缓,而经过粉煤灰和蛭石改良处理后,3 种土壤酶活性均显著增强,即土壤酶活性大小顺序为:F-RM 组>V-RM 组>RM 组.其中,脱氢酶及脲酶均随着培养时间的延长酶活性显著增长,而碱性磷酸酶活性在培养180d 时增长较为缓慢,180d 后快速增长.在培养到 540d时,F-RM 组的土壤脱氢酶、脲酶及碱性磷酸酶活性较RM 组相比分别增长了114.98%、321.26%和560.88%,V-RM 组分别增长了33.53%、215.66%和174.85%.其主要原因为通过添加粉煤灰和蛭石改善了赤泥基质的基本理化性质,从而更适宜微生物生存繁殖以及多种酶活性的增长.但相比之下,粉煤灰添加处理对土壤酶活性恢复的促进作用显著高于蛭石添加处理.

图2 不同改良处理中典型土壤酶酶活性的动态变化Fig.2 Variation of the typical enzymes’ activity in the improved treatments of red mud
2.4 基质改良对赤泥微生物群落功能多样性的影响
平均颜色变化率(AWCD),指Biolog-Eco微平板95 个孔吸光度的平均值,其大小随时间的变化可作为评价微生物群落整体活性的有效指标之一,与土壤中利用单一碳源的微生物的数目和种类有关[33].本研究通过测定AWCD 随培养时间的变化来反映经不同改良处理的赤泥基质中的微生物活性及微生物群落功能多样性[34].

表3 土壤微生物群落功能多样性指数Table 3 Functional diversity index of soil microbial community
微生物群落多样性作为衡量土壤质量和评价土壤生态系统稳定的重要生物学指标,能够敏感地反映土壤环境的微小变化[35].由表3 可知,不同改良处理组的AWCD 值随着培养时间的延长而不断地增加.其中,RM 组AWCD 值在前180d 增长缓慢,而180d 后增长迅速;其余处理组均随时间显著增长.在培养540d 时,RM 组的AWCD 值相对较低为(0.504±0.004);V-RM 组为(0.588±0.012),与RM 组相比增加了16.67%;F-RM 组AWCD 值最高为(0.882±0.011),与RM 组相比增加了75%.AWCD 值越大说明其微生物的密度越大,活性越高[36],故不同改良处理的改良效果为F-RM 组>V-RM 组>RM 组.
群落多样性指数可以用来分析土壤微生物群落的功能多样性,反映土壤微生物群落利用碳源类型的差异[37].由表3 可知,不同改良处理组随着培养时间的增加,Shannon 指数在不断地增加,即微生物物种丰富度不断增大.利用粉煤灰和蛭石改性赤泥均促进了赤泥基质中微生物Shannon 指数的增长,且添加粉煤灰改良效果更加明显.在培养30d 时,V-RM、F-RM 组与RM 组相比Shannon 指数分别增加了0.01 和0.52;培养540d 时,V-RM、F-RM 组的Shannon 指数较RM 组增长了0.26 和 2.485.在微生物优势物种方面,在 540d 时不同处理组的Simpson 指数存在显著差异性,说明赤泥基质改良处理可显著改变其优势物种的组成.
本研究通过2种不同改良处理赤泥基质AWCD值与纯赤泥相比显著增大,说明粉煤灰和蛭石的添加改善了赤泥基质的土壤环境.Jones 等也通过对赤泥进行改良,从而提高其有机质和养分含量,使赤泥基质的土壤环境更适宜微生物的生长和繁殖[38].同时根据土壤微生物群落多样性指数分析结果表明,各处理组随着培养时间的延长,Shannon 指数在不断地增加.粉煤灰和蛭石的添加能够促进赤泥基质中微生物群落物种丰富度的快速增长,并且粉煤灰的改良效果更加明显.
2.5 基质改良对赤泥微生物群落结构变化的影响
2.5.1 α-多样性分析 OTU 是系统发生学或群体遗传学研究中,划定的一个分类单元,通过归类操作,按照97%的相似性阀值将序列划分为不同的OTU,每个OTU 被视为一个微生物物种,OTU 的数量可以代表样品物种的丰度.Coverage 指数可用来判断本次测序结果能否代表样本的实际情况.其数值越高,表明样本文库覆盖率越高.Chao1 指数可用于反映样品微生物丰度,而Shannon 指数和Simpson 指数则用于表征微生物群落多样性.Chao1 指数值越大,样品中细菌微生物群落的丰富度就越高;Shannon 指数值越大,细菌群落的多样性越高;Simpson 指数值越小,土壤微生物均匀度越高[39].

表4 不同处理下土壤微生物OTU 及α-多样性指数Table 4 The α-diversity index and OTU of soil bacterial and fungal under different treatments
由表4 可知,所有处理Coverage 指数均在0.99以上,表明本次测序数据能够覆盖当前状态下不同处理样品中的细菌及真菌种类,符合微生物多样性分析的要求,能真实反映样本中的菌群落情况,可用于后续分析.与添加蛭石、粉煤灰修复处理(T5、T6)30d 相比,对照组(T4)在无任何改良措施的条件下,自然恢复540d 赤泥基质中微生物的OTU、Shannon、Chao1 指数值并未发生显著变化;但培养至540d时,OTU、Shannon、Chao1 指数显著增加,说明粉煤灰和蛭石的加入可有效促进赤泥基质微生物菌群的丰度和多样性的恢复.其原因可能是由于粉煤灰及蛭石的加入改善了赤泥基质的基本理化性质,为土著微生物提供了良好的生存环境,致使赤泥基质中细菌及真菌菌群结构发生了明显变化,但与纯土壤(T1)相比仍较低,需进一步培养恢复.
2.5.2 微生物群落结构分析 由高通量测序分析可知,本研究中细菌主要分属15 个门(图3),包括变形菌门(Proteobacteria),酸杆菌门(Acidobacteria),芽单 胞 菌 门 (Gemmatimonadetes), 放 线 菌 门(Actinobacteria),浮霉菌门(Planctomycetes),拟 杆 菌门(Bacteroidetes),绿弯菌门(Chloroflexi)等.通过不同改良处理,细菌群落在门水平上的差异较为显著.其中变形菌门、放线菌门和芽单孢菌门为纯赤泥基质(T4)中的优势菌门,其相对丰度分别为21.39%、38.78%和18.42%.在培养540d 后,与纯赤泥(T4)相比,两种改良处理(T5、T6)均显著抑制了芽单胞菌门(Gemmatimonadetes)及厚壁菌门(Firmicutes)的生长.其中所包含的芽孢杆菌是一类好氧和兼性厌氧型革兰氏阳性杆状细菌或球状细菌,抗逆性强、生长快、分布极其广泛,是土壤和植物根际的重要微生物种群[40],因此对赤泥盐碱环境具有很好的适用性.而经过改良,赤泥基质理化性质得到一定改善,其所占比例也随之下降.添加粉煤灰改良(T6)处理后,酸杆菌门(Acidobacteria)菌群丰富度较纯赤泥基质(T4)有显著增加,即其在菌群中的占比由0.51%增长到5.43%,但仍显著低于其在自然土壤中的菌群占比(24.17%).Schmalenberger 等[41]研究发现,通过菌种鉴定和PCR技术分析,经石膏和堆肥处理改良后的赤泥中含有大量酸杆菌,这些菌群通过代谢产酸作用可实现对赤泥碱性的中和调控,有利于促进赤泥堆场生物修复,在对赤泥强碱性环境的适应及碱性调控方面有其潜在优势[42].同时,随着培养时间的延长,赤泥基质理化性质得到改善,土壤酶活性提高,更加适宜生物生存和繁殖,故细菌的数量及种类均得到提升.但其微生物群落组成仍与自然土壤存在显著差异,分析其原因可能与各改良基质的盐碱性环境相关.

图3 不同改良处理下细菌门水平的相对丰度Fig.3 The relative abundance of the dominant bacterial phylum under different improved treatments
对不同处理组中的真菌门水平群落结构进行 了高通量测序分析,结果如图4 所示.所测不同处理组赤泥基质中的真菌主要分属9 个门,包括子囊菌门(Ascomycota),未分类真菌(Fungi_unclassified),担子菌门(Basidiomycota),接合菌门(Zygomycota),鞭毛菌门(Mortierellomycota),壶菌门(Chytridiomycota),球 囊 菌 门 (Glomeromycota) 和 罗 兹 菌 门(Rozellomycota)等.当修复方法不同时,赤泥基质中的真菌在门水平上的差异较为显著.纯赤泥基质中微生物量占比最大的为子囊菌门(Ascomycota,85.71%),其次是未分类真菌(Fungi_unclassified,13.43%)及担子菌门(Basidiomycota,0.82%).与纯赤泥组(T5)相比,改良处理后会降低赤泥基质中未分类真菌(Fungi_unclassified)的比例;而粉煤灰的添加(T6)还会增大担子菌门(Basidiomycota)所占比例、抑制子囊菌门的生长.这与陈凯丽[43]利用有机物修复盐碱土壤结果相同.综上可得,粉煤灰和蛭石的添加可显著改变赤泥土壤真菌的微生物群落结构,与细菌变化相同,赤泥基质中真菌的数量和种类也明显增加,通过聚类分析可知,添加粉煤灰改良后赤泥基质土壤化程度得到一定提升.

图4 不同改良处理下真菌门水平的相对丰度Fig.4 The relative abundance of the dominant fungal phylum under different improved treatments
2.6 微生物群落结构与主导环境因子

图5 环境因子对微生物群落结构影响的冗余分析Fig.5 Redundancy analysis between soil properties and microbial community structure
将各处理组门水平优势种群与环境因子相结合,利用冗余分析(RDA)探究微生物菌群与环境变化的关系.如图5,通过微生物群落与环境因子间的冗余分析结果可知,第一、二排序轴分别解释了89.46%和10.54%的变异,且微生物群落分布特征主要受赤泥土壤pH 值、碱化度ESP、电导率EC、孔隙度及-N 等理化指标影响.V-RM 处理组样本点分布在第二象限,F-RM 处理组样品点分布在第四象限,而RM 处理组样品点处于第三象限,表明不同处理组之间微生物群落组成具有明显的差异性.此外,分析各环境因子与优势种群之间的关系可知,细菌酸杆菌门(Acidobacteria) 、 变形菌门(Proteobacteria)及疣微菌门(Verrucom)与孔隙度和硝态氮呈正相关关系,而蓝藻菌门(Cyanobac)、芽单孢菌门(Gemmatimonadetes)及厚壁菌门(Firmicutes)则主要受pH 值、碱化度ESP 及电导率EC 的影响比较大.
3 结论
3.1 通过添加蛭石和粉煤灰进行改良,有效调控了赤泥基质盐碱性,其pH 值、碱化度ESP 和EC 值均显著降低.其中540d 时,F-RM 组pH 值已降至8.49,趋近于参照土壤(8.51);同时,容重、孔隙度也得到明显改善.
3.2 在肥力水平方面,F-RM 组硝态氮含量显著提高,达到了28.27mg/kg,为微生物生存繁殖提供了良好的营养条件.
3.3 与此同时,理化性质及肥力水平的改善,进一步刺激了赤泥基质酶活性,大幅提高了微生物群落多样性,表征微生物群落代谢水平的AWCD 值也由0.059 增长至0.882(F-RM 组).
3.4 改良培养后,赤泥基质中的微生物群落结构发生显著变化,代谢产酸能力较强的微生物,如酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)的所占比例显著提升,成为优势种群.这些菌群通过代谢产酸作用可实现对赤泥碱性的中和调控,有利于促进赤泥堆场生物修复.
3.5 综合比较分析各处理的赤泥土壤化修复改良效果可知,粉煤灰添加处理对赤泥微生物群落结构、代谢活性以及土壤酶功能的促进作用均优于蛭石改良处理.这为赤泥土壤化修复在改良材料的选择方面提供了有效参考.
