紫甘薯花色苷通过调控KTN1-AS1表达对肺癌细胞的增殖和凋亡的影响
2021-03-16范智彦刘金菊
范智彦,刘金菊
(1.临沂市第三人民医院,山东 临沂 276004;2.临沂市肿瘤医院,山东 临沂 276004)
肺癌是一种常见的恶性肿瘤,其恶性程度高,5年生存率较低,严重威胁患者生命健康[1]。目前,肺癌的治疗手段主要有手术、放疗及化疗,但肿瘤细胞易对化疗药物产生耐药性,导致治疗效果不佳[2]。因此,寻找并开发低毒且高效的天然药物尤为重要。紫甘薯属旋花科一年生草本植物,富含天然花色苷。花色苷具有抗氧化、抗肿瘤和降血糖等作用,且无毒副作用[3-4]。研究显示,紫甘薯花色苷可有效抑制膀胱癌细胞增殖,阻滞细胞周期进程,并促进细胞凋亡,发挥抗肿瘤作用[5]。但目前还未见紫甘薯花色苷影响肺癌细胞恶性生物学行为的相关报道。KTN1-AS1是近年新发现的一种长链非编码RNA(long non-coding RNA,lncRNA),其在肺鳞癌组织中表达上调,且高表达的患者预后较差[6]。但目前KTN1-AS1对肺癌发生发展的影响还未知。因此,本研究以肺癌A549细胞为研究对象,KTN1-AS1为切入点,探讨了紫甘薯花色苷对A549细胞增殖和凋亡的影响及分子机制。
1 仪器与材料
1.1 仪器
CO2培养箱(美国Thermo公司);Statfax 4300全自动酶标仪(北京华泰和合商贸有限公司);FACScan流式细胞仪(美国Becton Dickinson公司);PCR仪(美国Applied Biosystems公司);凝胶成像系统(美国Bio RAD公司)。
1.2 材料
肺癌A549细胞(中国科学院上海细胞库);胎牛血清(FBS,浙江天杭生物科技股份有限公司);RPMI 1640培养基,细胞计数试剂盒-8(CCK-8),胰蛋白酶,LipofectamineTM2000试剂盒,二喹啉甲酸(BCA)蛋白检测试剂盒和Annexin V-FITC/PI细胞凋亡试剂盒(北京索莱宝科技有限公司);KTN1-AS1小干扰RNA(si-KTN1-AS1)及乱序无意义阴性序列(si-NC),KTN1-AS1过表达载体(pcDNA-KTN1-AS1),空载体(pcDNA,上海吉玛制药技术有限公司);逆转录试剂盒和PCR试剂盒(大连宝生物工程有限公司);Trizol试剂(美国Invitrogen公司);PCR引物(上海生工生物工程有限公司);兔抗人细胞周期蛋白D1(cyclin D1),p21多克隆抗体(北京博奥森生物科技有限公司);B淋巴细胞瘤-2 蛋白(Bcl-2),B淋巴细胞瘤-2相关蛋白(Bax),甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(北京中杉金桥生物技术有限公司)。
2 方法
2.1 紫甘薯花色苷的制备
参照文献方法紫甘薯花色苷[7]。选取新鲜、无病虫害、无腐烂的紫甘薯,自来水洗净,晾干后切成薄片,置于干燥机中干燥,温度50 ℃。干燥后粉碎,过80目筛。准确称取100 g紫甘薯粉,加入6000 ml蒸馏水,调整pH为6.0,加入50 g果胶酶,40 ℃水浴提取120 min。滤液经旋转蒸发浓缩后,冷冻干燥,得25 mg花色苷。超纯水配制为浓度为10 mg/ml的花色苷母液,过滤除菌,-20 ℃保存备用。使用时培养基稀释为所需浓度。
2.2 细胞培养和转染
A549细胞复苏后,加入含10 % FBS的RPMI 1640培养基培养。取对数生长期的A549细胞,以1×105个/孔接种于6孔板中,采用LipofectamineTM2000脂质体法,将si-KTN1-AS1、si-NC、pcDNAKTN1-AS1和pcDNA分别转染至A549细胞。转染6 h后,换为含10 % FBS的RPMI 1640培养基。继续培养48 h后,收集细胞用于后续实验。
2.3 细胞分组
未进行转染操作的A549细胞分为对照组、紫甘薯花色苷不同剂量组。其中对照组细胞常规培养基培养24 h;紫甘薯花色苷不同剂量组细胞分别用含紫甘薯花色苷终200,400,800 μg/ml[8]的培养基培养24 h。转染si-KTN1-AS1、si-NC的细胞常规培养基培养24 h,记为si-KTN1-AS1组、si-NC组。转染pcDNA-KTN1-AS1、pcDNA的细胞用紫甘薯花色苷终浓度为800 μg/ml的培养基培养24 h,记为紫甘薯花色苷800 μg/ml+pcDNA-KTN1-AS1组、紫甘薯花色苷800 μg/ml+pcDNA组。
2.4 CCK-8法检测细胞增殖
将A549细胞以0.5×104个/孔接种于96孔板中,按2.3项下步骤分组处理,每组设3个复孔。培养后,加10 μl CCK-8试剂,继续培养1.5 h后,采用酶标仪于450 nm处测吸光度值(A),计算细胞抑制率。抑制率(%)=(1-A实验组/ A对照组)×100 %。重复3次。
2.5 流式细胞仪检测细胞凋亡
将A549细胞以2.5×104个/孔接种于24孔板中,按2.3项下步骤分组处理,每组设3个复孔。培养后,收集细胞。参照Annexin V-FITC/PI试剂盒说明书,采用流式细胞仪检测细胞凋亡。
2.6 实时荧光定量PCR(RT-qPCR)检测细胞中KTN1-AS1表达
将A549细胞以2.5×104个/孔接种于24孔板中,按2.3项下步骤分组处理,每组设3个复孔。培养后,收集细胞。Trizol试剂提取细胞中总RNA,逆转录为cDNA,进行PCR扩增。扩增条件:95 ℃3 min,95 ℃15 s,60 ℃30 s,72℃30 s,共35个循环。引物序列:KTN1-AS1上游5'-GGGTCCAGGCTATACGAGAC-3',下游5'-GGACAGTTGGAAGATGGTGC- 3';内参GAPDH上游5'-GGCCTCCAAGGAGTAAGACC-3',下游5'-CAAGGGGTCTACATGGCAAC-3'。2-ΔΔCt法计算KTN1-AS1表达水平。
2.7 蛋白印迹法(Western Blot)检测细胞中cyclin D1、p21、Bcl-2和Bax蛋白表达水平
将A549细胞以每孔2.5×104个接种于24孔板中,按2.3项下步骤分组处理,每组设3个复孔。培养后,收集细胞。RIPA试剂提取细胞中总蛋白,BCA法对蛋白定量后,行12 %十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳后,将分离蛋白电转移至聚偏乙烯二氟(PVDF)膜,于5 %脱脂奶粉中封闭1 h。分别置于cyclin D1(1:1000)、p21(1:1000)、Bcl-2(1:800)、Bax(1:800)和GAPDH(1:1000)一抗孵育液中,4 ℃过夜。置于辣根过氧化酶标记的山羊抗兔二抗(1:5000)孵育液中,37 ℃孵育1 h。加入化学发光试剂避光显影,曝光拍照,Image J软件分析蛋白条带灰度值。
2.8 统计学分析
利用SPSS.22.0软件分析实验数据。符合正态分布的计量资料以均数±标准差(±s)表示。两组间比较采用独立样本t检验。多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05表示差异有统计学意义。
3 结果
3.1 紫甘薯花色苷对肺癌A549细胞增殖的影响
与对照组比较,紫甘薯花色苷不同剂量组细胞抑制率升高(P<0.05),cyclin D1蛋白表达降低(P<0.05),p21蛋白表达升高(P<0.05),且呈剂量依赖性(P<0.05)。见图1、表1。
表1 紫甘薯花色苷对A549细胞增殖和相关蛋白表达的影响(±s,n=9)
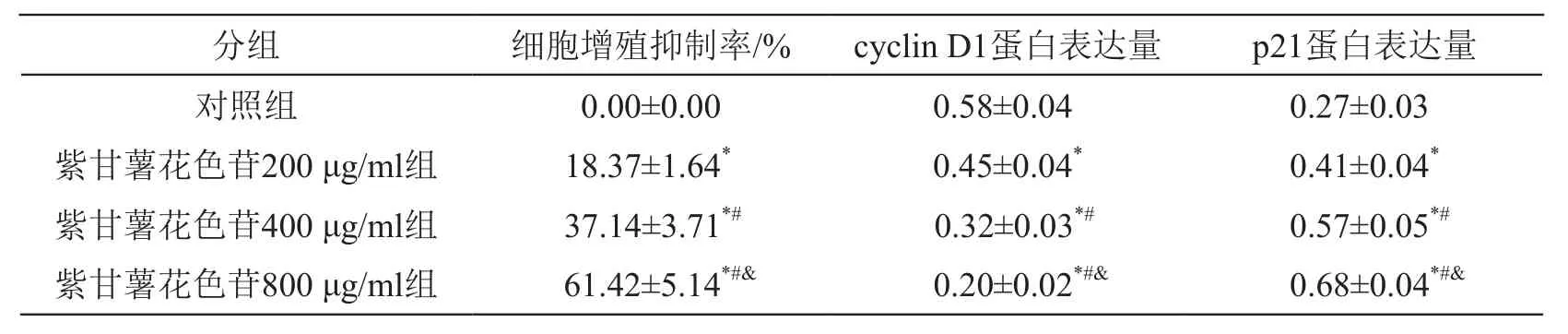
表1 紫甘薯花色苷对A549细胞增殖和相关蛋白表达的影响(±s,n=9)
注:*P<0.05 vs 对照组;#P<0.05 vs 紫甘薯花色苷200 μg/ml组;&P<0.05 vs 紫甘薯花色苷400 μg/ml组
分组 细胞增殖抑制率/% cyclin D1蛋白表达量 p21蛋白表达量对照组 0.00±0.00 0.58±0.04 0.27±0.03紫甘薯花色苷200 μg/ml组 18.37±1.64* 0.45±0.04* 0.41±0.04*紫甘薯花色苷400 μg/ml组 37.14±3.71*# 0.32±0.03*# 0.57±0.05*#紫甘薯花色苷800 μg/ml组 61.42±5.14*#& 0.20±0.02*#& 0.68±0.04*#&
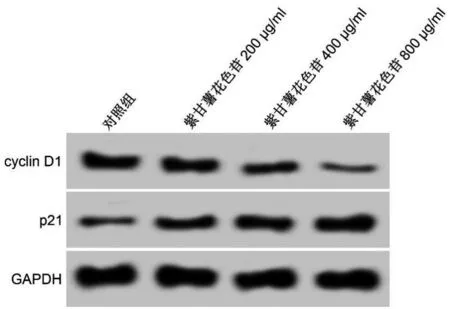
图1 紫甘薯花色苷对A549细胞中cyclin D1和p21蛋白表达的影响
3.2 紫甘薯花色苷对肺癌A549细胞凋亡的影响
与对照组比较,紫甘薯花色苷不同剂量组细胞凋亡率和Bax蛋白表达升高(P<0.05),Bcl-2蛋白表达降低(P<0.05),且呈剂量依赖性。见图2、表2。
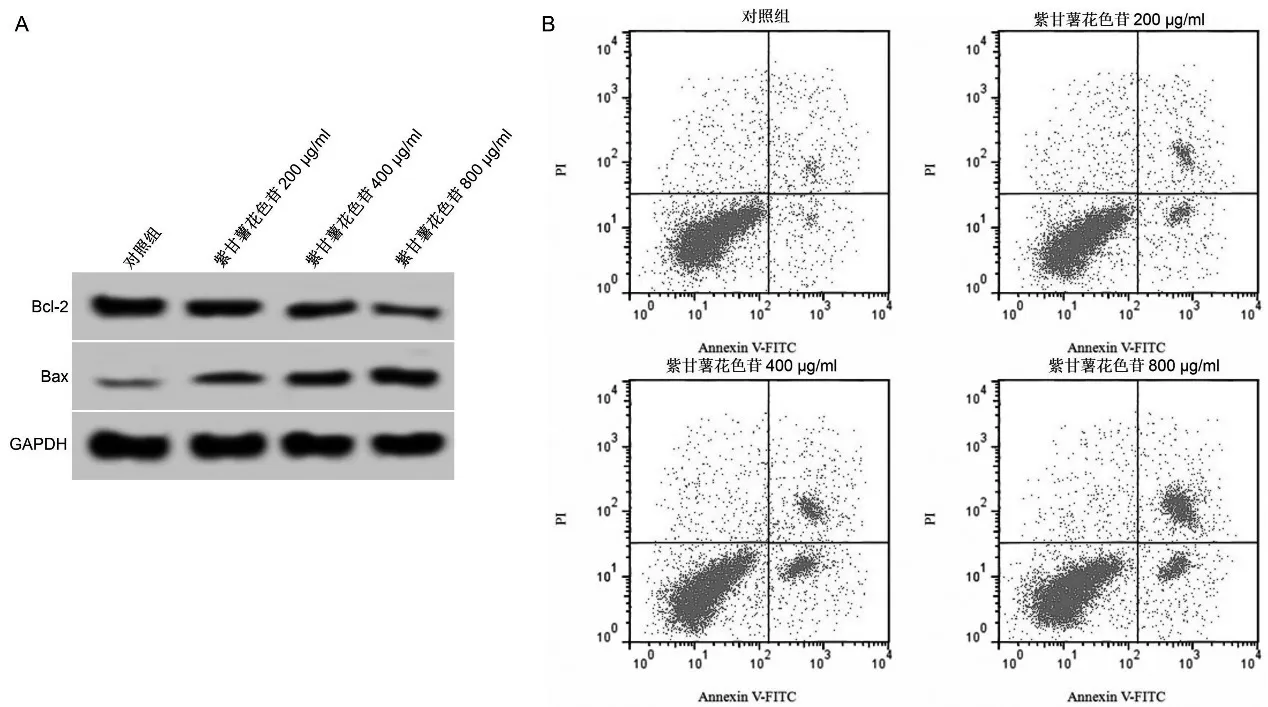
图2 紫甘薯花色苷对A549细胞中Bcl-2和Bax蛋白表达及凋亡的影响
表2 紫甘薯花色苷对A549细胞凋亡及Bcl-2和Bax蛋白表达的影响(±s,n=9)
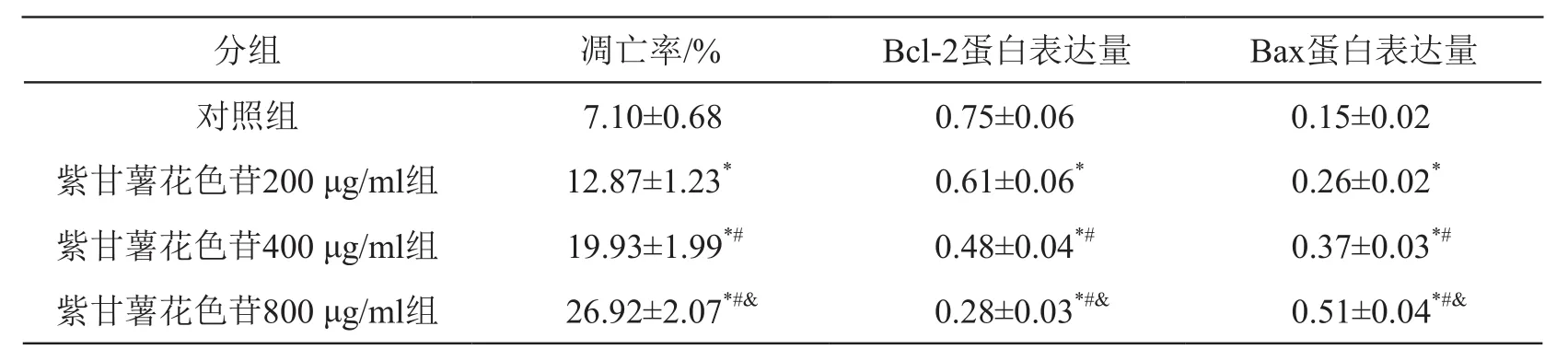
表2 紫甘薯花色苷对A549细胞凋亡及Bcl-2和Bax蛋白表达的影响(±s,n=9)
注:*P<0.05 vs 对照组;#P<0.05 vs 紫甘薯花色苷200 μg/ml组;&P<0.05 vs 紫甘薯花色苷400 μg/ml组
分组 凋亡率/% Bcl-2蛋白表达量 Bax蛋白表达量对照组 7.10±0.68 0.75±0.06 0.15±0.02紫甘薯花色苷200 μg/ml组 12.87±1.23* 0.61±0.06* 0.26±0.02*紫甘薯花色苷400 μg/ml组 19.93±1.99*# 0.48±0.04*# 0.37±0.03*#紫甘薯花色苷800 μg/ml组 26.92±2.07*#& 0.28±0.03*#& 0.51±0.04*#&
3.3 紫甘薯花色苷对肺癌A549细胞中KTN1-AS1表达的影响
与对照组比较,紫甘薯花色苷不同剂量组细胞中KTN1-AS1表达水平降低(P<0.05),且呈剂量依赖性。见表3。
表3 紫甘薯花色苷对A549细胞中KTN1-AS1表达的影响(±s,n=9)
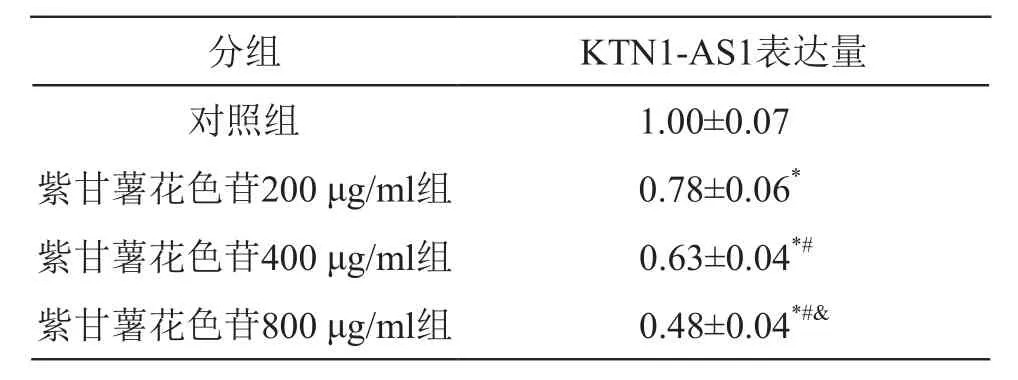
表3 紫甘薯花色苷对A549细胞中KTN1-AS1表达的影响(±s,n=9)
注:*P<0.05 vs 对照组;#P<0.05 vs 紫甘薯花色苷200 μg/ml组;&P<0.05 vs 紫甘薯花色苷400 μg/ml组
分组 KTN1-AS1表达量对照组 1.00±0.07紫甘薯花色苷200 μg/ml组 0.78±0.06*紫甘薯花色苷400 μg/ml组 0.63±0.04*#紫甘薯花色苷800 μg/ml组 0.48±0.04*#&
3.4 下调KTN1-AS1表达对肺癌A549细胞增殖和凋亡的影响
与si-NC组比较,si-KTN1-AS1组细胞中KTN1-AS1表达水平降低(P<0.05),细胞抑制率、凋亡率及p21和Bax蛋白表达升高(P<0.05),cyclin D1和Bcl-2蛋白表达降低(P<0.05)。见图3、表4。
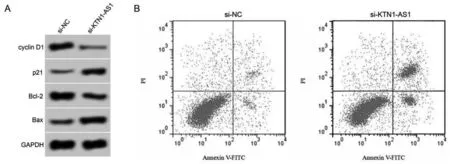
图3 下调KTN1-AS1表达对A549细胞增殖和凋亡的影响
表4 下调KTN1-AS1表达对A549细胞增殖和凋亡及相关蛋白表达的影响(±s,n=9)
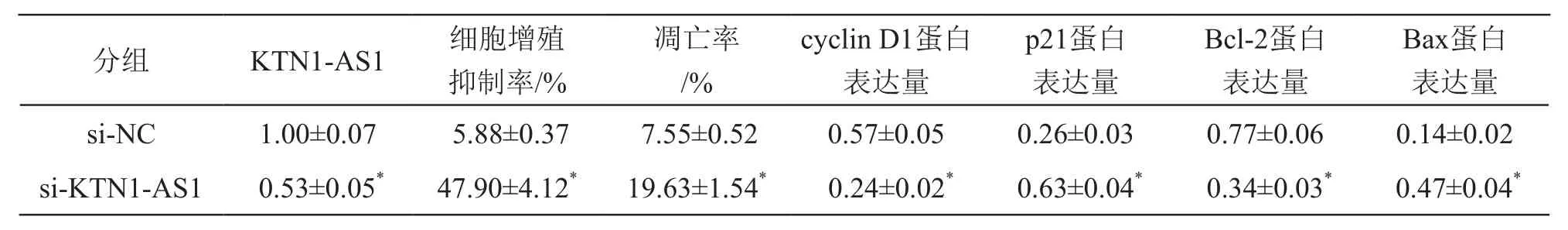
表4 下调KTN1-AS1表达对A549细胞增殖和凋亡及相关蛋白表达的影响(±s,n=9)
注:*P<0.05 vs si-NC组
Bax蛋白表达量si-NC 1.00±0.07 5.88±0.37 7.55±0.52 0.57±0.05 0.26±0.03 0.77±0.06 0.14±0.02 si-KTN1-AS1 0.53±0.05* 47.90±4.12* 19.63±1.54* 0.24±0.02* 0.63±0.04* 0.34±0.03* 0.47±0.04*分组 KTN1-AS1 细胞增殖抑制率/%凋亡率/%cyclin D1蛋白表达量p21蛋白表达量Bcl-2蛋白表达量
3.5 上调KTN1-AS1表达逆转紫甘薯花色苷对肺癌A549细胞增殖和凋亡的影响
与紫甘薯花色苷800 μg/ml+pcDNA组比较,紫甘薯花色苷800 μg/ml+pcDNA-KTN1-AS1组细胞抑制率、凋亡率及p21和Bax蛋白表达降低(P<0.05),KTN1-AS1及cyclin D1和Bcl-2蛋白表达升高(P<0.05)。见图4、表5。
表5 上调KTN1-AS1表达逆转紫甘薯花色苷对A549细胞增殖和凋亡及相关蛋白表达的影响(±s,n=9)
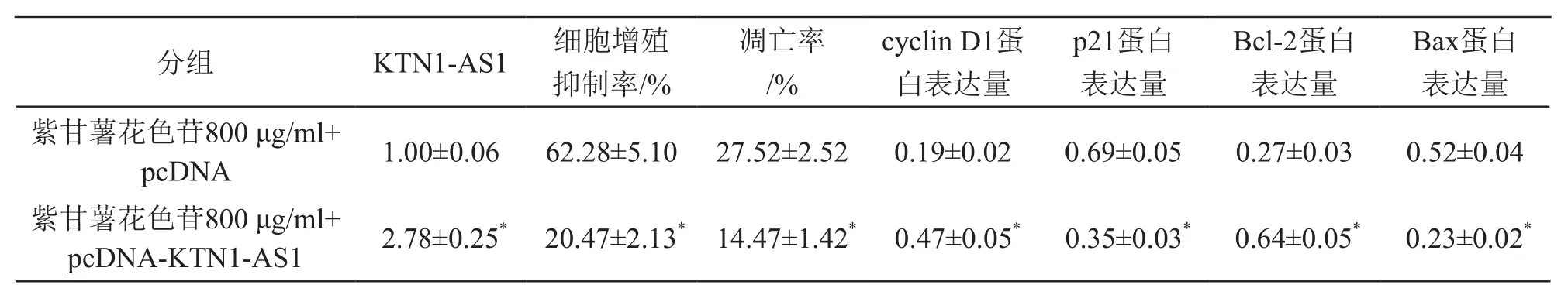
表5 上调KTN1-AS1表达逆转紫甘薯花色苷对A549细胞增殖和凋亡及相关蛋白表达的影响(±s,n=9)
注:*P<0.05 vs 紫甘薯花色苷800 μg/ml+pcDNA组
Bax蛋白表达量紫甘薯花色苷800 μg/ml+pcDNA 1.00±0.06 62.28±5.10 27.52±2.52 0.19±0.02 0.69±0.05 0.27±0.03 0.52±0.04紫甘薯花色苷800 μg/ml+pcDNA-KTN1-AS1 2.78±0.25* 20.47±2.13* 14.47±1.42* 0.47±0.05* 0.35±0.03* 0.64±0.05* 0.23±0.02*分组 KTN1-AS1 细胞增殖抑制率/%凋亡率/%cyclin D1蛋白表达量p21蛋白表达量Bcl-2蛋白表达量
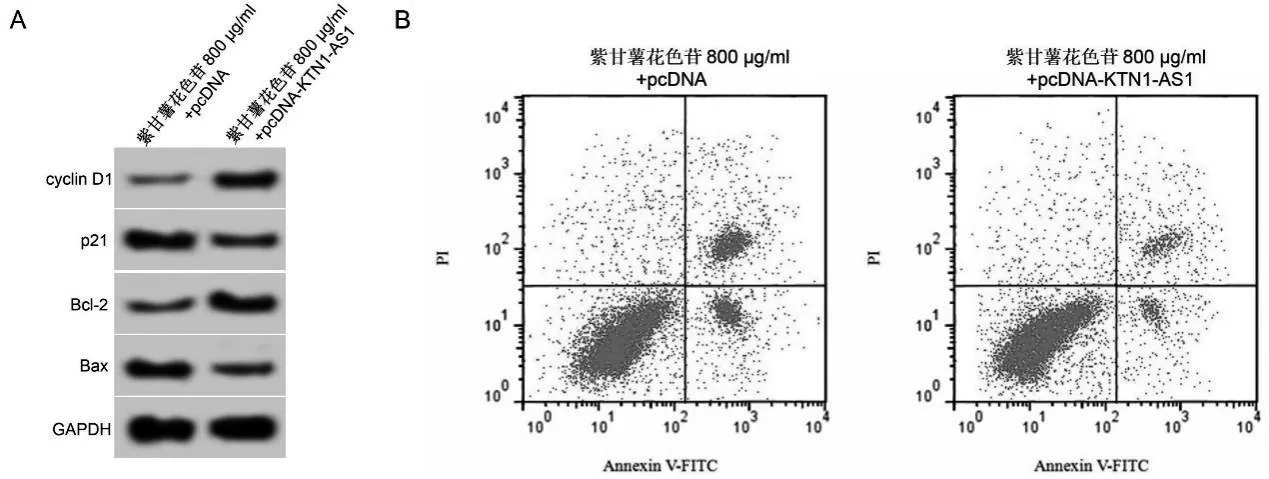
图4 上调KTN1-AS1表达逆转紫甘薯花色苷对A549细胞增殖和凋亡的影响
4 讨论
肺癌是世界范围内的常见肿瘤,具有较高的病死率,严重威胁人类生命健康。近年,肺癌的治疗取得了一定进展,但由于肺癌发病隐匿,多数患者确诊时已处于晚期,预后仍不佳。因此,寻找治疗肺癌的新方法尤为重要。紫甘薯花色苷是从紫甘薯中获得的天然色素,无毒、无异味,且性质稳定。研究显示,紫甘薯花色苷具有抑菌[9]、抗氧化[10]等功效。但目前,紫甘薯花色苷在抗肿瘤方面的研究还很少见。
正常细胞增殖和凋亡处于动态平衡,而恶性肿瘤细胞增殖和凋亡平衡被打破,细胞无限增殖而凋亡降低。cyclin D1可促进细胞周期由G1期进入S期,加速细胞增殖[11]。p21是一种肿瘤抑制因子,主要通过调控细胞周期维持细胞的生长和增殖[12]。本研究显示,紫甘薯花色苷可呈剂量依赖性降低肺癌A549细胞中cyclin D1蛋白表达,促进p21蛋白表达,说明其可有效抑制A549细胞增殖。诱导肿瘤细胞凋亡是抗癌药物发挥作用的一种途径。细胞的凋亡受多种基因的调控,抗凋亡蛋白Bcl-2和促凋亡蛋白Bax参与调控细胞凋亡[13]。Bcl-2主要位于线粒体膜和外膜,可通过抑制细胞色素C等促凋亡分子的释放抑制细胞凋亡[14]。Bax可改变线粒体通透性,诱导细胞色素C等促凋亡分子的释放,诱导细胞凋亡[15]。本研究显示,紫甘薯花色苷可剂量依赖性抑制提高A549细胞凋亡率及细胞中中Bcl-2蛋白表达,而促进Bax蛋白表达,表明紫甘薯花色苷可诱导肺癌A549细胞凋亡。这些结果表明紫甘薯花色苷在一定程度上具有抗肺癌的作用,具有开发为治疗肺癌药物的潜在价值。
lncRNA是一类参与调控细胞增殖、凋亡和分化等生命学过程的小分子非编码RNA,与人类肿瘤的发生发展密切相关[16-17]。研究显示,KTN1-AS1在肝癌组织中表达升高,其高表达的患者预后不良,下调其表达可抑制肝癌细胞增殖和集落形成,并促进细胞凋亡[18];KTN1-AS1在头颈部鳞状细胞癌(HNSCC)中表达升高,其促进HNSCC细胞增殖、迁移、侵袭和上皮间质转化,是HNSCC治疗的潜在分子靶标[19]。但KTN1-AS1对肺癌发生发展的影响还未知。本研究通过转染KTN1-AS1小干扰RNA下调KTN1-AS1表达后,A549细胞增殖能力降低,凋亡加剧,表明下调KTN1-AS1表达可抑制A549细胞增殖,并诱导细胞凋亡,提示KTN1-AS1可能作为促癌基因参与肺癌发生发展,是肺癌治疗的潜在分子靶点。本研究还显示,紫甘薯花色苷可剂量依赖性抑制肺癌A549细胞中KTN1-AS1表达,而上调KTN1-AS1表达则逆转了紫甘薯花色苷对A549细胞增殖的抑制作用及凋亡促进作用,提示紫甘薯花色苷可能通过下调KTN1-AS1表达来抑制A549细胞增殖,并诱导细胞凋亡。
综上,紫甘薯花色苷可剂量依赖性抑制肺癌A549细胞增殖,并诱导细胞凋亡,其可能通过下调细胞中KTN1-AS1表达发挥作用,可能为肺癌治疗药物的研发提供了新途径。
