大口黑鲈维氏气单胞菌的分离鉴定及其感染的病理损伤
2021-03-09邓龙君
邓龙君
(雅砻江流域水电开发有限公司,四川 成都 610051)
维氏气单胞菌(Aeromonasveronii)隶属气单胞菌科(Aeromonadaceae)气单胞菌属(Aeromonas),广泛分布于自然界中,有温和型(A.veroniibiovarsobria)和维罗纳型(A.veroniibiovarveronii)2个生物型[1],是一种可引起人、兽和水生生物共患的革兰氏阴性病原菌。现已证实,维氏气单胞菌可感染草鱼(Ctenopharyngodonidellus)[2]、中华鲟(Acipensersinensis)[3]、西伯利亚鲟(Acipenserbaeri)[4]、泥鳅(Misgurnusanguillicaudatus)[5]、花斑副沙鳅(ParabotiafasciataDabry)[6]、鲱形白鲑(Coregonusclupeaformis)[7]、黄颡鱼(Pelteobagrusfulvidraco)[8]、湘华鲮(SinilabeodecorusTungting)[9]、大黄鱼(Pseudosciaenacrocea)[10]、中华绒螯蟹(Eriocheirsinensis)[11]、凡纳滨对虾(Litopenaeusvannamei)[12]和大鲵(Andriasdavidianus)[13]等数十种海淡水鱼虾蟹类和两栖动物类水产养殖动物,常引起出血、腹水和溃疡等症状,造成巨大的经济损失。人食用了被维氏气单胞菌污染的水产品后,可引起胃肠炎和败血症等,甚至可导致免疫力低下者死亡[14]。
大口黑鲈(Micropterussalmoides)隶属鲈形目(Perciformes)太阳鱼科(Centrachidae)黑鲈属(Micropterus),原产于北美洲密西西比河水系,具有抗逆性强、适温性广、生长迅速、养殖周期短等优点,加之肉质鲜美、无肌间刺等特点[15],备受消费者青睐。自1983年引入我国以来,经多年人工养殖技术攻关与配合饲料的突破应用,大口黑鲈在我国南起广东、西至新疆、北达黑龙江等多个省份都有规模化养殖,并逐渐形成了繁育供苗、商品鱼养殖、饲料生产和食品加工等较为完善的产业链,已成为我国淡水养殖中最具前景的名优品种之一。随着养殖密度的不断增加、水体环境的恶化以及病原微生物的滋生传播,有关大口黑鲈疾病的报道日益增长。2019年9月,四川省某养殖场养殖的大口黑鲈发生以体表溃疡为特征的疾病,造成大量死亡。为明确其病因,对患病大口黑鲈进行病原菌分离鉴定,观察组织病理变化探究致病机制,药物敏感性试验筛选敏感药物,以期为大口黑鲈维氏气单胞菌病的科学诊断和有效防治提供参考。
1 材料和方法
1.1 试验动物
患病大口黑鲈,体质量150 g左右,采自四川省某养殖场;健康大口黑鲈,体质量180 g左右,购自四川省新津县某养殖场。
1.2 主要试剂
脑心浸液琼脂(Brain heart infusion,BHI)购自北京欣经科生物技术有限公司;MH培养基、LB培养基、LB营养肉汤、细菌生化微量鉴定管购自杭州微生物试剂有限公司;细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;TaqDNA聚合酶和DNA Marker (DL2 000)购自TaKaRa公司;药敏纸片购自杭州天和微生物试剂有限公司。
1.3 剖解特征与组织病理学观察
剖解病鱼,观察各组织器官的病理损伤情况,并取鳃丝、鳍条及体表黏液进行寄生虫检查。同时取患病鱼的肝脏、脾脏、肾脏、肠、鳃和肌肉等组织,经福尔马林固定,脱水、透明、石蜡包埋、切片、HE染色,中性树胶封片,在光学显微镜下观察组织损伤并拍照。
1.4 病原菌的分离与形态特征观察
在无菌条件下,从患病大口黑鲈的肝脏、脾脏、肾脏等组织取样,划线接种至BHI培养基,于28 ℃恒温培养24~48 h后,观察菌落生长形态、分布及一致性,然后挑取形状、大小、颜色均匀一致的优势单个菌落再次接种于LB培养基进行纯化培养,并观察菌落与细菌形态特征。纯化后的菌株于4 ℃下保存备用。
1.5 分离菌株生理生化特性及药敏试验
分离菌株的生理生化特性采用微量生化法测定,参照《常见细菌系统鉴定手册》[16]进行。药物敏感性试验采用K-B纸片琼脂扩散法测定。将分离菌株的单个菌落接种于LB营养肉汤,28 ℃振荡培养24 h,通过麦氏比浊法将菌液浓度调至1.5×108cfu/mL。将新鲜菌液用无菌棉签均匀涂布于MH平板,并贴上药敏纸片28 ℃培养24 h,测定抑菌圈的直径并判定敏感度。敏感度根据杭州微生物试剂有限公司提供的标准进行判定。
1.6 分离菌株16S rRNA基因序列测定及系统进化分析
取新鲜菌液于12 000 r/min离心2 min,按照细菌基因组DNA提取试剂盒操作说明提取DNA。采用16S rRNA的通用引物[17]进行PCR扩增。PCR反应程序:94 ℃预变性3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1.5 min,共34次循环;最后,72 ℃延伸5 min。取5 μL扩增产物经1%的琼脂糖凝胶电泳检测,将PCR产物送至成都擎科梓熙生物技术公司测序。将分离菌株的16S rRNA序列与GenBank数据库中已有气单胞菌属的序列进行BLAST比对,采用DNA Star软件进行多序列比对,并使用MEGA 7.1软件中的Neighbor-Joining方法构建系统发育树。
1.7 人工感染试验
将分离菌株接种于LB肉汤,28 ℃振荡培养24 h,参照麦氏比浊法调整菌液浓度至1.5×109、1.5×108、1.5×107、1.5×106C、1.5×105cfu/mL。健康大口黑鲈在水温(28±2) ℃中暂养7 d后,腹腔注射菌液0.2 mL/尾,每组10尾;对照组注射等量的无菌生理盐水。接种后每隔24 h观察大口黑鲈的临床表现并统计死亡情况,连续观察14 d。对感染后的病死鱼及时进行解剖,并进行细菌分离鉴定。
2 结果与分析
2.1 病鱼临床症状与剖解特征
发病的大口黑鲈临床症状主要表现为游动缓慢,食欲降低,甚至不摄食。病鱼背部或体侧出现溃疡,并伴有水霉着生(图1A、B)。剖检发现,部分病鱼鳃丝充血、出血,呈深红色(图1C);肝脏肿大,呈淡黄色或土黄色(图1D、E);脾脏、肾脏肿大(图1E、F),呈暗红色。鳃丝和体表黏液压片镜检未发现寄生虫。
2.2 病原菌分离及形态观察
从发病大口黑鲈的肝脏、脾脏、肾脏内分离获得1株优势菌株(编号为MYLY01),28 ℃培养24 h后,在LB培养基上形成表面光滑,中央突起,边缘完整,直径1~2 mm的白色圆形菌落。经革兰氏染色,分离菌株为两端钝圆,多数单个排列,无荚膜,无芽孢的革兰氏阴性短杆菌(图2)。
2.3 分离菌生理生化特性及药敏试验结果
分离菌株的主要生理生化特性见表1。由表1可知,分离菌株与维氏气单胞菌的生理生化特性基本一致,初步判定其为A.veronii。药敏试验结果显示,分离菌株对头孢呋辛、头孢他啶、多黏菌素B、新霉素、头孢噻呋钠、大观霉素、头孢拉啶、庆大霉素8种药物敏感;对四环素、复方新诺明、卡那霉素、阿莫西林、妥布霉素、多西环素、万古霉素、罗红霉素、克林霉素9种药物耐药(表2)。
2.4 分离菌人工感染试验结果
菌液浓度为1.5×109、1.5×108、1.5×107、1.5×106cfu/mL试验组的大口黑鲈在攻毒后第1天就表现出游动缓慢无力,鳍条出血等症状,第3天开始出现死亡;1.5×105cfu/mL试验组在攻毒后也出现不适反应,但未见死亡;整个试验期间对照组大口黑鲈未见异常。随着病情的发展,发病大口黑鲈的体表开始出现局部溃烂的典型症状。到试验期结束,各试验组死亡率分别为 100%、60%、30%、10%、0%。根据寇氏法计算可得分离菌株对健康大口黑鲈的LD50为4.79×108cfu/mL。对人工感染发病的大口黑鲈体内再次分离细菌,获得与分离菌株形态、理化特性及16S rRNA基因序列一致的菌株。
2.5 分离菌16S rRNA基因序列及系统发育分析
通过16S rRNA基因的通用引物扩增出1 500 bp的片段,纯化测序后提交NCBI获得登录号为SUB6567018。将16S rRNA基因序列与GenBank中已有气单胞菌属的序列进行BLAST比对,结果显示分离菌株MYHY01序列与A.veronii的同源性最高。在基于分离菌株的16S rRNA序列与数据库中已有气单胞菌属的序列建立系统进化树(图3),可判定该分离菌株为A.veronii。

表1 分离菌株MYHY01的生理生化特性Tab.1 Biochemical and physiological characteristics of the isolated strain MYHY01
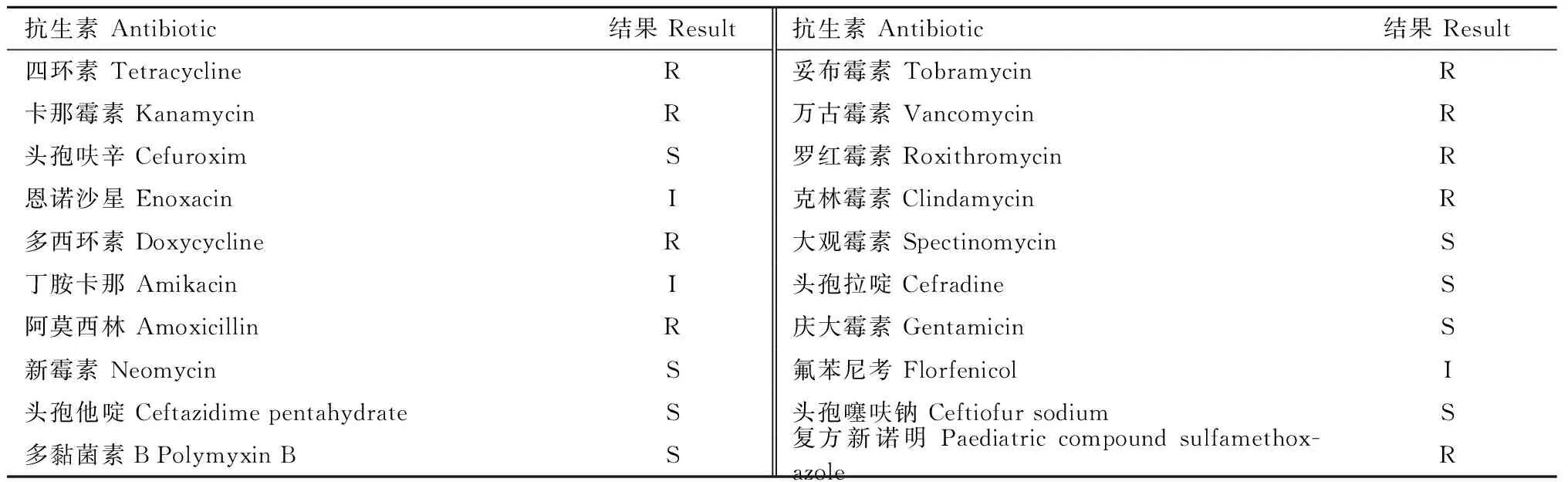
表2 分离菌株MYHY01的药敏试验结果Tab.2 Antibiotics sensitivities of the isolated strain MYHY01
2.6 患病大口黑鲈组织病理特征观察
病鱼肝脏肝细胞肿胀,颗粒变性、水泡变性,肝细胞索排列紊乱,肝血窦体积缩小(图4A)。脾脏淋巴细胞数量减少、坏死,黑素巨噬细胞中心明显,红髓淤血、出血(图4B)。肌纤维肿胀,排列紊乱,横纹消失,部分肌纤维溶解、断裂,炎症细胞浸润(图4C)。肾脏肾小管上皮细胞肿胀、变性、坏死,部分管腔内有均质红染的蛋白,形成管型;肾小球肿大,毛细血管扩张充血;肾间质疏松,造血组织细胞减少,巨噬细胞与中性白细胞浸润(图4D)。鳃小片上皮细胞肿胀,与毛细血管分离,毛细血管扩张、淤血、出血,鳃小片基部上皮下表增生,多量炎性细胞浸润(图4E)。皮肤真皮血管扩张淤血、出血,大量炎性细胞浸润(图4F)。
3 结论与讨论
气单胞菌(Aeromonassp.)感染在我国呈现广泛流行趋势,对水产养殖业造成严重危害。致病性气单胞菌分为3个复合群,即嗜水复合群、豚鼠复合群与温和复合群。嗜水复合群主要包括嗜水气单胞菌(A.hydrophila)和杀鲑气单胞菌(A.salmonicida)等,豚鼠复合群主要包括豚鼠气单胞菌(A.caviae)和中间气单胞菌(A.media)等,温和复合群主要包括温和气单胞菌(A.sobria)、维氏气单胞菌和简氏气单胞菌(A.jandaei)等[18]。维氏气单胞菌同嗜水气单胞菌、豚鼠气单胞菌被认为是气单胞菌中致病性最强的3种细菌,强致病性与其能产生气溶素、溶血素、肠毒素、胞外蛋白酶、鞭毛、菌毛、S层蛋白、脂多糖和外膜蛋白等多种毒力因子有关[19]。研究证实,维氏气单胞菌感染草鱼[2]和花斑副沙鳅[6]分别具有6种和4种毒力因子基因。但本试验并未对维氏气单胞菌毒力因子进行检测,有待进一步研究。维氏气单胞菌是一种人、兽和水生动物共患的条件致病菌,现已被国家列为食品和水体安全的检测对象[20],应引起人们广泛关注和高度重视。
维氏气单胞菌感染大口黑鲈剖解病变主要表现为体表溃疡,肝脏、脾脏与肾脏肿大;组织病理损伤主要表现为肌纤维呈波浪状、排列紊乱、肌纤维断裂、肌浆溶解,肝脏肝细胞肿胀、变性、坏死,脾脏淋巴细胞坏死、红髓出血,肾脏肾小管上皮细胞变性、坏死及肾间质大量炎性细胞浸润等,这与龙波等[21]报道的维氏气单胞菌感染加州鲈的病理损伤基本相同。但与维氏气单胞菌感染的其他宿主不尽相同,感染西伯利亚鲟引起心脏肿大,外表呈现凹凸不平的瘤状[4];感染中华绒螯蟹引起肝胰腺坏死[11];感染凡纳滨对虾引起软壳病,肝胰腺呈糊状[12];感染大鲵引起体表白斑、胃肠道出血[13]。维氏气单胞菌感染黄颡鱼[8]、中华绒螯蟹[11]、凡纳滨对虾[12]、金鱼[22]不同分离株的LD50分别为3.98×104、6.92×104、8.7×105、1.4×107cfu/mL,毒力均高于本研究中的分离菌株。由此可见,维氏气单胞菌感染在不同宿主间会引起不同的病理损伤,这可能与宿主的种属特异性和不同菌株的毒力差异有关,毒力差异又与毒力因子种类及其数量有关,毒力因子中的气溶素则被认为是感染鱼类出血现象的主要因子[23]。
本研究结果显示,维氏气单胞菌对头孢呋辛、大观霉素、新霉素、庆大霉素和多黏菌素B等药物敏感,但对卡那霉素、多西环素、复方新诺明等药物耐药。结合《水产养殖用药明白纸2019年2号》,推荐使用新霉素控制维氏气单胞菌感染疫情。本研究分离菌株的药敏试验结果与高彩霞等[2]、田甜等[3]、高通等[6]、龙波等[21]报道的维氏气单胞菌药敏试验结果存在差异,分析原因可能与不同菌株来源和不同地区的用药习惯有关。邓玉婷等[24]研究表明,广东主要水产养殖地区689株维氏气单胞菌对14种抗菌药物相对敏感,多重耐药率为1.74%;而耿昕颖等[25]研究表明,东北地区52株分离菌株中,多株对11种抗菌药物表现出5种多重耐药性,6—10重耐药分别达到了9.62%、21.15%、40.38%、15.38%、13.46%。因此,在药物选择上应根据国家渔业用药准则,筛选敏感药物科学用药,避免耐药菌株的产生。鉴于维氏气单胞菌对水产养殖业的严重危害,针对性的免疫预防也已受到科研工作者们的重视,先后开展了DNA疫苗[26]、菌影疫苗[27]、菌蜕疫苗[28]、灭活疫苗[29]等的研究;另有研究表明,使用肠道益生菌对控制维氏气单胞菌感染具有一定作用[30];同时也有研究表明,五倍子、黄连的水煎剂对维氏气单胞菌有抑制作用[31]。这些研究为水产养殖上维氏气单胞菌感染的有效防控提供了重要的技术支撑,但还需开展其耐药机制研究,以期控制维氏气单胞菌耐药性的进一步产生。
致谢:本研究得到了四川农业大学耿毅教授的大力帮助,在此表示衷心的感谢。
