石蒜碱药理活性及构效关系研究进展
2021-03-08曾炳麟潘显道
曾炳麟,赵 茹,潘显道,2*
1中国医学科学院北京协和医学院药物研究所,北京 100050;2山东达因海洋生物制药股份有限公司,荣成 264300
石蒜科植物是活性生物碱的重要来源之一,其作为传统的药用植物,在我国有着悠久的应用历史。石蒜碱(lycorine)于1877年首次从石蒜科植物洋水仙(Narcissuspseudonarcissus)中分离得到,现已发现其在石蒜科植物中有广泛的分布。至今,对它的研究持续了近150年[1]。石蒜碱属于异喹啉类生物碱,其结构如图1所示。石蒜碱之所以能获得持久的关注,主要是因为它独特的结构和丰富的药理活性。石蒜碱包含四个连续手性中心的刚性骨架使其结构确认进展缓慢。石蒜碱的药理作用包含了抗癌、抗病毒、抗寄生虫、抗菌、抗炎、抑制乙酰胆碱酯酶等活性。其结构修饰也具备多样性,首先是C1、C2位羟基的修饰,包括酯化、醚化、氧化成酮等;其次是3,4位的双键,包括环氧化、还原、双羟基化等;D环的主要变化是芳香化,消除原有的手性中心;E环的开环;A环的修饰包含开环和亚甲基上碳链的增长;另外7位亚甲基还可以氧化成羰基变为酰胺等等。近年来,越来越多的药理学和药物化学工作者将目光投向石蒜碱的药理作用机制和结构修饰研究,已有相关综述对其药理活性或者构效关系做了一定的总结[2-4],但石蒜碱药理活性丰富多样,作用机制复杂。随着石蒜碱的研究不断深入,有必要对石蒜碱的机制研究和化学修饰进行更深入而系统地了解。本文着眼于不断更新的研究成果,对石蒜碱的药理活性及作用机制做了全面的阐述,并与构效关系一一对应,以期为石蒜碱相关的药物开发工作提供便利。
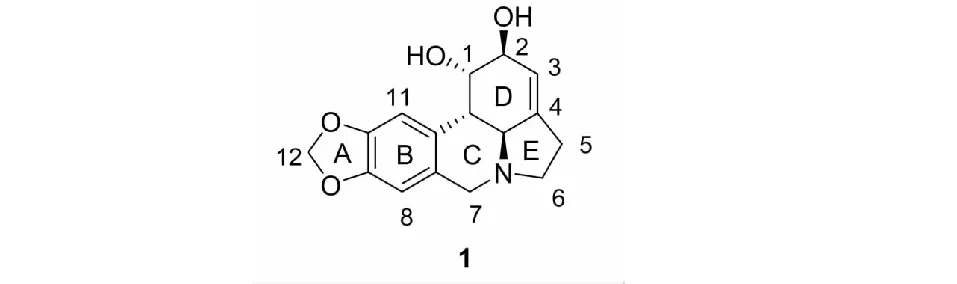
图1 石蒜碱的化学结构Fig.1 The chemical structures of lycorine
1 抗癌作用
1.1 药理活性及作用机制
石蒜碱是最早从石蒜科植物中分离得到的具有细胞毒的天然产物之一[5]。近年来,石蒜碱的抗癌效果得到愈加广泛和深入的研究。其抗癌活性包含以下的特征:(1)抗癌谱广:体内外实验表明,石蒜碱对多种癌症有较好的抑制活性,包括白血病、多发性骨髓瘤、前列腺癌、乳腺癌、膀胱癌、卵巢癌、非小细胞肺癌、大细胞肺癌、结肠癌、肝癌、黑色素瘤和胶质瘤、骨肉瘤等[6-14],且IC50值通常低于7.5 μM。(2)选择性好,毒性小:石蒜碱在有效浓度时,对正常细胞的毒性很小,同时在小鼠模型中,5~20 mg/kg/d的石蒜碱不引起明显的体重改变[3,15-18],且HE染色法结果显示实验结束后正常组织无明显病理学改变[19]。(3)抗耐药癌细胞:石蒜碱对一些具有耐药性以及对诱导凋亡化合物不敏感的癌细胞展示出较好的抑制活性,例如对阿霉素有耐药性的癌细胞[20]、耐各种促凋亡剂的多形性胶质瘤细胞U373和小细胞肺癌细胞A549[6]。
石蒜碱的抗癌特性和它的抗癌机制是分不开的。其抗癌机制主要体现在以下几个方面:(1)促凋亡:石蒜碱既能通过线粒体依赖的内源途径(mitochondria-dependent intrinsic pathway),也能通过死亡受体介导的外源途径(death receptor-dependent extrinsic pathway)来诱导癌细胞凋亡[4]。(2)阻滞细胞周期:根据细胞的不同,石蒜碱可以调节细胞周期蛋白(cyclins)和细胞周期蛋白依赖性激酶(CDK)将细胞周期阻滞于G0/G1或G2/M期。(3)调节细胞自噬:在多发性骨髓瘤细胞ARP-1和ANBL6中,石蒜碱可以下调高迁移率族蛋白B1(HMGB1,high-mobility group box-1)的表达最终达到抑制细胞自噬的效果[16]。同时有研究表明,石蒜碱也能通过激活细胞自噬来参与抗肿瘤作用。(4)上调抑癌基因的表达:近来有研究表明,SAV1(Salvador homolog-1)在Hippo通路中是重要的抑癌因子,在很多癌细胞中SAV1基因的表达会被下调,且SAV1的缺陷与肿瘤预后较差相关,而石蒜碱可以通过纠正SAV1的缺失起到抗肺癌的效果[21]。(5)调节相关信号通路获得抗耐药性:Wnt/β-catenin信号通路的激活对于多发性骨髓瘤干细胞样细胞的耐药性至关重要,石蒜碱可通过抑制这一通路起到抗耐药的作用[22]。(6)其他:石蒜碱还具有引发程序性坏死[23],抑制肿瘤转移侵袭[4]和抗肿瘤血管生成[24]的作用。
石蒜碱的各种抗肿瘤作用机制是协同作用的,其中研究最多的是诱导凋亡和调节自噬之间的关系。石蒜碱可以下调HMGB1的表达,从而抑制ERK1/2的磷酸化,进而抑制了Bcl-2的磷酸化,使得Bcl-2与Beclin-1形成的复合物不易解离,削弱了Beclin-1和PI3K-III形成复合物从而激活自噬的能力,最终达到抑制自噬的目的[16,25,26],而HMGB1也能激活AMPK/mTOR通路来抑制自噬[26]。值得注意的是,HMGB1本身在肿瘤细胞中具有抗凋亡的作用[27]。在肝细胞性肝癌细胞中,石蒜碱下调TCRP1的表达进而抑制Akt/mTOR通路,诱导细胞自噬和凋亡,其诱导的自噬可能是细胞凋亡中的暂时保护机制[28]。亦有研究表明石蒜碱对Akt磷酸化的抑制作用参与了诱导凋亡[18]。在人结肠癌细胞HCT116中,石蒜碱通过激活AMPK/mTOR信号通路引发细胞自噬,抑制自噬可以增强石蒜碱的促凋亡作用[29]。同样在人结肠癌细胞中,有研究发现石蒜碱在MAPK/ERK通路中可能直接作为MEK2的抑制剂发挥诱导细胞自噬的作用,从而引发自噬协助的细胞凋亡[30]。细胞凋亡和自噬之间的平衡对肿瘤的发生发展以及治疗至关重要,石蒜碱对肿瘤细胞自噬和凋亡的调节机制以及相互影响仍需进一步研究。目前来看,在不同癌细胞中石蒜碱诱导凋亡的能力都得以体现,但对细胞自噬则通过调节HMGB1和mTOR上游通路起到了不同作用。详见图2(A:石蒜碱在多发性骨髓瘤(MM)细胞中通过下调HMGB1抑制自噬,诱导凋亡;B:石蒜碱在人直肠癌(CRC)细胞和肝细胞性肝癌(HCC)细胞中通过调节mTOR上游通路激活自噬,诱导凋亡)。

图2 石蒜碱在不同癌细胞中通过不同通路调节细胞凋亡和自噬平衡Fig.2 Lycorine regulates the balance between apoptosis and autophagy in different cancer cell lines
目前,石蒜碱直接作用的抗癌靶点尚不明确,推测其靶点有可能是Bcl-2蛋白家族中的Mcl-1、 CDK抑制剂家族中的重要成员p21蛋白[4]、MAPK/ERK/mTOR信号通路中的重要激酶MEK2[30]以及表皮生长因子受体(EGFR)[13]。
1.2 构效关系
对石蒜碱抗癌活性构效关系的研究涉及了大部分的修饰位点。首先,C1、C2位的醚化衍生物中,无论是单独醚化C2位还是两羟基全部成醚,在MTT筛选中活性均呈下降趋势。醚化衍生物抗癌活性的重要影响因素是亲油性,clogP在-1到1之间时,GI50的平均值一般大于50 μM;clogP >1时,GI50保持在7.1~38.4 μM(石蒜碱GI50平均值为4.6 μM)。其中表现较好的化合物2(GI50平均值为7.1 μM)和3(GI50平均值为9.2 μM)[31],结构见图3。C1位成烯丙醚,C2位引入三异丙基硅醚的化合物4抗癌活性和石蒜碱持平(GI50平均值为4.5 μM)。而另一文献中,双烯丙醚衍生物5的GI50平均值达到3 μM,对胶质瘤细胞U373的GI50值更是达到0.03 μM,抗癌活性是石蒜碱的100倍[32]。可见在醚化衍生物中,含烯丙基的基团为优势片段。C1、C2位的酯化衍生物中,双酯化和选择性酯化C1位或C2位的化合物,对不同细胞的抗癌活性有不同程度的下降[32,33]。C2位成酮的化合物6活性下降较多,C1、C2位形成α环氧结构的化合物7对癌细胞和正常细胞的细胞毒性都增加,治疗指数下降[6]。C2位羟基可被氯原子取代(化合物8),活性提高,治疗指数与石蒜碱相当[6],但若在此基础上C1位被乙酰基取代(化合物9),则活性消失[33]。
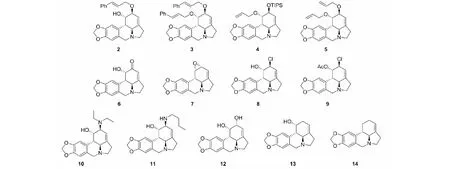
图3 石蒜碱衍生物2~14的化学结构Fig.3 The chemical structures of compounds 2-14
C2位还可以被含N原子的基团取代,活性均下降,叔胺的结构(化合物10)和仲胺的结构(化合物11)相比活性无显著差异,故而推测此处羟基主要扮演氢键受体的角色[33]。C2位构型翻转的化合物12、C2位羟基消去的化合物13以及C1、C2位羟基均消去的化合物14,抗癌活性都消失[6]。C1、C2位的反式邻二羟基对于石蒜碱的抗癌活性来说应是必须基团,可修饰的策略很少。
石蒜碱C3,C4位的双键还原(化合物15)、形成环氧(化合物16)以及双羟基化(化合物17)活性均消失[6,32,33],可见双键是活性必须基团,结构见图4。C7位氧化成羰基形成酰胺(化合物18)后活性消失,可见三级烷胺的结构特征是抗癌活性必须的[6]。在石蒜碱的骨架变化中,D环芳香化(化合物19)活性基本保持,B环和D环芳香化的同时打开E环得到化合物20,活性下降较多[31]。伪石蒜碱(化合物21)是石蒜碱A环打开的类似物,活性保持[6]。石蒜碱抗癌活性构效关系的总结见图5。
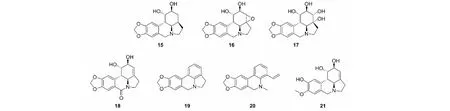
图4 石蒜碱衍生物15~21的化学结构Fig.4 The chemical structures of compounds 15-21

图5 石蒜碱抗癌活性构效关系总结Fig.5 Structure-activity relationship of lycorine against cancers
2 抗病毒作用
2.1 药理活性及作用机制
体内外实验表明石蒜碱有广谱的抗病毒活性,包括单纯疱疹病毒[34]、逆转录病毒HIV-1[35]、冠状病毒SARS-CoV[36]、脊髓灰质炎病毒(PV)[37]、 西尼罗河病毒(WNV)、登革热病毒、黄热病病毒[38]、肠道病毒EV71[39]、流感病毒[40]、丙肝病毒[41]和寨卡病毒[42]。近来有研究表明,石蒜碱对于SARS-CoV-2也有较好的抑制活性,其EC50为0.31 μM,CC50大于40 μM[43]。石蒜碱通过干扰病毒DNA合成和抑制DNA聚合酶活性表现出较好的抗带状疱疹病毒(HSV-1)作用[34]。针对脊髓灰质炎病毒(PV),石蒜碱通过抑制TNF-α的产生阻止病毒复制[37]。西尼罗河病毒NS4A和NS4B蛋白中2K肽段中一个氨基酸的突变可以引起对石蒜碱的耐药作用,提示其可能为石蒜碱直接作用靶点[38]。石蒜碱在5 mg/kg和10 mg/kg的给药量时对寨卡病毒引起的小鼠病理学损伤有明显的减轻,1 mg/kg的给药量下未见明显效果,石蒜碱可以与寨卡病毒的非结构性蛋白NS5结合,降低其C端RdRp与宿主细胞作用形成复制酶复合体的活性,达到抗病毒的效果[42]。
体内实验发现,石蒜碱对EV71病毒蛋白的C端蛋白合成抑制作用比N端蛋白的抑制作用更显著,阻断EV71病毒蛋白的合成,从而抑制EV71的复制,相较于利巴韦林50 mg/kg给药量将小鼠存活率提升至12%,石蒜碱0.4 mg/kg的给药量即能将存活率提升至45%[39]。石蒜碱的1位酯化衍生物对EV71同样表现出良好的抑制活性,结构见图6。通过突变引起的耐药性实验证明,1位乙酰基取代的石蒜碱衍生物(1-Acetyllycorine,22)靶向EV71的病毒蛋白酶2A(2Apro)上的苯丙氨酸(F76),稳定其独特锌指(zinc finger)的构象,进而抑制病毒复制。1-Acetyllycorine对HCV的抗病毒作用机制与之类似,HCV的NS3蛋白上精氨酸(R118)所处环境与EV71 2Apro(F76)相似,其突变也能引起对1-acetyllycorine的耐药性[44]。另本课题组设计合成的1位酯化衍生物LY55(23),则通过抑制EV71和柯萨奇病毒CVA16诱导的细胞自噬来抑制病毒复制,降低致死性EV71感染小鼠的病死率,1.5 mg/kg的给药量可将小鼠存活率提升至50%[45]。石蒜碱既能通过靶向病毒蛋白,也能调节宿主细胞的生理过程,可能是其抗病毒谱广的原因之一。

图6 石蒜碱衍生物22~33的化学结构Fig.6 The chemical structures of compounds 22-33
2.2 构效关系
石蒜碱具有抗病毒谱广的特点,针对石蒜碱衍生物抗病毒活性的研究往往聚焦于一到两种病毒。在针对抗登革热病毒的研究中[46],C1位乙酰化后的衍生物22选择性指数(CC50/EC50)SI >750,超过石蒜碱24倍(石蒜碱SI为31.4),这主要得益于毒性的大幅降低,其CC50>300 μM,相较于石蒜碱的25.1 μM,毒性降低超过12倍,同时其EC50为0.4 μM,是石蒜碱的一半,活性也有所提升。选择性对C2位进行酯化(化合物24)或引入硅醚保护基(化合物25)SI降低较多。C1位乙酰化和C2位不同酯基取代的衍生物(如化合物26),抗登革热活性大幅下降,虽说毒性降低很多,但EC50升高太多。C2位氧化成酮(化合物6)抗登革热潜力也增加,SI(113.2)约为石蒜碱的4倍。在C2位氧化成酮的基础上C1位乙酰化形成化合物27后SI(>166.7)进一步提高,虽说化合物27的EC50略微升高,但毒性降低更多。而若是将C1位的乙酰基变为碳链更长、位阻更大的脂肪酯基或芳香酯基,伴随着EC50的进一步升高,抗登革热活性损失较多。C1、C2位环氧后(化合物7)活性降低。在C1位乙酰化的基础上,C2位用含氮基团取代(化合物28~30)或构型翻转(化合物31、32)的衍生物活性均明显降低。石蒜碱A环亚甲基上碳链增长(如化合物33)抗登革热活性消失。
针对抗丙肝病毒HCV的研究中[41],C1、C2位的酯化修饰带来的活性改变和抗登革热不同,选择性对C1或C2位乙酰化(化合物22和24)SI均有所下降,双乙酰化后(化合物26)SI提高1.5倍。C2位氧化成酮的化合物6同时降低了EC50和升高了CC50,SI(76.9)提升约为石蒜碱(SI为19)的四倍,在此基础上C1位成醚得到的衍生物(化合物34~36)活性保持。C7位亚甲基氧化为羰基的化合物18的SI小于5,活性基本消失。A环打开的衍生物(化合物37和38)SI也略有提升。将石蒜碱的D环芳香化同时打开A环和E环得到一类新的菲啶类衍生物[47],两酚羟基裸露时(化合物39和40)活性无显著变化,在化合物39的基础上通过醚键或酯键在酚羟基上引入特定基团可使SI提升较多(化合物41和42),在化合物40的基础上,酚羟基成醚接短链脂肪烃(化合物43)或取代芳烃(化合物44)活性提高7~20倍,接不同酯基(如化合物45和46)活性提高2~10倍。此类化合物作用机制与“2.1”中所述化合物22不同,是通过下调宿主细胞内Hsc70来抑制病毒复制的。
基于可见的细胞病变作用(visible CPE)对石蒜碱衍生物进行抗EV71筛选后发现[44],除化合物22表现良好外,C1、C2位的其他酯化方式,C2位含氮基团的取代、硅醚基团保护、氯代(化合物47),C1、C2位环氧化(化合物7),C3,C4位环氧化(化合物48)以及A环亚甲基上碳链的增长都使得活性下降,结构见图7。

图7 石蒜碱衍生物34~48的化学结构Fig.7 The chemical structures of compounds 34-48
石蒜碱抗病毒活性构效关系总结见图8。
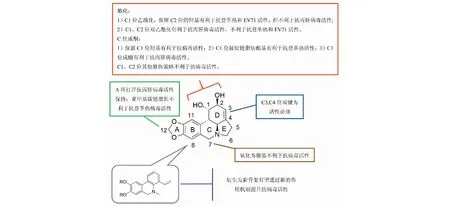
图8 石蒜碱抗病毒活性构效关系总结Fig.8 Structure-activity relationship of lycorine against viruses
3 抗寄生虫作用
3.1 药理活性及作用机制
石蒜碱是抗恶性疟原虫、蓖麻三叶虫和棉蚜的最有效的生物碱之一[48]。石蒜碱可以降低阴道毛滴虫核苷三磷酸二磷酸水解酶(NTPDase)和ecto-5'-核苷酸酶的活性,并且可以阻滞细胞周期,但并非典型的促凋亡作用[49]。同时,石蒜碱对寄生虫细胞生长所需的DNA拓扑异构酶I(TOP I)活性具有显著抑制作用[4]。石蒜碱对恶性疟原虫F32的IC50值为0.13 μM[50],一系列的石蒜碱衍生物在具有耐药性的K1株中也显示有一定的抑制活性[51]。针对石蒜碱的抗寄生虫作用的研究相对较少,其作用机制和药理活性有待进一步研究。
3.2 构效关系
石蒜碱各种衍生物抗恶性疟原虫的活性相较于石蒜碱来说都有不同程度的下降,能将IC50保持在1 μM以下的包括:C1位乙酰化(化合物22)、C1、C2位双酯化(如化合物26和49)以及D环芳香化的同时打开A环和E环的菲啶骨架衍生物(化合物50和51)。其余诸如C2位氧化成酮(化合物6)、C3,C4位双键还原(化合物52)、C7位亚甲基氧化成羰基(化合物18)、A环打开(化合物53)、同时芳香化D环和打开E环(化合物20)等策略均导致活性下降较多[50]。有文献报道从石蒜植物提取到的新衍生物LT1(化合物54)也显示出一定的抗疟原虫活性,在一系列C1,C2位的酯化衍生物中,双丁酰化(化合物55)使活性有少许提高[51],结构见图9。

图9 石蒜碱衍生物49~55的化学结构Fig.9 The chemical structures of compounds 49-55
4 抑制乙酰胆碱酯酶的药理活性及构效关系
阿尔茨海默病(AD)是一种神经退行性疾病,具有不可逆性,会引起认知障碍和智力障碍。AD患者表现出脑胆碱能功能障碍,特别是乙酰胆碱(ACh)水平低,而乙酰胆碱酯酶(AChE)是降解ACh的酶。因此,抑制AChE可以使大脑ACh免受降解,从而成为治疗AD的策略。AChE抑制剂加兰他敏是从石蒜科植物中分离到的一种生物碱,目前已应用于临床治疗轻度至中度的阿尔茨海默病。多种石蒜科植物分离得到的生物碱表现出AChE抑制活性[52]。尽管在这之中石蒜碱抑制AChE的能力相对较弱(IC50为213±1 μM),但其结构类似的天然产物和化学修饰的衍生物中,均出现活性较好的AChE抑制剂[48,53]。C1位引入苯甲酰基、C2位引入TBS保护基(化合物25、56、57)均可使其IC50降至1 μM以下。A环打开(化合物58)活性有略微的提升(IC50为63.1±1.1 μM)。D环芳香化的同时打开A环的化合物59为生物碱assoanine,活性提升较多。D环芳香化的同时打开E环(化合物20和60)活性也得到理想的提升。但若仅仅打开E环(化合物61)则抑制乙酰胆碱酯酶的活性基本消失,结构见图10。

图10 石蒜碱衍生物56~61的化学结构Fig.10 The chemical structures of compounds 56-61
5 抗炎作用
石蒜碱在多种动物模型中显示出抗关节炎活性,同时可以降低有促炎症因子作用的钙网蛋白带来的细胞毒性[54]。石蒜碱可以通过抑制p38的表达和激活STATs,来降低因脂多糖(LPS,lipopolysaccharide)诱导而上升的RAW264.7细胞内环氧合酶(COX-2)蛋白和诱导型一氧化氮合酶(iNOS)蛋白的水平,同时抑制多种炎症介质的释放,如NO、PGE2、TNF-α和IL-6,但又不影响NF-κB信号通路[55]。石蒜碱在1.0~ 2.0 mg/kg的剂量时对小鼠表现出良好的抗炎活性,进而还能起到镇痛效果,其原因之一是石蒜碱具有自由基清除的功能[56]。近来有研究表明,石蒜碱通过调节mROS/TRPML1/TFEB,减弱了破骨细胞的自噬,从而降低了LPS诱导发生的炎症性骨丢失[57]。目前,关于石蒜碱抗炎活性的研究相对较少,可通过筛选其衍生物的抗炎活性,进一步探讨其构效关系和抗炎作用机制。
6 其他药理作用
石蒜碱具有中等的抑制DNA拓扑异构酶I(TOP I)的活性[58],值得注意的是,TOP I作为宿主因子能够参与EV71病毒RNA的复制和蛋白的合成[59]。石蒜碱能够抑制酿酒酵母的生长,该作用依赖线粒体DNA[60]。石蒜碱可以抑制NF-κB配体诱导的破骨细胞生成,预防卵巢切除手术造成的骨质疏松和钛颗粒诱导的骨质溶解,其作用机制包含下调p38、JNK和ERK信号通路,潜在靶点为MKKs[61]。石蒜碱还拥有抗菌活性,近来有实验证明其对多个菌株表现出较好的抑制效果,例如其对金黄色葡萄球菌的MIC低于氨苄西林[62]。但在此之前,也有研究表明石蒜碱对金黄色葡萄球菌几乎无抑制活性[63]。石蒜碱还显示出应用于心血管疾病的潜力,譬如其在体内外均对心脏纤维化和舒张功能障碍有疗效[64]。在血液系统中,石蒜碱也能促进发育过程中造血干细胞和祖细胞与微环境的相互作用,最终帮助干细胞库扩展至成年期[65]。此外,石蒜碱还具有保肝、抑制蛋白合成、抑制抗坏血酸合成等生物活性[61]。
7 总结与展望
我国有丰富的石蒜属野生品种,在石蒜碱的开发利用上占据优势。石蒜碱作为含有三级胺的生物碱,易成盐增加水溶性也是其重要优势。目前,针对石蒜碱的药理活性及作用机制的研究取得了长足的进展,但靶点不明阻碍了其进一步开发。针对石蒜碱结构修饰及构效关系的研究也较为充分,但囿于其可修饰位点较少,骨架变动较难,新的结构和化学修饰策略仍需进一步研究。石蒜碱的靶点探究和结构修饰是相辅相成的,靶点一旦明确即可充分利用现代计算机辅助和人工智能技术,指导结构修饰;而活性明确单一的衍生物也能成为探明靶点的有效工具。对石蒜碱的研究和开发,仍需科研工作者的不懈努力。
